Provigil: Herätysherkkyys (täydelliset lääkemääräykset)
Tuotemerkki: Provigil
Yleinen nimi: Modafinil
Sisällys:
Kuvaus
farmakologia
Kliiniset polut
Käyttöaiheet ja käyttö
Vasta
varoitukset
varotoimet
Haitalliset reaktiot
Huumeiden väärinkäyttö ja riippuvuus
yliannostus
Annostelu ja hallinnointi
Kuinka toimitetaan
Provigilin (modafiniili) potilastiedot (selkeästi englanniksi)
Kuvaus
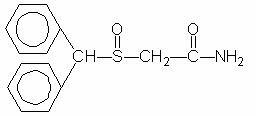
Provigili (modafiniili) on herkkyyttä edistävä aine suun kautta annettavaksi. Modafiniili on raseeminen yhdiste. Modafiniilin kemiallinen nimi on 2 - [(difenyylimetyyli) sulfinyyli] asetamidi. Molekyylikaava on C15H15NO2S ja molekyylipaino on 273,35.
Kemiallinen rakenne on:
Modafiniili on valkoinen tai luonnonvalkoinen kiteinen jauhe, joka on käytännössä liukenematon veteen ja sykloheksaaniin. Se on heikosti liukoinen metanoliin ja asetoniin. Provigil-tabletit sisältävät 100 mg tai 200 mg modafiniiliä ja seuraavia inaktiivisia aineosia: laktoosia, mikrokiteinen selluloosa, esigelatinoitu tärkkelys, kroskarmelloosinatrium, povidoni ja magnesium stearaattia.
ylin
Kliininen farmakologia
Toimintamekanismi ja farmakologia
Tarkkaa mekanismia, jonka kautta modafiniili edistää herkkyyttä, ei tunneta. Modafiniilillä on heräämistä edistäviä vaikutuksia, jotka ovat samanlaisia kuin sympatomimeettiset aineet, kuten amfetamiini ja metyylifenidaatti, vaikkakin farmakologinen profiili ei ole identtinen sympatomimeettisten amiinien kanssa.
Modafiniilillä on heikkoa tai vähäistä vuorovaikutusta norepinefriinin, serotoniinin, dopamiinin, GABA: n, adenosiinin, histamiini-3: n, melatoniinin ja bentsodiatsepiinien reseptoreiden kanssa. Modafiniili ei myöskään estä MAO-B: n tai fosfodiesteraasien II-V aktiivisuutta.
Modafiniilin indusoimaa herkkyyttä voidaan heikentää Î ± 1-adrenergisen reseptorin antagonisti pratsosiinilla; modafiniili on kuitenkin inaktiivinen muissa in vitro -määritysjärjestelmissä, joiden tiedetään reagoivan Î ± -adrenergisiin agonisteihin, kuten rotan vas-deferenssivalmiste.
Modafiniili ei ole suoran tai epäsuoran vaikutuksen omaava dopamiinireseptoriagonisti. Kuitenkin in vitro modafiniili sitoutuu dopamiinin kuljettajaan ja estää dopamiinin takaisinottoa. Tämä aktiivisuus on liitetty in vivo lisääntyneisiin solunulkoisiin dopamiinitasoihin eläinten joillakin aivoalueilla. Geeniteknisissä hiirissä, joissa ei ollut dopamiinin kuljettajaa (DAT), modafiniilillä puuttui herättä edistävää aktiivisuutta, mikä viittaa siihen, että tämä aktiivisuus oli DAT-riippuvainen. Dopamiinireseptorin antagonisti haloperidoli ei kuitenkaan antagonistanut rotilla modafiniilin herättävää vaikutusta, toisin kuin amfetamiini. Lisäksi alfa-metyyli-p-tyrosiini, dopamiinisynteesin estäjä, estää amfetamiinin vaikutusta, mutta ei estä modafiniilin indusoimaa liikunta-aktiivisuutta.
Kissassa yhtä suuret herkkyyttä edistävät metyylifenidaatin ja amfetamiinin annokset lisäsivät hermostoa aktivoitumista koko aivoissa. Modafiniili vastaavalla herkkyyttä edistävällä annoksella lisäsi selektiivisesti ja näkyvästi hermosolujen aktivaatiota aivojen erillisemmillä alueilla. Tämän kissien havainnon yhteyttä modafiniilin vaikutuksiin ihmisissä ei tunneta.
Heräämistä edistävien vaikutusten ja kyvyn lisätä liikkuvuutta eläimissä lisäksi modafiniili tuottaa psykoaktiiviset ja euforiset vaikutukset, mielialan, havainnon, ajattelun ja tunteiden muutokset, jotka ovat tyypillisiä muille keskushermoston stimulantteille ihmisillä. Modafiniilillä on vahvistavia ominaisuuksia, mikä ilmenee sen itsensä antamisesta apinoilla, jotka on aikaisemmin koulutettu kokaiinin itsehallintoon. Modafiniili erotettiin myös osittain stimulantin kaltaisesta.
Modafiniilin optisilla enantiomeereillä on samanlaiset farmakologiset vaikutukset eläimissä. Kaksi tärkeintä modafiniilin metaboliittia, modafiniilihappo ja modafiniilisulfoni, eivät näytä edistävän modafiniilin keskushermostoa aktivoivia ominaisuuksia.
farmakokinetiikkaa
Modafiniili on raseeminen yhdiste, jonka enantiomeereillä on erilainen farmakokinetiikka (esim. L-isomeerin puoliintumisaika on noin kolme kertaa d-isomeerin puoliintumisaika aikuisilla ihmisillä). Enantiomeerit eivät muunna toisiaan. Vakaassa tilassa kokonaisaltistus l-isomeerille on noin kolme kertaa d-isomeerin altistuminen. Lämpötilan pitoisuus (Cminss) kiertävän modafiniilin osuus kerran päivässä annon jälkeen koostuu 90% l-isomeeristä ja 10% d-isomeeristä. Modafiniilin tehokas eliminaation puoliintumisaika useiden annosten jälkeen on noin 15 tuntia. Modafiniilin enantiomeereillä on lineaarinen kinetiikka annettaessa useita kertoja 200-600 mg / päivä kerran päivässä terveille vapaaehtoisille. Modafiniilin kokonaismäärän ja l - (-) - modafiniilin näennäinen vakaa tila saavutetaan 2 - 4 päivän annon jälkeen.
imeytyminen
Provigil-tabletit imeytyvät nopeasti, huippupitoisuudet plasmassa saavutetaan 2 - 4 tunnissa. Provigil-tablettien hyötyosuus on suunnilleen yhtä suuri kuin vesisuspension. Absoluuttista oraalista hyötyosuutta ei määritetty johtuen modafiniilin vesiliukoisuudesta (<1 mg / ml), joka esti suonensisäisen annon. Ruoalla ei ole vaikutusta Provigilin yleiseen hyötyosuuteen; sen imeytyminen (tmax) voi viivästyä noin tunnilla, jos otetaan ruuan kanssa.
Jakelu
Modafiniili jakautuu hyvin kehon kudoksiin, ja sen näennäinen jakautumistilavuus (~ 0,9 l / kg) on suurempi kuin kehon kokonaisveden tilavuus (0,6 l / kg). Ihmisen plasmassa in vitro modafiniili sitoutuu kohtalaisesti plasmaproteiiniin (~ 60%, pääasiassa albumiiniin). Seerumikonsentraatioissa, jotka saatiin vakaan tilan ollessa 200 mg / päivä annosten jälkeen, modafiniili ei osoita varfariinin, diatsepaamin tai propranololin sitoutumista proteiineihin. Jopa paljon suuremmissa konsentraatioissa (1000 uM; > 25 kertaa Cmax 40 µM vakaan tilan ollessa 400 mg / päivä), modafiniilillä ei ole vaikutusta varfariinin sitoutumiseen. Modafiniilihappo pitoisuuksilla> 500 uM vähentää varfariinin sitoutumisastetta, mutta nämä pitoisuudet ovat yli 35-kertaiset terapeuttisesti saavutettuihin.
Aineenvaihdunta ja eliminaatio
Tärkein eliminaatioreitti on metabolia (~ 90%) pääasiassa maksassa, minkä jälkeen metaboliitit eliminoituvat munuaisten kautta. Virtsan alkalisoinnilla ei ole vaikutusta modafiniilin eliminaatioon.
Metabolia tapahtuu hydrolyyttisen deamidaation, S-hapettumisen, aromaattisen renkaan hydroksyloinnin ja glukuronidikonjugaation avulla. Alle 10% annetusta annoksesta erittyy emäyhdisteeksi. Radioaktiivisella leimatulla modafiniilillä käytetyssä kliinisessä tutkimuksessa todettiin yhteensä 81% annetusta radioaktiivisuudesta 11 päivän kuluessa annoksen jälkeen, pääasiassa virtsassa (80% vs. 1,0% ulosteessa). Suurin osa lääkkeestä virtsassa oli modafiniilihappoa, mutta ainakin kuutta muuta metaboliittia oli läsnä alhaisemmissa pitoisuuksissa. Vain kaksi metaboliittia saavuttaa huomattavia konsentraatioita plasmassa, ts. Modafiniilihappo ja modafiniilisulfoni. Prekliinisissä malleissa modafiniilihappo, modafiniilisulfoni, 2 - [(difenyylimetyyli) sulfonyyli] etikkahappo ja 4-hydroksimodafiniili olivat inaktiivisia tai niiden ei näyttänyt välittävän modafiniilin kiihtyviä vaikutuksia.
Aikuisilla monien viikkojen annon jälkeen on joskus havaittu modafiniilin vähimmäistasojen laskua, mikä viittaa siihen auto-induktio, mutta laskujen suuruus ja niiden esiintymisen epäjohdonmukaisuus viittaavat niiden kliiniseen merkitykseen on minimaalinen. Useiden annosten jälkeen on havaittu merkittävää modafiniilisulfonin kertymistä, koska sen pitkä eliminaation puoliintumisaika on 40 tuntia. Metaboloivien entsyymien, tärkeimmän sytokromi P-450 (CYP) 3A4, induktio on havaittu myös in vitro ihmisen maksasolujen primaariviljelmien inkubointi modafiniilin kanssa ja in vivo modafiniilin jatketun annon jälkeen 400 mg / päivä. (Lisätietoja modafiniilin vaikutuksista CYP - entsyymiaktiivisuuteen, ks VAROTOIMET, Lääkkeiden yhteisvaikutukset.)
Huumeiden ja lääkkeiden yhteisvaikutukset:
In vitro -tietojen perusteella modafiniili metaboloituu osittain maksan sytokromi P450: n (CYP3A4) 3A-isoformissa alaryhmässä. Lisäksi modafiniilillä on mahdollisuus estää CYP2C19, tukahduttaa CYP2C9 ja indusoida CYP3A4, CYP2B6 ja CYP1A2. Koska modafiniili ja modafiniilisulfoni ovat lääkeaineita metaboloivan entsyymin CYP2C19 palautuvia estäjiä, modafiniilin anto samanaikaisesti lääkkeet, kuten diatsepaami, fenytoiini ja propranololi, jotka eliminoituvat suurelta osin tämän reitin kautta, voivat nostaa näiden yhdisteet. Lisäksi yksilöillä, joilla puuttuu CYP2D6-entsyymi (ts. 7-10% Kaukasian väestöstä; samanlainen tai alempi muissa populaatioissa), CYP2D6-substraattien, kuten trisyklisten masennuslääkkeiden ja selektiivisen serotoniinin, pitoisuudet takaisinoton estäjät, joilla on aputie eliminaatioreittejä CYP2C19: n kautta, voidaan lisätä antamalla samanaikaisesti Modafiniili. Annoksen muuttaminen voi olla tarpeen potilaille, joita hoidetaan näillä ja vastaavilla lääkkeillä (ks VAROTOIMET, Lääkkeiden yhteisvaikutukset). In vitro -tutkimus osoitti, että armodafiniili (yksi modafiniilin enantiomeereistä) on P-glykoproteiinin substraatti.
Modafiniilin samanaikainen käyttö muiden keskushermostoon vaikuttavien lääkkeiden, kuten metyylifenidaatin ja dekstroamfetamiinin kanssa, ei vaikuttanut merkittävästi kummankaan lääkkeen farmakokinetiikkaan.
Modafiniilin 400 mg: n kroonisen antamisen havaittiin vähentävän systeemistä altistumista kahdelle CYP3A4: lle substraatit, etinyyliestradioli ja triatsolaami suun kautta antamisen jälkeen viittaavat siihen, että CYP3A4 aiheuttama. Modafiniilin krooninen antaminen voi lisätä CYP3A4-substraattien eliminaatiota. Annoksen muuttaminen voi olla tarpeen potilaille, joita hoidetaan näillä ja vastaavilla lääkkeillä (ks VAROTOIMET, Lääkkeiden yhteisvaikutukset).
Ihmisen maksasoluissa havaittiin ilmeistä pitoisuuteen liittyvää CYP2C9-aktiivisuuden vähenemistä sen jälkeen, kun altistuminen modafiniilille oli in vitro. mikä viittaa siihen, että modafiniilin ja tämän entsyymin substraattien (esim. S-varfariini, fenytoiini). Terveillä vapaaehtoisilla tehdyssä yhteisvaikutustutkimuksessa krooninen modafiniilihoito ei kuitenkaan osoittanut merkittävää vaikutusta varfariinin farmakokinetiikkaan plaseboon verrattuna. (Katso VAROTOIMET, Lääkkeiden yhteisvaikutukset, muut lääkkeet, varfariini).
Erityisväestöt
Sukupuolivaikutus:
Sukupuoli ei vaikuta modafiniilin farmakokinetiikkaan.
Ikävaikutus:
Modafiniilin suun kautta tapahtuvan puhdistuman (CL / F) pieneneminen (~ 20%) havaittiin kerta-annostutkimuksessa 200 mg: lla 12: ssa. koehenkilöt, joiden keski-ikä oli 63 vuotta (alue 53 - 72 vuotta), mutta muutoksen ei katsottu olevan todennäköinen kliinisesti merkittävä. Moniannos -tutkimuksessa (300 mg / päivä) 12 potilaalla, joiden keski-ikä oli 82 vuotta (vaihteluväli 67 - 87 vuotta), keskimääräinen modafiniilin tasot plasmassa olivat suunnilleen kaksi kertaa korkeammat kuin vastaavasti nuoremmilla aiheista. Useiden samanaikaisten lääkkeiden mahdollisten vaikutusten takia, joiden kanssa suurin osa potilaista oli mukana Hoidettujen lääkkeiden ilmeinen ero modafiniilin farmakokinetiikassa ei saa johtua pelkästään munuaisten vaikutuksista ikääntyminen. Tulokset viittaavat kuitenkin siihen, että modafiniilin puhdistuma voi vähentyä vanhuksilla (ks Annostelu ja hallinnointi).
Kilpailuvaikutus:
Rotujen vaikutusta modafiniilin farmakokinetiikkaan ei ole tutkittu.
Munuaisten vajaatoiminta:
Yhden annoksen 200 mg: n modafiniilitutkimuksessa vaikea krooninen munuaisten vajaatoiminta (kreatiniinipuhdistuma - 20 ml / min) ei vaikuttaa merkittävästi modafiniilin farmakokinetiikkaan, mutta altistuminen modafiniilihapolle (inaktiivinen metaboliitti) kasvoi 9-kertainen (katso VAROTOIMET).
Maksan vajaatoiminta:
Farmakokinetiikkaa ja aineenvaihduntaa tutkittiin maksakirroosipotilailla (6 miestä ja 3 naista). Kolmella potilaalla oli vaiheen B tai B + maksakirroosi (lasten kriteerejä kohden) ja 6 potilaalla vaiheen C tai C + maksakirroosi. Kliinisesti 8 yhdeksästä potilaasta oli icteric ja kaikilla oli vesivatsa. Näillä potilailla modafiniilin oraalinen puhdistuma laski noin 60% ja vakaan tilan pitoisuus kaksinkertaistui verrattuna normaaleihin potilaisiin. Provigil-annosta tulee pienentää potilailla, joilla on vaikea maksan vajaatoiminta (ks VAROTOIMET ja Annostelu ja hallinnointi).
ylin
Kliiniset polut
Provigilin tehokkuus liiallisen unisuuden vähentämisessä on osoitettu seuraavassa unessa häiriöt: narkolepsia, obstruktiivinen uniapnea / hypopnea-oireyhtymä (OSAHS) ja vuorotyön unihäiriö (SWSD).
narkolepsia
Provigilin tehokkuus narkolepsiaan liittyvän liiallisen uneliaisuuden (ES) vähentämisessä osoitettiin kahdessa Yhdysvaltojen 9 viikossa, monikeskustutkimus, lumekontrolloitu, kahden annoksen (200 mg päivässä ja 400 mg päivässä) rinnakkaisryhmän kaksoissokkotutkimukset avohoidosta vastaaville ICD-9 ja American Sleep Disorders Association kriteerit narkolepsialle (jotka ovat myös yhdenmukaisia American Psychiatric Associationin kanssa) DSM-IV-kriteerit). Näihin kriteereihin sisältyy joko 1) toistuvat päiväsaikaiset päiväunet tai vaihtuvat nukkumiseen, joita esiintyy melkein päivittäin vähintään kolmen kuukauden ajan, plus - posturaalisen lihaksen äkillinen kahdenvälinen menetys yhdessä voimakkaiden tunteiden kanssa (katapleksia) tai 2) valitus liiallisesta unesta tai äkillinen lihasheikkous ja siihen liittyvät piirteet: unen halvaus, hypnagogiset hallusinaatiot, automaattiset käytökset, häiriintynyt suuri uni episodi; ja polysomnografia, joka osoittaa yhden seuraavista: unen latenssi alle 10 minuuttia tai nopea silmän liikkeen (REM) unen latenssi alle 20 minuuttia. Lisäksi näiden potilaiden oli ennen näihin tutkimuksiin osallistumista vaadittava objektiivisesti dokumentoitua liiallista päiväsaikaista uneliaisuutta, useita unia Latenssitesti (MSLT) kahdella tai useammalla unen alkavalla REM-ajanjaksolla ja minkään muun kliinisesti merkittävän aktiivisen lääketieteellisen tai psykiatrisen potilaan puuttuessa häiriö. MSLT, objektiivinen päiväsaikainen monisomografinen arvio potilaan kyvystä nukahtaa stimuloimattomassa tilassa ympäristö, mittaa viivettä (minuutteina) nukkumisen alkamiseen keskimäärin 4 testiistunnossa 2 tunnin välein yöllisen jälkeen polysomnography. Jokaisesta testiistunnosta koehenkilön käskettiin makaamaan hiljaa ja yrittämään nukkua. Jokainen testiistunto päättyi 20 minuutin kuluttua, jos uni ei tapahtunut, tai 15 minuutin kuluttua unen alkamisesta.
Molemmissa tutkimuksissa tehokkuuden ensisijaiset mitat olivat 1) unen latenssi, jota arvioitiin herkkyyden ylläpitämistestillä (MWT) ja 2) potilaan yleisen sairaustilan muutos, mitattuna kliinisellä muutoksen globaalilla vaikutelmalla (CGI-C). Menestyksekkään oikeudenkäynnin kannalta molempien toimenpiteiden piti parantaa huomattavasti.
MWT mittaa viiveen (minuutteina) unen alkamiseen keskimäärin 4 testiistunnossa 2 tunnin välein öisen polysomnografian jälkeen. Jokaisessa testiistunnossa koehenkilöä pyydettiin yrittämään pysyä hereillä käyttämättä ylimääräisiä toimenpiteitä. Jokainen testiistunto päättyi 20 minuutin kuluttua, jos uni ei tapahtunut, tai 10 minuutin kuluttua unen alkamisesta. CGI-C on 7-pisteinen asteikko, jonka keskipiste on Ei muutosta, ja se vaihtelee erittäin huonommasta parasta hyvin parannettuun. Potilaat arvioivat arvioijat, joilla ei ollut pääsyä muihin potilaita koskeviin tietoihin kuin mitta heidän lähtötason vakavuudesta. Arvioijille ei annettu erityisiä ohjeita kriteereistä, joita heidän oli sovellettava potilaiden arvioinnissa.
Muihin vaikutustenarviointeihin sisältyi moninkertainen lepotilatesti (MSLT), Epworth-unelma-asteikko (ESS; joukko kysymyksiä, joiden tarkoituksena on arvioida uneliaisuusastetta jokapäiväisissä tilanteissa) Steer Clear Performance Test (SCPT; tietokonepohjainen arvio potilaan kyvystä välttää esteitä osumasta simuloidussa ajo-tilanteessa), vakiona yöllinen polysomnografia ja potilaan päivittäinen nukkumispäiväkirja. Potilaita arvioitiin myös elämänlaadulla narkolepsiassa (QOLIN), joka sisältää validoidun SF-36-terveyskyselyn.
Molemmat tutkimukset osoittivat liiallisen päiväsapiaisuuden objektiivisten ja subjektiivisten mittausten paranemista sekä 200 mg: n että 400 mg: n annoksilla lumelääkkeeseen verrattuna. Kummallakin Provigil-annoksella hoidetut potilaat osoittivat tilastollisesti merkitsevästi parempaa kykyä pysyä hereillä MWT: llä (kaikki p-arvot <0,001) viikot 3, 6, 9 ja viimeinen vierailu verrattuna lumelääkkeeseen ja tilastollisesti merkitsevästi suurempi globaali parannus CGI-C-asteikolla mitattuna (kaikki p-arvot <0.05).
Keskimääräiset nukkua viiveet (minuutteina) MWT: llä lähtötasolla 2 kontrolloidulle tutkimukselle on esitetty alla olevassa taulukossa 1, samoin kuin keskimääräinen muutos lähtötasosta MWT: llä viimeisen vierailun aikana.
Seuraavassa taulukossa 2 on esitetty niiden potilaiden prosenttiosuus, joilla CGI-C: n paraneminen havaittiin missä tahansa kahdessa kliinisessä tutkimuksessa.
Samanlaisia tilastollisesti merkitseviä hoitoon liittyviä parannuksia havaittiin myös muissa arvonalentumistesteissä vuonna 2002 narkolepsia, mukaan lukien potilaan arvioitu päiväsaikaisen uneliaisuuden taso ESS: llä (p <0,001 jokaisella annoksella verrattuna plasebo).
Provigilin käyttö ei vaikuttanut polysomnografialla mitattuun yöaikaan.
Obstruktiivinen uniapnea / hypopnea-oireyhtymä (OSAHS)
Provigilin tehokkuus OSAHS: ään liittyvän liiallisen uneliaisuuden vähentämisessä osoitettiin kahdessa kliinisessä tutkimuksessa. Molemmissa tutkimuksissa otettiin mukaan potilaat, jotka täyttivät kansainvälisen unihäiriöiden luokituksen (ICSD) kriteerit OSAHS: lle (jotka ovat myös yhdenmukaisia American Psychiatric Association DSM-IV: n kanssa) kriteeri). Näihin kriteereihin kuuluvat joko 1) liiallinen uneliaisuus tai unettomuus sekä usein toistuvat vajaatoimintaa jaksot hengitys nukkumisen aikana ja siihen liittyvät ominaisuudet, kuten kova kuorsaus, aamupäänsärky ja suun kuivuminen herääminen; tai 2) liiallinen uneliaisuus tai unettomuus ja polysomnografia, joka osoittaa yhden seuraavista: enemmän kuin viisi obstruktiivista apneaa, jokaisen kesto on yli 10 sekuntia tunnissa unen ja yhden tai useamman seuraavista: usein unesta johtuvat kiihtyvyydet, jotka liittyvät apneaan, bradytakykardia ja valtimoiden hapen desaturaatio yhdessä apneas. Näihin tutkimuksiin osallistumisen lisäksi kaikkien potilaiden piti olla liiallista uneliaisuutta, kuten on osoitettu pistemäärällä â 10 on Epworth-unelma-asteikolla huolimatta jatkuvasta positiivisesta hengitysteiden paineesta (CPAP). CPAP: n käytön dokumentoinnin lisäksi vaadittiin todisteita siitä, että CPAP oli tehokas apnea / hypopnea-kohtausten vähentämisessä.
Ensimmäisessä tutkimuksessa, 12 viikon monikeskuksessa, lumelääkekontrolloidussa tutkimuksessa, yhteensä 327 potilasta satunnaistettiin saamaan Provigil 200 mg / vrk, Provigil 400 mg / vrk tai vastaavaa lumelääkettä. Suurin osa potilaista (80%) noudatti täysin CPAP: n määritelmää. CPAP: n käyttö oli> 4 tuntia / yö> 70% öisin. Loput olivat osittain CPAP-yhteensopivia, määriteltyinä CPAP-käyttö 30% yötä. CPAP: n käyttö jatkui koko tutkimuksen ajan. Ensisijaiset tehokkuuden mitat olivat 1) unen latenssi, arvioituna Wakefulness Testissä (MWT) ja 2) muutos potilaan kokonaistilassa, mitattuna kliinisellä globaalilla muutoksen vaikutelmalla (CGI-C) viikolla 12 tai viimeisellä vierailla. (Katso Kliiniset polut, Narkolepsia-osio, joka kuvaa näitä testejä.)
Provigililla hoidetut potilaat osoittivat tilastollisesti merkitsevää paranemista pysyvät hereillä verrattuna lumelääkkeellä hoidettuihin potilaisiin mitattuna MWT: llä (p <0,001) päätepisteessä [Pöytä 1]. Provigililla hoidetut potilaat osoittivat myös tilastollisesti merkitsevää parannusta kliinisessä tilassa CGI-C-asteikolla mitattuna (p <0,001) [taulukko 2]. Provigilin kaksi annosta suoritettiin samalla tavalla.
Toisessa tutkimuksessa, 4 viikon monikeskuksessa, lumelääkekontrolloidussa tutkimuksessa, 157 potilasta satunnaistettiin joko Provigil 400 mg: aan / päivä tai lumelääkkeeseen. Kaikkien potilaiden vaadittiin dokumentointia CPAP: n säännöllisestä käytöstä (vähintään 4 tuntia / yö 70%: lla öistä). Ensisijainen tulosmitta oli muutos lähtötilanteeseen ESS: llä viikolla 4 tai viimeisellä vierailulla. Perustason ESS-pisteet Provigil- ja plaseboryhmillä olivat vastaavasti 14,2 ja 14,4. Viikolla 4 ESS laski 4,6: lla Provigil-ryhmässä ja 2,0: lla lumeryhmässä, ero, joka oli tilastollisesti merkitsevä (p <0,0001).
Provigilin käyttö ei vaikuttanut polysomnografialla mitattuun yöaikaan.
Vaihto-työhäiriö (SWSD)
Provigilin teho SWSD: hen liittyvästä liiallisesta uneliaisuudesta osoitettiin 12 viikon lumekontrolloidussa kliinisessä tutkimuksessa. Yhteensä 209 potilasta, joilla oli krooninen SWSD, satunnaistettiin saamaan Provigilia 200 mg / päivä tai lumelääkettä. Kaikki potilaat täyttivät kroonisen SWSD: n kansainvälisen unihäiriöiden luokituksen (ICSD-10) kriteerit (jotka ovat yhdenmukainen amerikkalaisen psykiatrisen yhdistyksen DSM-IV-kriteerien kanssa vuorokausirytmin unihäiriöille: vuorotyö Tyyppi). Näihin perusteisiin sisältyy 1) joko: a) ensisijainen valitus liiallisesta unesta tai unettomuudesta, joka liittyy ajallisesti työjaksoon (yleensä yötyöhön), joka tapahtuu tavanomaisen nukkumisvaiheen aikana, tai b) polysomnografia ja MSLT osoittavat normaalin unen herättämisen kuvion menetyksen (ts. häiriintynyt kronobiologinen rytmiä); ja 2) mikään muu lääketieteellinen tai psyykkinen häiriö ei vastaa oireita ja 3) oireet eivät täytä kriteerejä kaikille muille unihäiriöille, jotka aiheuttavat unettomuutta tai liiallista unisuutta (esim. aikavyöhykkeen muutos [jet lag] oireyhtymä).
On huomattava, että kaikki uneliaisuusta kärsivät potilaat, jotka tekevät myös vuorotyötä, eivät täytä SWSD-diagnoosin kriteerejä. Kliinisessä tutkimuksessa otettiin mukaan vain potilaat, joilla oli oireita vähintään 3 kuukautta.
Rekisteröityjen potilaiden piti myös työskennellä vähintään 5 yövuoroa kuukaudessa, ja heillä oli liiallinen unisuus heidän yövuorojensa aika (MSLT-pistemäärä <6 minuuttia), ja päiväsaikaisella unettomuudella on dokumentoitu päiväsaikainen polysomnogrammi (PSG).
Ensisijaiset tehokkuusmittarit olivat 1) unen latenssi, arvioituna moninkertaisen unen latenssitestin (MSLT) avulla, joka suoritettiin simuloidussa yövuorossa viikolla 12 tai viimeinen käynti ja 2) muutos potilaan kokonaistilassa, mitattuna kliinisellä muutoksen globaalilla vaikutelmalla (CGI-C) viikolla 12 tai viimeisenä vierailla. Provigililla hoidetut potilaat osoittivat tilastollisesti merkitsevää pidentymistä uniajan alkamisessa verrattuna plasebohoitoon saaneisiin potilaisiin, mitattuna yöaikaisella MSLT: llä [taulukko 1] (p <0,05). CGI-C: n paranemisen havaittiin myös olevan tilastollisesti merkitsevä (p <0,001). (Katso Kliiniset polut, Narkolepsia-osio, joka kuvaa näitä testejä.)
Provigilin käyttö ei vaikuttanut polysomnografialla mitattuun päiväsaikaan.
HTML-leikepöytä
| Häiriö | Mitata | provigil 200 mg * |
provigil 400 mg * |
Plasebo | |||
| * Merkittävästi erilainen kuin lumelääke kaikissa tutkimuksissa (p <0,01 kaikissa tutkimuksissa paitsi SWSD, joka oli p <0,05) | |||||||
| lähtötilanteessa | Muuttaa lähtötasosta |
lähtötilanteessa | Muuttaa lähtötasosta |
lähtötilanteessa | Vaihda lähtötilanteessa |
||
| Narkolepsia I | MWT | 5.8 | 2.3 | 6.6 | 2.3 | 5.8 | -0.7 |
| Narkolepsia II | MWT | 6.1 | 2.2 | 5.9 | 2.0 | 6.0 | -0.7 |
| OSAHS | MWT | 13.1 | 1.6 | 13.6 | 1.5 | 13.8 | -1.1 |
| SWSD | MSLT | 2.1 | 1.7 | - | - | 2.0 | 0.3 |
| Häiriö | provigil 200 mg * |
provigil 400 mg * |
Plasebo |
| * Merkittävästi erilainen kuin lumelääke kaikissa tutkimuksissa (p <0,01) | |||
| Narkolepsia I | 64% | 72% | 37% |
| Narkolepsia II | 58% | 60% | 38% |
| OSAHS | 61% | 68% | 37% |
| SWSD | 74% | - | 36% |
ylin
Käyttöaiheet ja käyttö
Provigil on tarkoitettu parantamaan herkkyyttä aikuisilla potilailla, joilla on liiallinen uneliaisuus, joka liittyy narkolepsiaan, obstruktiiviseen uniapneaan / hypopnea-oireyhtymään ja vuorotyön unihäiriöön.
OSAHS: ssä Provigil on osoitettu lisäaineena tavanomaiseen obstruktiohoitoon. Jos jatkuva positiivinen hengitysteiden paine (CPAP) on potilaalle valittavana oleva hoito, ennen Provigil-hoidon aloittamista on tehtävä mahdollisimman suuri vaikutus CPAP: n hoitoon riittävän pitkän ajan. Jos Provigilia käytetään yhdessä CPAP: n kanssa, CPAP: n noudattamisen kannustaminen ja säännöllinen arviointi ovat välttämättömiä.
Kaikissa tapauksissa huolellinen huomiota taustalla olevien unihäiriöiden diagnoosiin ja hoitoon on erittäin tärkeää. Lääkkeiden määrääjien tulee olla tietoisia siitä, että joillakin potilailla voi olla useampi kuin yksi unihäiriö, joka osaltaan lisää heidän liiallista uneliaisuuttaan.
Modafiniilin tehokkuus pitkäaikaisessa käytössä (yli 9 viikkoa Narcolepsy-kliinisissä tutkimuksissa ja 12 viikot OSAHS- ja SWSD-kliinisissä tutkimuksissa) ei ole arvioitu systemaattisesti plasebokontrolloidussa muodossa tutkimuksissa. Lääkärin, joka päättää määrätä Provigilia pitkään Narcolepsia-, OSAHS- tai SWSD-potilaille, tulee määräajoin arvioida uudelleen pitkäaikainen hyödyllisyys yksittäiselle potilaalle.
ylin
Vasta
Provigili on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä modafiniilille, armodafiniilille tai sen inaktiivisille aineille.
ylin
varoitukset
Vakava ihottuma, mukaan lukien Stevens-Johnsonin oireyhtymä
Modafiniilin käytön yhteydessä on raportoitu vakavista ihottumista, jotka vaativat sairaalahoitoa ja hoidon keskeyttämistä.
Modafiniilia ei ole hyväksytty käytettäväksi lapsipotilailla mihinkään käyttöaiheeseen.
Modafiniilin kliinisissä tutkimuksissa lopettamiseen johtavan ihottuman esiintyvyys oli noin 0,8% (13/1 585) lapsipotilailla (ikä <17 vuotta); näihin ihottumiin sisältyy 1 tapaus mahdollisesta Stevens-Johnsonin oireyhtymästä (SJS) ja 1 tapaus ilmeisestä monijärjestelmän yliherkkyysreaktiosta. Useat tapauksista liittyivät kuumeeseen ja muihin poikkeavuuksiin (esim. Oksentelu, leukopenia). Keskimääräinen aika ihottumaan, joka johti lääkityksen lopettamiseen, oli 13 päivää. Tällaisia tapauksia ei havaittu 380 plaseboa saaneen lapsipotilaan joukossa. Modafiniilin kliinisissä tutkimuksissa (0/4 264) ei ole ilmoitettu vakavista ihottumista.
Harvinaiset vakavat tai hengenvaaralliset ihottumat, mukaan lukien SJS, toksinen epidermaalinen nekrolyysi (TEN) ja huumeiden ihottuma Eosinofiliasta ja systeemisistä oireista (DRESS) on ilmoitettu aikuisilla ja lapsilla markkinoille tulon jälkeen maailmanlaajuisesti kokea. Modafiniilin käyttöön liittyvä TEN: n ja SJS: n raportointiaste, jonka yleisesti pidetään aliarviointina aliraportoinnin vuoksi, ylittää taustan esiintyvyysasteen. Arviot näiden vakavien ihoreaktioiden taustalla esiintyvyysväestöstä väestössä ovat välillä 1 - 2 tapausta miljoonaa henkilöä kohden.
Ei ole mitään tekijöitä, joiden tiedetään ennustavan modafiniiliin liittyvän esiintymisriskin tai ihottuman vakavuuden. Melkein kaikki modafiniiliin liittyvät vakavat ihottumatapaukset tapahtuivat 1–5 viikon sisällä hoidon aloittamisesta. Yksittäisiä tapauksia on kuitenkin ilmoitettu pitkäaikaisen hoidon jälkeen (esim. 3 kuukautta). Siksi hoidon kestoa ei voida luottaa keinona ennustaa mahdollista riskiä, joka johtuu ihottuman ensimmäisestä esiintymisestä.
Vaikka hyvänlaatuisia ihottumia esiintyy myös modafiniilillä, ei ole mahdollista luotettavasti ennustaa, mitkä ihottumat osoittautuvat vakaviksi. Siksi modafiniilin käyttö tulisi yleensä lopettaa ensimmäisissä ihottuman oireissa, paitsi jos ihottuma ei selvästikään liity lääkkeisiin. Hoidon lopettaminen ei välttämättä estä ihottumaa muuttumasta hengenvaaralliseksi tai poistamasta pysyvästi toimintakykyä tai muodonmuutosta.
Angioödeema ja anafylaktoidiset reaktiot
Yksi vakava angioödeematapaus ja yksi yliherkkyystapaus (ihottuma, dysfagia ja bronkospasmi) olivat havaittu 1 595 potilaalla, joita hoidettiin armodafiniilillä, modafiniilin R-enantiomeerillä (joka on raseeminen seos). Modafiniilin kliinisissä tutkimuksissa ei havaittu sellaisia tapauksia. Angioödeemaa on kuitenkin ilmoitettu markkinoille tulon jälkeisissä kokemuksissa modafiniilillä. Potilaita tulisi neuvoa lopettamaan hoito ja ilmoittamaan heti lääkärilleen kaikista oireista tai angioedeemaan tai anafylaksiaan viittaavia oireita (esim. kasvojen, silmien, huulten, kielen tai nielun turvotusta) kurkunpää; nielemis- tai hengitysvaikeudet; käheys).
Monen elimen yliherkkyysreaktiot
Monen elimen yliherkkyysreaktioilla, mukaan lukien ainakin yksi kuolema markkinoille tulon jälkeisessä kokemuksessa, on ollut tapahtui tiiviissä ajallisessa yhteydessä (mediaani aika havaitsemiseen 13 päivää: alue 4-33) aloittamisen alkamiseen Modafiniili.
Vaikka raportteja on ollut rajoitetusti, useiden elinten yliherkkyysreaktiot voivat johtaa sairaalahoitoon tai olla hengenvaarallisia. Ei ole mitään tekijöitä, joiden tiedetään ennustavan modafiniiliin liittyvien moniorgaanisten yliherkkyysreaktioiden riskiä tai vakavuutta. Tämän häiriön merkit ja oireet olivat erilaisia; potilailla on kuitenkin tyypillisesti, vaikkakaan ei yksinomaan, kuumetta ja ihottumaa, joka liittyy muuhun elinjärjestelmään. Muihin niihin liittyviin oireisiin sisältyi sydänlihastulehdus, hepatiitti, maksan toimintakokeen poikkeavuudet, hematologiset poikkeavuudet (esim. eosinofilia, leukopenia, trombosytopenia), kutina ja voimattomuus. Koska useiden elinten yliherkkyys on ilmentymisessä vaihtelevaa, voi esiintyä muita elinjärjestelmän oireita ja oireita, joita ei ole mainittu tässä.
Jos epäillään useiden elinten yliherkkyysreaktiota, Provigilin käyttö tulee lopettaa. Vaikka ei ole tapausraportteja, jotka osoittaisivat ristiherkkyyttä muiden tämän oireyhtymän aiheuttavien lääkkeiden kanssa, monien elinten yliherkkyyteen liittyvien lääkkeiden kokemus osoittaa tämän olevan a mahdollisuus.
Pysyvä uneliaisuus
Potilaita, joilla on epänormaalia uneliaisuutta ja jotka käyttävät Provigilia, tulee neuvoa, että heidän herkkyysaste ei välttämättä palaudu normaaliksi. Potilaat, joilla on liiallinen uneliaisuus, mukaan lukien Provigilia käyttävät, tulee arvioida usein uudelleen uneliaisuusaste ja tarvittaessa suositeltava välttämään ajamista tai muuta potentiaalisesti vaarallista toimintaa. Reseptilääkärien tulee myös olla tietoisia siitä, että potilaat eivät välttämättä tunne väsymystä tai uneliaisuutta, ennen kuin heitä suoraan kysytään uneliaisuudesta tai unisuudesta tiettyjen toimintojen aikana.
Psykiatriset oireet
Psykiatrisia haittavaikutuksia on ilmoitettu potilailla, joita on hoidettu modafiniilillä. Markkinoille saattamisen jälkeisiin modafiniilin käyttöön liittyviin haittatapahtumiin ovat kuuluneet mania, harhaluulot, hallusinaatiot, itsemurha-ajatukset ja aggressio, joista jotkut ovat johtaneet sairaalahoitoon. Monilla, mutta ei kaikilla, potilailla oli aiempi psykiatrinen historia. Yksi terve miespuolinen vapaaehtoinen kehitti ideoita vertailusta, vainoharhaisista harhaluuloista ja kuulohallusinaatioista yhdessä useiden päivittäisten 600 mg: n modafiniili-annosten ja unipuutteen kanssa. Ei ollut näyttöä psykoosista 36 tuntia lääkityksen lopettamisen jälkeen.
Aikuisten modafiniili -valvottujen tutkimusten tietokannassa psykiatriset oireet, jotka johtivat hoidon keskeyttämiseen (esiintymistiheys> 0,3%) ja raportoitiin useammin potilailla modafiniililla hoidettuihin verrattuna lumelääkkeellä hoidettuihin olivat ahdistus (1%), hermostuneisuus (1%), unettomuus (<1%), sekavuus (<1%), levottomuus (<1%) ja masennus (<1%).. Varovaisuutta on noudatettava annettaessa Provigilia potilaille, joilla on aiemmin ollut psykoosia, masennusta tai maniaa. Provigil-hoitoa saaneiden potilaiden psykiatristen oireiden mahdollinen esiintyminen tai paheneminen on otettava huomioon. Jos psykiatriset oireet kehittyvät yhdessä Provigil-hoidon kanssa, harkitse Provigilin käytön lopettamista.
ylin
varotoimet
Unihäiriöiden diagnoosi
Provigilia tulisi käyttää vain potilailla, joilla on ollut täydellinen arvio liiallisesta uneliaisuudestaan ja joilla a joko narkolepsian, OSAHS: n ja / tai SWSD: n diagnoosi on tehty ICSD: n tai DSM: n diagnoosikriteerien mukaisesti (katso Kliiniset polut). Tällainen arviointi koostuu yleensä täydellisestä historiasta ja fyysisestä tutkimuksesta, ja sitä voidaan täydentää testaamalla laboratorioympäristössä. Joillakin potilailla voi olla useampi kuin yksi unihäiriö, jotka edistävät heidän liiallista uneliaisuuttaan (esim. OSAHS ja SWSD sattuvat saman potilaan kohdalla).
yleinen
Vaikka modafiniilin ei ole osoitettu aiheuttavan toimintahäiriöitä, kaikki keskushermostoon vaikuttavat lääkkeet voivat muuttaa harkintaa, ajattelua tai motorisia taitoja. Potilaita tulee varoittaa käyttämästä autoa tai muita vaarallisia koneita, kunnes he ovat On kohtuullisen varmaa, että Provigil-terapia ei vaikuta haitallisesti heidän kykyyn osallistua sellaiseen toimintaa.
CPAP-käyttö potilailla, joilla on OSAHS
OSAHS: ssä Provigil on osoitettu lisäaineena tavanomaiseen obstruktiohoitoon. Jos jatkuva positiivinen hengitysteiden paine (CPAP) on potilaalle valittavana oleva hoito, ennen Provigil-hoidon aloittamista on tehtävä mahdollisimman suuri vaikutus CPAP: n hoitoon riittävän pitkän ajan. Jos Provigilia käytetään yhdessä CPAP: n kanssa, CPAP: n noudattamisen kannustaminen ja säännöllinen arviointi ovat välttämättömiä.
Sydän ja verisuoni
Modafiniiliä ei ole tutkittu potilailla, joilla on viime aikoina ollut sydäninfarkti tai epästabiili angina, ja sellaisia potilaita tulee hoitaa varoen.
Provigil-valmisteen kliinisissä tutkimuksissa merkkejä ja oireita, mukaan lukien rintakipu, sydämentykytys, hengenahdistus ja ohimenevä iskeeminen T-aallonmuutoksia EKG: ssä havaittiin kolmella koehenkilöllä mitraaliventtiilin prolapsin tai vasemman kammion yhteydessä liikakasvua. Provigil-tabletteja ei suositella käytettäväksi potilailla, joilla on aiemmin ollut vasemman kammion hypertrofiaa tai potilailla, joilla on mitraaliventtiilin prolapsia ja joilla on ollut mitraalisen venttiilin prolapsioireyhtymä, kun he ovat aiemmin saaneet keskushermostoa piristeitä. Tällaisia oireita voivat olla, mutta näihin rajoittumatta, iskeemiset EKG-muutokset, rintakipu tai rytmihäiriöt. Jos jokin näistä oireista ilmaantuu uudestaan, harkitse sydämen arviointia.
Verenpaineen seuranta lyhytaikaisissa (<3 kuukautta) kontrolloiduissa tutkimuksissa ei osoittanut kliinisesti merkitsevää muutokset keskimääräisessä systolisessa ja diastolisessa verenpaineessa Provigilia saaneilla potilailla verrattuna plasebo. Verenpainelääkkeiden käytön retrospektiivinen analyysi näissä tutkimuksissa kuitenkin osoitti, että suurempi osuus Provigil-hoitoa saaneet potilaat vaativat uutta tai lisääntynyttä verenpainelääkkeiden käyttöä (2,4%) verrattuna lumelääkeryhmään (0,7%). Erokäyttö oli hiukan suurempi, kun mukaan otettiin vain OSAHS-tutkimukset, 3,4%: lla potilaista Provigili ja 1,1% plaseboa saaneista potilaista, jotka vaativat tällaisia muutoksia verenpainelääkkeiden käytössä lääkitys. Lisääntynyt verenpaineen seuranta voi olla tarkoituksenmukaista Provigil-hoitoa saavilla potilailla.
Steroidisia ehkäisyvalmisteita käyttävät potilaat
Steroidisten ehkäisyvalmisteiden teho saattaa heikentyä, kun niitä käytetään Provigil-tablettien kanssa ja yhden kuukauden ajan hoidon lopettamisesta (ks. varotoimet, Lääkkeiden yhteisvaikutukset). Provigil-tableteilla hoidetuille potilaille suositellaan vaihtoehtoisia tai samanaikaisia ehkäisymenetelmiä yhden kuukauden ajan Provigil-hoidon lopettamisesta.
Potilaat, jotka käyttävät syklosporiinia
Siklosporiinin pitoisuus veressä voi laskea käytettäessä Provigil-valmistetta (ks varotoimet, Lääkkeiden yhteisvaikutukset). Kiertävien syklosporiinipitoisuuksien seurantaa ja syklosporiinin annostuksen asianmukaista säätämistä tulisi harkita, kun näitä lääkkeitä käytetään samanaikaisesti.
Potilaat, joilla on vaikea maksan vajaatoiminta
Potilaat, joilla on vaikea maksan vajaatoiminta, maksakirroosin kanssa tai ilman (ks Kliininen farmakologia), Provigilia tulee antaa pienemmällä annoksella (ks Annostelu ja hallinnointi).
Potilaat, joilla on vaikea munuaisten vajaatoiminta
Annoksen turvallisuuden ja tehon määrittämiseksi vaikeaa munuaisten vajaatoimintaa sairastaville potilailla ei ole riittäviä tietoja. (Farmakokinetiikka munuaisten vajaatoiminnassa, ks Kliininen farmakologia.)
Iäkkäät potilaat
Iäkkäillä potilailla modafiniilin ja sen metaboliittien eliminaatio voi vähentyä ikääntymisen seurauksena. Siksi on harkittava pienempien annosten käyttöä tässä populaatiossa. (Katso Kliininen farmakologia ja Annostelu ja hallinnointi).
Tietoa potilaille
Lääkäreitä kehotetaan keskustelemaan seuraavista aiheista potilaiden kanssa, joille he määräävät Provigilin.
Provigili on tarkoitettu potilaille, joilla on epänormaalia uneliaisuutta. Provigilin on osoitettu parantavan, mutta ei poista tätä epänormaalia taipumusta nukahtaa. Siksi potilaiden ei tule muuttaa aikaisempaa käyttäytymistään mahdollisesti vaarallisten toimintojen (esim. Ajaminen, koneiden käyttö) tai muun suhteen toiminnot, jotka edellyttävät asianmukaista herkkyysastetta, kunnes ja ellei hoidon Provigililla ole osoitettu tuottavan herkkyystasoa, joka sallii sellaisen toimintaa. Potilaita tulee kertoa, että Provigil ei korvaa unta.
Potilaille tulee kertoa, että voi olla kriittistä jatkaa aiemmin määrättyjen hoitomuotojensa hoitamista (esim. CPAP: n saavien OSAHS-potilaiden tulee jatkaa niin tekemistä).
Potilaille on kerrottava potilastiedotteen saatavuudesta ja heitä on kehotettava lukemaan esite ennen Provigilin ottamista.
Potilaita tulisi neuvoa ottamaan yhteyttä lääkäriinsä, jos he kokevat rintakipua, ihottumaa, masennusta, ahdistusta tai merkkejä psykoosista tai maniasta.
raskaus
Potilaita tulisi neuvoa ilmoittamaan lääkärilleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi hoidon aikana. Potilaita tulee varoittaa mahdollisesta lisääntyneestä raskausriskistä käytettäessä steroidisia ehkäisyvälineitä (mukaan lukien depot- tai implantoitavat) ehkäisyvalmisteet) yhdessä Provigilin kanssa ja yhden kuukauden ajan hoidon lopettamisesta (katso Karsinogeneesi, Mutageneesi, Hedelmällisyyden heikkeneminen ja Raskaus).
Sairaanhoito
Potilaita tulisi neuvoa ilmoittamaan lääkärilleen, jos he imettävät lasta.
Samanaikainen lääkitys
Potilaita tulisi neuvoa ilmoittamaan lääkärilleen, jos he käyttävät tai suunnittelevat ottavansa mitään reseptilääkkeet tai käsikauppalääkkeet Provigilin ja muut huumeet.
alkoholi
Potilaita tulee kertoa, että Provigilin käyttöä yhdessä alkoholin kanssa ei ole tutkittu. Potilaita tulee kertoa, että on järkevää välttää alkoholia Provigil-hoidon aikana.
Allergiset reaktiot
Potilaita tulisi neuvoa lopettamaan Provigilin käyttö ja ilmoittamaan lääkärilleen, jos heillä ilmenee ihottumaa, nokkosihottuma, suun haavaumat, rakkuloita, ihon kuorinta, nielemis- tai hengitysvaikeudet tai siihen liittyvä allergia ilmiö.
Lääkkeiden yhteisvaikutukset
CNS-aktiiviset lääkkeet
metyylifenidaatti
Yhden annoksen tutkimuksessa terveillä vapaaehtoisilla annettiin samanaikaisesti modafiniilia (200 mg) yhdessä metyylifenidaatti (40 mg) ei aiheuttanut merkittäviä muutoksia kummankaan farmakokinetiikassa huume. Provigilin imeytyminen voi kuitenkin viivästyä noin tunnilla, kun sitä annetaan samanaikaisesti metyylifenidaatin kanssa.
Moniannoksisessa vakaan tilan tutkimuksessa terveillä vapaaehtoisilla modafiniilia annettiin kerran päivässä 200 mg / päivä 7 päivän ajan, jota seurasi 400 mg / päivä 21 päivän ajan. Metyylifenidaatin (20 mg / päivä) antaminen modafiniilihoidon päivinä 22 - 28 8 tunnin kuluttua - modafiniilin päivittäinen annos ei aiheuttanut merkittäviä muutoksia munuaisten farmakokinetiikassa Modafiniili.
dekstroamfetamiinin
Yhden annoksen tutkimuksessa terveillä vapaaehtoisilla annettiin samanaikaisesti modafiniiliä (200 mg) dekstroamfetamiini (10 mg) ei aiheuttanut merkittäviä muutoksia kummankaan farmakokinetiikassa huume. Provigilin imeytyminen voi kuitenkin viivästyä noin tunnilla, kun sitä annetaan samanaikaisesti dekstroamfetamiinin kanssa.
Moniannoksisessa vakaan tilan tutkimuksessa terveillä vapaaehtoisilla modafiniilia annettiin kerran päivässä 200 mg / päivä 7 päivän ajan, jota seurasi 400 mg / päivä 21 päivän ajan. Dekstroamfetamiinin (20 mg / päivä) antaminen modafiniilihoidon päivinä 22-28 7 tunnin kuluttua - modafiniilin päivittäinen annos ei aiheuttanut merkittäviä muutoksia munuaisten farmakokinetiikassa Modafiniili.
Clomipramine
Klomipramiinin kerta-annoksen (50 mg) samanaikainen käyttö kolmella ensimmäisellä hoitopäivällä modafiniili (200 mg / päivä) terveillä vapaaehtoisilla ei osoittanut vaikutusta kummankaan lääkkeen farmakokinetiikkaan. Modafiniilihoidon aikana on kuitenkin ilmoitettu yhdestä klomipramiinin ja sen aktiivisen metaboliitin desmetyyliklomipramiinin pitoisuuden lisääntymisestä.
triatsolaami
Provigilin ja etinyyliestradiolin (EE2) välisessä lääkkeiden yhteisvaikutustutkimuksessa samoina päivinä kuin Plasmanäytteellä EE2-farmakokinetiikan suhteen annettiin myös yksi annos triatsolaamia (0,125 mg). Triatsolaamin keskimääräinen Cmax ja AUC0-β laskivat vastaavasti 42% ja 59%, ja sen eliminaation puoliintumisaika pieneni noin tunnin kuluttua modafiniilikäsittelystä.
Monoaminioksidaasin (MAO) estäjät
Yhteisvaikutustutkimuksia monoaminioksidaasin estäjien kanssa ei ole tehty. Siksi on noudatettava varovaisuutta annettaessa samanaikaisesti MAO-estäjiä ja modafiniiliä.
Muut huumeet
varfariini
Terveillä koehenkilöillä, jotka saivat kerta-annoksen raseemista varfariinia (5 mg), ei havaittu merkittäviä muutoksia R- ja S-varfariinin farmakokinetiikassa jälkeen modafiniilin kroonisen antamisen (200 mg / päivä 7 päivän ajan, sen jälkeen 400 mg / päivä 27 päivän ajan) suhteessa potilaiden profiiliin plasebo. Protrombiiniaikojen / INR: n tarkempi seuranta on kuitenkin suositeltavaa aina, kun Provigilia annetaan samanaikaisesti varfariinin kanssa (ks. Kliininen farmakologia, Farmakokinetiikka, lääkkeiden ja lääkkeiden yhteisvaikutukset).
Etinyyliestradioli
Modafiniilin anto vapaaehtoisille naisilla kerran päivässä annoksella 200 mg / päivä 7 päivän ajan, mitä seuraa 400 mg / vrk 21 vuorokauden ajan aiheutti etinyyliestradiolin Cmax-arvon keskimääräisen alenemisen 11% ja AUC0-24-arvon 18% (EE2; 0,035 mg; annostellaan suun kautta norgestimaatin kanssa). Etinyyliestradiolin eliminaationopeudessa ei ollut näkyvää muutosta.
Cyclosporine
Yksi tapaus modafiniilin ja syklosporiinin, CYP3A4: n substraatin, vuorovaikutuksesta on raportoitu 41-vuotiaalle naiselle, jolle oli tehty elinsiirto. Yhden kuukauden annon jälkeen, kun modafiniilia annettiin 200 mg / päivä, syklosporiinin pitoisuus veressä laski 50%. Yhteisvaikutuksen oletetaan johtuvan syklosporiinin lisääntyneestä metaboliasta, koska mikään muu tekijä, jonka odotetaan vaikuttavan lääkkeen dispositioon, ei ollut muuttunut. Siklosporiinin annosta voidaan joutua muuttamaan.
Mahdolliset yhteisvaikutukset lääkkeiden kanssa, jotka estävät, indusoivat tai metaboloidaan sytokromi P-450 -entsyymeillä ja muilla maksaentsyymillä
In vitro -tutkimuksissa, joissa käytettiin ihmisen primaarisia hepatosyyttiviljelmiä, modafiniilin osoitettiin indusoivan lievästi CYP1A2, CYP2B6 ja CYP3A4 pitoisuudesta riippuvalla tavalla. Vaikka in vitro -kokeisiin perustuvat induktiotulokset eivät välttämättä ennusta vastetta in vivo, ole varovainen on käytettävä, kun Provigilia annetaan samanaikaisesti lääkkeiden kanssa, jotka ovat riippuvaisia näistä kolmesta entsyymistä puhdistumaan. Erityisesti tällaisten lääkkeiden alhaisemmat veren pitoisuudet voivat johtaa (katso Muut lääkkeet, syklosporinebove).
Ihmisen maksasolujen altistuminen modafiniilille in vitro aiheutti ilmeisen pitoisuuteen liittyvän CYP2C9-aktiivisuuden ekspression tukahduttamisen mikä viittaa siihen, että modafiniilin ja tämän entsyymin substraattien (esim. S-varfariini ja fenytoiini). Myöhemmässä terveiden vapaaehtoisten kliinisessä tutkimuksessa krooninen modafiniilihoito ei osoittanut merkittävää vaikutusta varfariinin kerta-annoksen farmakokinetiikkaan plaseboon verrattuna (ks. varotoimet, Lääkkeiden yhteisvaikutukset, varfariini).
Ihmisen maksamikrosomeja käyttävät in vitro -tutkimukset osoittivat, että modafiniili inhiboi palautuvasti CYP2C19: ää modafiniilin farmakologisesti merkityksellisissä pitoisuuksissa. CYP2C19: tä estä myös palautuvasti samalla tehokkuudella kiertävä metaboliitti, modafiniilisulfoni. Vaikka modafiniilisulfonin maksimipitoisuudet plasmassa ovat paljon alhaisemmat kuin vanhemmilla modafiniili, molempien yhdisteiden yhdistetty vaikutus voisi tuottaa jatkuvan osittaisen estämisen entsyymi. Lääkkeet, jotka eliminoituvat suurelta osin CYP2C19-aineenvaihdunnan kautta, kuten diatsepaami, propranololi, fenytoiini (myös CYP2C9: n kautta) tai S-mefenytoiinilla saattaa olla pitkäaikainen eliminaatio samanaikaisessa käytössä Provigilin kanssa, ja se voi vaatia annoksen pienentämistä ja seurantaa myrkyllisyydelle.
Trisykliset masennuslääkkeet
CYP2C19 tarjoaa myös apureitin tiettyjen trisyklisten masennuslääkkeiden (esim. Klomipramiinin ja desipramiinin) aineenvaihdunnalle, jotka pääasiassa metaboloituvat CYP2D6: lla. Trisyklisillä potilailla, joilla puuttuu CYP2D6 (ts. Potilailla, jotka ovat heikot debrisokiinin metaboloijat; 7-10% Kaukasian väestöstä; samanlainen tai alempi muissa populaatioissa), CYP2C19: n metaboloitumisen määrä voi kasvaa huomattavasti. Provigili voi aiheuttaa trisyklisten pitoisuuksien nousua tällä potilasryhmällä. Lääkärien tulee olla tietoisia siitä, että trisyklisten aineiden annosta voidaan joutua pienentämään näillä potilailla.
Koska CYP3A4 osallistuu osittain modafiniilin metaboliseen eliminaatioon, CYP3A4: n voimakkaiden indusoijien samanaikainen anto (esim. karbamatsepiini, fenobarbitaali, rifampiini) tai CYP3A4: n estäjät (esim. ketokonatsoli, itrakonatsoli) voivat muuttaa Modafiniili.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
karsinogeneesi
Karsinogeenisyystutkimukset tehtiin, joissa modafiniilia annettiin ruokavaliossa hiirille 78 viikon ajan ja rotille 104 viikon ajan annoksina 6, 30 ja 60 mg / kg / päivä. Suurin tutkittu annos on 1,5 (hiiri) tai 3 (rotta) kertaa suurempi kuin suositeltu aikuisen ihmisen päivittäinen modafiniilin annos (200 mg) mg / m2. Näissä tutkimuksissa ei ollut näyttöä modafiniilin antamiseen liittyvästä kasvaimen synnystä. Koska hiiretutkimuksessa käytettiin kuitenkin riittämätöntä suurta annosta, joka ei ollut edustava suurimmalle siedettävälle annokselle, suoritettiin seuraava syöpää aiheuttava vaikutus -tutkimus Tg: ssä. AC-siirtogeeninen hiiri. Tg: ssä arvioidut annokset AC-määritykset olivat 125, 250 ja 500 mg / kg / päivä, annettuna dermaalisesti. Modafiniilin antamiseen ei liittynyt tumorigeenisyyttä; tämä ihomalli ei kuitenkaan välttämättä arvioi riittävästi suun kautta annettavan lääkkeen syöpää aiheuttavia vaikutuksia.
mutageneesi
Modafiniili ei osoittanut mutageenista tai klastogeenistä potentiaalia in vitro -sarjoissa (ts. Bakteerien käänteismutaatiomääritys, hiiren lymfooman tk-määritys, kromosomaalinen aberraatio) määritys ihmisen lymfosyyteissä, solutransformaatiomääritys BALB / 3T3-hiiren alkion soluissa) määritykset metabolisen aktivaation puuttuessa tai läsnäollessa tai in vivo (hiiren luuytimen mikrotuma) määrityksissä. Modafiniili oli myös negatiivinen suunnittelemattomassa DNA-synteesimäärityksessä rotan maksasoluissa.
Hedelmällisyyden heikkeneminen
Modafiniilin oraalinen anto (annokset jopa 480 mg / kg / päivä) koiras- ja naarasrotille ennen ja sen ajan parituminen ja naisilla jatkuminen raskauspäivän 7 aikana lisäsi paritusaikaa korkeimmalla tasolla annos; Muihin hedelmällisyys- tai lisääntymisparametreihin ei havaittu vaikutuksia. Vaikuttavaan annokseen 240 mg / kg / päivä liittyi plasman modafiniilialtistus (AUC), joka oli suunnilleen sama kuin ihmisillä, kun suositeltu 200 mg: n annos oli ihmisillä.
raskaus
Raskausluokka C:
Rotilla ja kaniineilla tehdyissä tutkimuksissa havaittiin kehitysmyrkyllisyyttä kliinisesti merkittävissä altistuksissa.
Modafiniili (50, 100 tai 200 mg / kg / vrk) annettiin suun kautta raskaana oleville rotille koko aiheutetun organogeneesin ajanjakson, jos äidille myrkyllisyys, resorptioiden lisääntyminen ja sisäelinten ja luuston muutosten lisääntyminen jälkeläisissä annos. Rotan alkion ja sikiön kehitysmyrkyllisyyden suurempi vaikutukseton annos liittyi plasmaan - modafiniilialtistus noin 0,5-kertainen AUC: n ihmisillä suositellussa päivittäisessä annoksessa (RHD) 200 mg. Myöhemmässä tutkimuksessa, joka koski jopa 480 mg / kg / päivä (plasman modafiniilialtistus noin 2 kertaa AUC ihmisillä RHD: llä), ei havaittu haitallisia vaikutuksia alkion ja sikiön kehitykseen.
Modafiniili annettiin suun kautta raskaana oleville kaniineille koko organogeneesin ajanjaksona annoksina 45, 90 ja 180 mg / kg / päivä lisäsi sikiön rakenteellisten muutosten ja alkion ja sikiön kuoleman todennäköisyyttä suurimmalla annoksella. Suurin kehityshäiriöihin vaikuttava annos liittyi plasman modafiniilien AUC: hen, joka oli suunnilleen yhtä suuri kuin AUC ihmisillä RHD: llä.
Armodafiniilin (modafiniilin R-enantiomeeri; 60, 200 tai 600 mg / kg / päivä) raskaana oleville rotille koko organogeneesin ajan. sikiön viskeraaliset ja luuvaihtelut väliannoksella tai enemmän ja sikiön kehon painot pienentyneet korkeimmalla annos. Rotan alkion ja sikiön kehitysmyrkyllisyyden vaikutukseton annos liitettiin plasman armodafiniiliin altistuminen (AUC) noin kymmenesosa kertaa armodafiniilin AUC ihmisillä, joita hoidettiin modafiniilillä RHD.
Modafiniilin anto rotille koko raskauden ja imetyksen ajan suun kautta annettavilla annoksilla 200 mg / kg / vrk vähensi jälkeläisten elinkelpoisuus annoksilla, jotka ovat suurempia kuin 20 mg / kg / päivä (plasman modafiniilin AUC on noin 0,1-kertainen AUC: n ihmisillä RHD). Elossaolevilla jälkeläisillä ei havaittu vaikutuksia synnytyksen jälkeiseen kehitykseen ja neuro-käyttäytymiseen.
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Armodafiniilin ja modafiniilin kanssa on ilmoitettu kahta tapausta kohdunsisäisestä kasvun hidastumisesta ja yhtä spontaania aborttia. Vaikka modafiniilin ja armodafiniilin farmakologia ei ole identtinen sympatomimeettisten amiinien kanssa, niillä on kuitenkin joitain farmakologisia ominaisuuksia tämän luokan kanssa. Joihinkin näistä lääkkeistä on liitetty kohdunsisäinen kasvun hidastuminen ja spontaanit abortit. Ei tiedetä, ovatko ilmoitetut tapaukset huumeita.
Modafiniilia tulisi käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen sikiölle aiheutuvan vaaran.
Työ ja toimitus
Modafiniilin vaikutusta synnytykseen ja synnytykseen ihmisillä ei ole systemaattisesti tutkittu.
Imettävät äidit
Ei tiedetä erittyykö modafiniili tai sen metaboliitit äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta, kun Provigil-tabletteja annetaan imettävälle naiselle.
Lasten käyttö
Turvallisuutta ja tehokkuutta alle 16-vuotiailla lapsipotilailla ei ole osoitettu. Modafiniilin käyttöön lapsipotilailla on liitetty vakavia ihottumia, mukaan lukien monimuotoinen eryteema (EMM) ja Stevens-Johnsonin oireyhtymä (SJS) (ks. varoitukset, Vakava ihottuma, mukaan lukien Stevens-Johnsonin oireyhtymä).
Kontrolloidussa 6 viikon tutkimuksessa 165 lapsipotilasta (5 - 17-vuotiaita), joilla oli narkolepsia, hoidettiin modafiniilillä (n = 123) tai lumelääkkeellä (n = 42). Ei ollut tilastollisesti merkitseviä eroja, jotka suosivat modafiniilia plaseboon verrattuna unen latenssin pidentämisessä mitattuna MSLT: llä, tai uneliaisuudessa kliinisen globaalin vaikutelman ja kliinisen asteikon määrittämällä tavalla (CGI-C).
Kontrolloiduissa ja avoimissa kliinisissä tutkimuksissa hoidossa esiintyi psykiatrisen ja hermoston haittavaikutuksia mukaan lukien Tourette'in oireyhtymä, unettomuus, vihamielisyys, lisääntynyt katapleksia, lisääntyneet hypnagogiset hallusinaatiot ja itsemurha ajatukset. Havaittiin myös ohimenevää leukopeniaa, joka hävisi ilman lääketieteellistä interventiota. Kontrolloidussa kliinisessä tutkimuksessa 3: lla 38: sta 12-vuotiasta tytöstä, joita hoidettiin modafiniilillä, ilmeni dysmenorrea verrattuna 0: lle kymmenestä lumelääkettä saaneesta tytöstä.
Geriatrinen käyttö
Turvallisuutta ja tehokkuutta yli 65-vuotiailla henkilöillä ei ole osoitettu. Kokemus rajoitetusta joukosta yli 65-vuotiaita potilaita kliinisissä tutkimuksissa osoitti muiden ikäryhmien kaltaisten haittavaikutusten esiintyvyyttä.
ylin
Haitalliset reaktiot
Modafiniilin turvallisuus on arvioitu yli 3500 potilaalla, joista yli 2000 potilaalla, joilla on liiallinen uneliaisuus, joka liittyy primaarisiin unihäiriöihin ja hereillä, annettiin vähintään yksi annos Modafiniili. Kliinisissä tutkimuksissa modafiniilin on havaittu olevan yleensä hyvin siedetty ja useimmat haittavaikutukset olivat lieviä tai kohtalaisia.
Yleisimmin havaitut haittavaikutukset (¥% 5%), jotka liittyvät Provigilin käyttöön useammin kuin plasebohoitoa saaneilla potilailla plasebokontrolloidussa Kliinisissä tutkimuksissa primaaristen unihäiriöiden ja hereillä olleiden häiriöiden joukossa olivat päänsärky, pahoinvointi, hermostuneisuus, nuha, ripuli, selkäkipu, ahdistus, unettomuus, huimaus ja dyspepsia. Haittavaikutusprofiili oli samanlainen kaikissa näissä tutkimuksissa.
Plasebokontrolloiduissa kliinisissä tutkimuksissa 74 Pro4igilia saaneesta 934 potilaasta (8%) keskeytti hoidon haittavaikutusten vuoksi, kun taas 3%: lla lumelääkettä saaneista potilaista. Yleisimmät syyt lopettamiseen, joita esiintyi Provigililla enemmän kuin plaseboa Potilaat olivat päänsärky (2%), pahoinvointi, ahdistus, huimaus, unettomuus, rintakipu ja hermostuneisuus (kukin <1%). Kanadan kliinisessä tutkimuksessa 35-vuotias lihava narkoleptinen mies, jolla on aiemmin ollut synkopisia jaksoja kokenut 9 sekunnin asystoolijakson 27 päivän modafiniilihoidon jälkeen (300 mg / päivä jaettuna annosta).
Ilmaantuvuus kontrolloiduissa tutkimuksissa
Seuraava taulukko (taulukko 3) kuvaa haittavaikutuksia, joita esiintyi vähintään 1 prosentilla ja jotka olivat useampia aikuisilla potilailla, joita hoidettiin Provigililla, kuin plasebolla hoidetuilla potilailla pääasiassa plasebokontrolloidussa kliinisessä hoidossa tutkimuksissa.
Lääkärin määrääjän tulee olla tietoinen siitä, että alla olevia lukuja ei voida käyttää ennustamaan haitallisten kokemusten esiintyvyyttä tavanomaisen lääketieteellisen käytännön kurssi, jossa potilaan ominaisuudet ja muut tekijät voivat poiketa kliinisen ajan aikana esiintyvistä opinnot. Samoin mainittuja esiintymistiheyksiä ei voida suoraan verrata lukuihin, jotka on saatu muista kliinisistä tutkimuksista, joihin liittyy erilaisia hoitoja, käyttötapoja tai tutkijoita. Näiden esiintymistiheyksien tarkistaminen antaa lääkärille kuitenkin perustan lääke- ja muiden tekijöiden suhteellisen vaikutuksen arvioimiseksi tutkittujen populaatioiden haittavaikutusten ilmaantuvuudessa.
| Vartalojärjestelmä | Haluttu termi | modafiniili (n = 934) |
Plasebo (n = 567) |
| * Kuusi kaksoissokkotettua, lumekontrolloitua kliinistä tutkimusta narkolepsiassa, OSAHS: ssä ja SWSD: ssä. 1 Ainakin 1% Provigil-hoitoa saaneista potilaista ilmoitti tapahtumia, jotka olivat useammin kuin lumelääkeryhmässä. esiintyvyys pyöristetään lähimpään prosenttiin. Haitallisen kokemuksen terminologia koodataan käyttämällä standardia muokattua COSTART-sanakirjaa. Tapahtumia, joissa Provigilin esiintyvyys oli vähintään 1%, mutta yhtä suuri tai pienempi kuin plasebo, ei ole lueteltu taulukossa. Näihin tapahtumiin sisältyi seuraavat: infektio, kipu, vahingossa tapahtunut vamma, vatsakipu, hypotermia, allerginen reaktio, astenia, kuume, virusinfektio, niskakipu, migreeni, epänormaali elektrokardiogrammi, hypotensio, hammashäiriöt, oksentelu, periodontaalinen paise, lisääntynyt ruokahalu, ekkymoosi, hyperglykemia, ääreisödeema, painonpudotus, paino lisääntyminen, lihaskipu, jalkakrampit, niveltulehdus, katapleksia, ajattelutavan poikkeavuudet, unihäiriöt, lisääntynyt yskä, sinuiitti, hengenahdistus, keuhkoputkentulehdus, ihottuma, sidekalvotulehdus, korvakipu, dysmenorrea4, virtsatieinfektio. 2 Kohonnut maksaentsyymit. 3 Oro-kasvojen dyskinesiat. 4 Ilmaantuvuus sovitettu sukupuolen mukaan. | |||
| Keho kokonaisuutena | Päänsärky | 34% | 23% |
| Selkäkipu | 6% | 5% | |
| Influenssaoireyhtymä | 4% | 3% | |
| Rintakipu | 3% | 1% | |
| vilunväristykset | 1% | 0% | |
| Kaulan jäykkyys | 1% | 0% | |
| sydän- | verenpainetauti | 3% | 1% |
| takykardia | 2% | 1% | |
| Sydämentykytys | 2% | 1% | |
| vasodilataatio | 2% | 0% | |
| Ruoansulatus | Pahoinvointi | 11% | 3% |
| Ripuli | 6% | 5% | |
| ruoansulatushäiriö | 5% | 4% | |
| Kuiva suu | 4% | 2% | |
| anoreksia | 4% | 1% | |
| Ummetus | 2% | 1% | |
| Epänormaali maksan toiminta2 | 2% | 1% | |
| Ilmavaivat | 1% | 0% | |
| Suun haavauma | 1% | 0% | |
| Jano | 1% | 0% | |
| Veri / Imusuonisto | eosinofilia | 1% | 0% |
| Metabolinen / Nutritional | turvotus | 1% | 0% |
| Hermostunut | Hermostuneisuus | 7% | 3% |
| Unettomuus | 5% | 1% | |
| levottomuus | 5% | 1% | |
| Huimaus | 5% | 4% | |
| Masennus | 2% | 1% | |
| Tuntoharha | 2% | 0% | |
| uneliaisuus | 2% | 1% | |
| hypertonia | 1% | 0% | |
| dyskinesia3 | 1% | 0% | |
| hyperkinesia | 1% | 0% | |
| levottomuus | 1% | 0% | |
| sekaannus | 1% | 0% | |
| Vapina | 1% | 0% | |
| Emotionaalinen hyvinvointi | 1% | 0% | |
| Huimaus | 1% | 0% | |
| Hengitys | nuha | 7% | 6% |
| Nielutulehdus | 4% | 2% | |
| Keuhkosairaus | 2% | 1% | |
| nenäverenvuoto | 1% | 0% | |
| Astma | 1% | 0% | |
| Iho / lisäkkeet | hikoilu | 1% | 0% |
| Huuliherpes | 1% | 0% | |
| Erityiset aistit | amblyopia | 1% | 0% |
| Epänormaali visio | 1% | 0% | |
| Maku perversio | 1% | 0% | |
| Silmäkipu | 1% | 0% | |
| Urogenitaaliset | Virtsan epänormaalisuus | 1% | 0% |
| hematuria | 1% | 0% | |
| pyuria | 1% | 0% |
Haittavaikutusten riippuvuus annosta
Aikuisten lumekontrolloiduissa kliinisissä tutkimuksissa, joissa verrattiin annoksia 200, 300 ja 400 mg / vrk Provigil ja lumelääke, ainoat haittatapahtumat, jotka olivat selvästi annokseen liittyviä, olivat päänsärky ja ahdistusta.
Vital Sign muutokset
Vaikka syketason tai systolisen ja diastolisen verenpaineen keskiarvoissa ei ollut jatkuvaa muutosta, verenpainelääkkeiden tarve oli Provigilia saaneilla potilailla hieman suurempi kuin lumelääkkeellä (ks varotoimet).
Painonmuutokset
Lumekontrolloiduissa kliinisissä tutkimuksissa ei ollut kliinisesti merkitseviä eroja painon muutoksessa Provigil-hoitoa saaneilla potilailla verrattuna lumelääkehoitoon.
Laboratorion muutokset
Kliinistä kemiaa, hematologiaa ja virtsa-analyysin parametreja tarkkailtiin vaiheissa 1, 2 ja 3. Näissä tutkimuksissa gammaglutamyylitransferaasin (GGT) ja alkalisen fosfataasin (AP) keskimääräisten pitoisuuksien plasmassa havaittiin olevan korkeampia Provigilin annon jälkeen, mutta ei plaseboa. Harvoilla koehenkilöillä oli kuitenkin GGT- tai AP-arvon nousu normaalin alueen ulkopuolella. Siirtyminen korkeampiin, mutta ei kliinisesti merkitsevästi epänormaaleihin, GGT- ja AP-arvot näyttivät kasvavan ajan myötä Provigililla hoidetuissa populaatioissa vaiheen 3 kliinisissä tutkimuksissa. Alaniini-aminotransferaasissa, aspartaatin aminotransferaasissa, kokonaisproteiinissa, albumiinissa tai kokonaisbilirubiinissa ei havaittu eroja.
EKG-muutokset
Provigilin antamisen jälkeen lumelääkekontrolloiduissa kliinisissä tutkimuksissa ei havaittu EKG-poikkeavuuksien muodostumista hoidossa.
Markkinoinnin jälkeiset raportit
Seuraavat haittavaikutukset on havaittu Provigilin käytön jälkeen. Koska näitä reaktioita ilmoitetaan vapaaehtoisesti epävarman koon populaatiosta, niiden esiintymistiheyttä ei voida luotettavasti arvioida tai syy-yhteyttä lääkealtistukseen voida määrittää. Päätökset näiden reaktioiden sisällyttämisestä merkinnöihin perustuvat tyypillisesti yhteen tai useampaan seuraavista tekijöistä: (1) reaktion vakavuus, (2) ilmoittamistiheys tai (3) syy-yhteyden vahvuus Provigil.
Hematologiset: agranulosytoosi
ylin
Huumeiden väärinkäyttö ja riippuvuus
Hallittu aineluokka
Modafiniili (Provigil) on lueteltu valvottavia aineita koskevan lain luettelossa IV.
Väärinkäyttömahdollisuudet ja riippuvuus
Provigil tuottaa herättävyyttä edistävän vaikutuksen ja lisääntynyttä liikkuvuutta eläimissä, ihmisissä psykoaktiiviset ja euforiset vaikutukset, mielialan, havainnon, ajattelun ja tunteiden muutokset, jotka ovat tyypillisiä muille keskushermoston stimulantteille. In vitro sitoutumistutkimuksissa modafiniili sitoutuu dopamiinin takaisinoton kohtaan ja aiheuttaa solunulkoisen dopamiinin määrän lisääntymisen, mutta ei lisääntynyttä dopamiinin vapautumista. Modafiniili vahvistuu, kuten osoittaa sen itsehallinto apinoilla, jotka on aiemmin koulutettu kokaiinin itsenäiseen antamiseen. Joissakin tutkimuksissa modafiniili erotettiin myös osittain stimulantin kaltaisesta. Lääkärien tulee seurata potilaita tarkasti, etenkin potilaita, joilla on aiemmin ollut huumeiden ja / tai piristeiden (esim. Metyylifenidaatin, amfetamiinin tai kokaiinin) väärinkäyttöä. Potilaita tulee tarkkailla väärinkäytön tai väärinkäytön oireiden varalta (esim. Annosten lisääminen tai huumeiden etsiminen).
Modafiniilin (200, 400 ja 800 mg) väärinkäytön potentiaali arvioitiin suhteessa metyylifenidaattiin (45 ja 90 mg) potilaiden tutkimuksessa potilailla, joilla oli kokemuksia väärinkäytöksistä. Tämän kliinisen tutkimuksen tulokset osoittivat, että modafiniili tuotti psykoaktiivisia ja euforisia vaikutuksia ja tunteita, jotka olivat yhdenmukaisia muiden suunniteltujen keskushermostoa stimulanttien (metyylifenidaatin) kanssa.
vetäytyminen
Modafiniilin lopettamisen vaikutuksia seurattiin 9 viikon modafiniilin käytön jälkeen yhdessä USA: n vaiheen 3 kontrolloidussa kliinisessä tutkimuksessa. Mitään erityisiä vieroitusoireita ei havaittu 14 havaintopäivän aikana, vaikka unelma palasi narkoleptisilla potilailla.
ylin
yliannostus
Ihmisen kokemus
Kliinisissä tutkimuksissa yhteensä 151 protokollassa määriteltyä annosta, jotka vaihtelivat välillä 1 000 - 1600 mg / päivä (5 - 8 kertaa suositeltu päiväannos 200 mg) on annettu 32 henkilölle, mukaan lukien 13 henkilöä, jotka saivat annoksia 1000 tai 1200 mg / päivä 7–21 peräkkäin päivää. Lisäksi tapahtui useita tahallisia akuutteja yliannostuksia; kaksi suurinta on 4500 mg ja 4000 mg, jotka ottivat kaksi ulkomaalaiseen masennustutkimukseen osallistuvaa henkilöä. Yhdelläkään näistä tutkimushenkilöistä ei ollut mitään odottamattomia tai hengenvaarallisia vaikutuksia. Haittavaikutuksia, joita ilmoitettiin näillä annoksilla, olivat herättäminen tai levottomuus, unettomuus ja lievät tai kohtalaiset kohonneet hemodynaamiset parametrit. Muihin kliinisissä tutkimuksissa havaittuihin suuriannoksisiin vaikutuksiin ovat kuuluneet ahdistus, ärtyneisyys, aggressiivisuus, sekavuus, hermostuneisuus, vapina, sydämentykytys, unihäiriöt, pahoinvointi, ripuli ja vähentynyt protrombiini aika.
Markkinoille tulon jälkeisistä kokemuksista ei ole ilmoitettu kuolemaan johtavista yliannostuksista, jotka koskisivat pelkästään modafiniilia (annokset korkeintaan 12 grammaa). Useiden lääkkeiden, mukaan lukien modafiniili, yliannostelut ovat johtaneet kuolemaan. Modafiniilin yliannostukseen yleensä liittyviä oireita yksinään tai yhdessä muiden lääkkeiden kanssa ovat olleet: unettomuus; keskushermosto-oireet, kuten levottomuus, hajaantuminen, sekavuus, herätys ja hallusinaatiot; ruoansulatuskanavan muutokset, kuten pahoinvointi ja ripuli; ja kardiovaskulaariset muutokset, kuten takykardia, bradykardia, verenpainetauti ja rintakipu.
Tahattoman nielemisen / yliannostuksen tapauksia on ilmoitettu 11 kuukauden ikäisillä lapsilla. Suurin ilmoitettu vahingossa tapahtuva nauttiminen mg / kg perusteella tapahtui 3-vuotiaalla pojalla, joka nieli 800-1000 mg (50-63 mg / kg) modafiniiliä. Lapsi pysyi vakaana. Lasten yliannostukseen liittyvät oireet olivat samanlaisia kuin aikuisilla.
Yliannosten hallinta
Modafiniilin yliannostuksen toksisille vaikutuksille ei ole toistaiseksi tunnistettu erityistä vastalääkettä. Tällaisia yliannostuksia tulee hoitaa ensisijaisesti tukevalla hoidolla, mukaan lukien sydän- ja verisuonitarkkailu. Jos vasta-aiheita ei ole, indusoitua oksentelua tai mahahuuhtelua tulee harkita. Ei ole tietoja, jotka osoittaisivat dialyysin tai virtsan happamoittamisen tai alkalisoinnin hyödyllisyyttä lääkkeen eliminaation tehostamisessa. Lääkärin tulisi harkita yhteyttä myrkytyskeskukseen yliannostuksen hoidossa.
ylin
Annostelu ja hallinnointi
Provigilin suositeltu annos on 200 mg kerran päivässä.
Potilaille, joilla on narkolepsia ja OSAHS, Provigil tulee ottaa yhtenä annoksena aamulla.
Potilaille, joilla on SWSD, Provigil tulee ottaa noin tunti ennen työvuoron alkamista.
Yhtenä kerta-annoksena annettavat 400 mg / vuorokausiannokset ovat siedetty hyvin, mutta ei ole olemassa jatkuvaa näyttöä siitä, että tämä annos lisäisi 200 mg: n annosta enemmän hyötyä (ks. Kliininen farmakologia ja Kliiniset polut).
Yleiset näkökohdat
Annoksen muuttamista tulisi harkita samanaikaisesti käytettävien lääkkeiden, kuten CYP3A4: n substraattien, kuten triatsolaamin ja syklosporiinin suhteen (ks. varotoimet, Lääkkeiden yhteisvaikutukset).
Lääkkeet, jotka eliminoituvat suurelta osin CYP2C19-aineenvaihdunnan kautta, kuten diatsepaami, propranololi, fenytoiini (myös CYP2C9: n kautta) tai S-mefenytoiinilla saattaa olla pitkäaikainen eliminaatio samanaikaisessa käytössä Provigilin kanssa, ja se voi vaatia annoksen pienentämistä ja seurantaa myrkyllisyydelle.
Potilailla, joilla on vaikea maksan vajaatoiminta, Provigil-annosta tulee pienentää puoleen siitä, jota suositellaan potilaille, joilla on normaali maksan toiminta (ks. CKliininen farmakologia ja varotoimet).
Annoksen turvallisuuden ja tehon määrittämiseksi vaikeaa munuaisten vajaatoimintaa sairastaville potilaille ei ole riittävästi tietoja (ks Kliininen farmakologia ja varotoimet).
Iäkkäillä potilailla Provigilin ja sen metaboliittien eliminaatio voi vähentyä ikääntymisen seurauksena. Siksi on harkittava pienempien annosten käyttöä tässä populaatiossa (ks Kliininen farmakologia ja varotoimet).
ylin
Kuinka toimitetaan
provigil® (modafiniili) tabletit
100 mg: Jokaisessa kapselinmuotoisessa, valkoisessa, päällystämättömässä tabletissa on toisella puolella merkintä "Provigil" ja toisella "100 MG".
NDC 63459-101-01 - 100 pullon pullot
200 mg: Jokaisessa kapselinmuotoisessa, valkoisessa, rei'ittämättömässä, päällystämättömässä tabletissa on merkintä "Provigil" toisella puolella ja "200 MG" toisella.
NDC 63459-201-01 - 100 pullon pullot
Varastoi lämpötilassa 20 - 25 ° C (68 - 77 ° F).
Valmistettu:
Cephalon, Inc.
Frazer, PA 19355
US-patentit nro. RE37,516 / 4,927,855
© Cephalon, Inc., 2008. Kaikki oikeudet pidätetään
PROV-011
Viimeksi päivitetty: 03.8
Provigilin (modafiniili) potilastiedot (selkeästi englanniksi)
Yksityiskohtaiset tiedot sivustosta Unihäiriöiden merkit, oireet, syyt ja hoidot
Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötapoja, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysymyksiä käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta.
takaisin:
~ kaikki artikkelit unihäiriöistä



