Iloperidoni (fanapt) Täydelliset lääkemääräykset
Tuotemerkki: Fanapt
Yleinen nimi: Iloperidone
Fanapt (Iloperidone) reseptioppaat (PDF)
Sisällys:
Varoitus ruudussa
Käyttöaiheet ja käyttö
Annostelu ja hallinnointi
Vasta
Varoitukset ja varotoimet
Haitalliset reaktiot
Lääkkeiden yhteisvaikutukset
Käyttö tietyissä populaatioissa
Huumeiden väärinkäyttö ja riippuvuus
yliannos
Kuvaus
Kliininen farmakologia
Ei-kliininen toksikologia
Kliiniset tutkimukset
Kuinka toimitetaan
Brintellix-lääkitysopas
VAROITUS: DEMENTIAAN LIITTYVÄN PSYKOSISIN KOSKEVAN KORKEUKSEN KÄYTTÖ Ikääntyneissä potilaissa
Vanhoilla potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan antipsykoottisilla lääkkeillä, on lisääntynyt kuoleman riski. FANAPT-valmistetta ei ole hyväksytty dementiaan liittyvän psykoosin hoitoon.
Käyttöaiheet ja käyttö
FANAPT® on tarkoitettu skitsofrenian hoitoon aikuisilla.
Päättäessään tämän sairauden käytettävissä olevien vaihtoehtoisten hoitomuotojen joukosta lääkärin tulisi ottaa huomioon havainto, että FANAPT liittyy QTc-ajan pidentymiseen. Joissakin muissa lääkkeissä QTc-ajan pidentyminen liittyy kykyyn aiheuttaa ylävartaloa pointes-tyyppinen rytmihäiriö, mahdollisesti kuolemaan johtava polymorfinen kammion takykardia, joka voi johtaa äkilliseen kuolema. Monissa tapauksissa tämä johtaisi johtopäätökseen, että ensin tulisi kokeilla muita huumeita. Vielä siitä, aiheuttaako FANAPT torsade de pointes tai lisää äkillisen kuoleman nopeutta, ei vielä tiedä.
Potilaat on titrattava tehokkaalle FANAPT-annokselle. Siten oireiden hallinta voi viivästyä ensimmäisen 1-2 hoitoviikon aikana verrattuna joihinkin muihin psykoosilääkkeisiin, jotka eivät vaadi samanlaista titrausta. Reseptoreiden tulee ottaa huomioon tämä viivästyminen valittaessa antipsykoottista lääkettä skitsofrenian hoitoon.
jatka tarinaa alla
Annostelu ja hallinnointi
Tavallinen annos
FANAPT on titrattava hitaasti pienestä aloitusannoksesta ortostaattisen hypotension välttämiseksi sen alfa-adrenergisten salpaavien ominaisuuksien takia. FANAPT-tablettien suositeltu aloitusannos on 1 mg suun kautta kahdesti päivässä. Annosta voidaan suurentaa tavoitealueelle 6 - 12 mg kahdesti päivässä (12_24 mg / päivä) voidaan tehdä päivittäisillä annostuksilla, jotka eivät ylitä 2 mg kahdesti päivässä (4 mg / päivä). Suurin suositeltava annos on 12 mg kahdesti päivässä (24 mg / päivä). Yli 24 mg / vrk FANAPT-annoksia ei ole arvioitu systemaattisesti kliinisissä tutkimuksissa. Tehokkuus osoitettiin FANAPT: llä annoksella 6 - 12 mg kahdesti päivässä. Lääkkeiden määrääjien tulee olla tietoisia siitä, että potilaat on titrattava tehokkaalle FANAPT-annokselle. Siten oireiden hallinta voi viivästyä ensimmäisen 1-2 hoitoviikon aikana verrattuna joihinkin muihin psykoosilääkkeisiin, jotka eivät vaadi samanlaista titrausta. Lääkkeiden määrääjien tulee myös olla tietoisia siitä, että jotkut FANAPT-valmisteen käyttöön liittyvät haittavaikutukset riippuvat annoksesta. FANAPT voidaan antaa riippumatta aterioista.
Annostus erityisryhmissä
Annoksen muuttaminen potilaille, jotka käyttävät FANAPTia samanaikaisesti potentiaalisten CYP2D6-estäjien kanssa: FANAPT-annoksen tulisi olla vähenee puoleen, kun sitä annetaan samanaikaisesti vahvojen CYP2D6-estäjien, kuten fluoksetiinin tai paroksetiinin kanssa. Kun CYP2D6-estäjä lopetetaan yhdistelmähoidosta, FANAPT-annosta tulee suurentaa sen jälkeen, kun se oli aiemmin.
Annoksen muuttaminen potilaille, jotka käyttävät FANAPTia samanaikaisesti potentiaalisten CYP3A4-estäjien kanssa: FANAPT-annoksen tulisi olla vähenee puoleen, kun sitä annetaan samanaikaisesti vahvojen CYP3A4-estäjien, kuten ketokonatsolin tai klaritromysiini. Kun CYP3A4-estäjä lopetetaan yhdistelmähoidosta, FANAPT-annosta tulee lisätä siihen, missä se oli ennen.
Annoksen muuttaminen FANAPTia käyttävillä potilailla, jotka ovat heikosti CYP2D6: n metaboloijia: FANAPT-annosta tulee pienentää puoleen CYP2D6: n huonojen metaboloijien tapauksessa.
Maksan vajaatoiminta: FANAPT-annoksen muuttamista ei tarvita potilailla, joilla on lievä maksan vajaatoiminta. Potilaat, joilla on kohtalainen maksan vajaatoiminta, voivat vaatia annoksen pienentämistä, jos se on kliinisesti tarpeen. FANAPT-valmistetta ei suositella potilaille, joilla on vaikea maksan vajaatoiminta.
Ylläpitohoito
Pidemmällä aikavälillä tehdyssä tutkimuksessa FANAPT viivästyi tehokkaasti uusiutumisaikaa skitsofreniapotilailla, joiden vakauden ollessa FANAPT saavutettiin korkeintaan 24 mg / vrk. Potilaita tulee arvioida säännöllisesti ylläpitohoidon tarpeen määrittämiseksi.
Hoidon uudelleen aloittaminen potilaille, jotka on aiemmin lopetettu, vaikka ei ole tietoja, jotka koskisivat uudelleen Hoidon aloittamisen jälkeen on suositeltavaa noudattaa titrauksen aloitusaikataulua aina, kun potilailla on ollut FANAPT-hoidosta pidempi aika kuin 3 päivää.
ylin
Annosmuodot ja vahvuudet
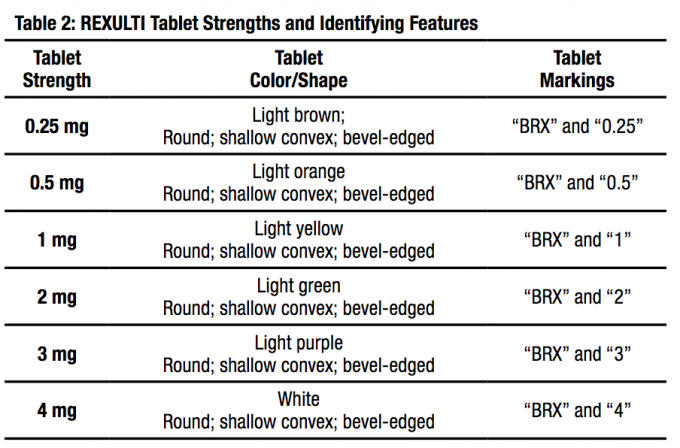
FANAPT-tabletteja on saatavana seuraavina vahvuuksina: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg ja 12 mg. Tabletit ovat valkoisia, pyöreitä, litteitä, viistoreunaisia ja merkitty logolla ””, jonka toisella puolella on painatus ja tabletin lujuus ”1”, “2”, “4”, “6”, “8”, “10”, tai ”12”, toisella puolella kohokuvioitu.
ylin
Vasta
FANAPT on vasta-aiheinen henkilöille, joilla on tunnettu yliherkkyysreaktio tuotteelle. Anafylaksia, angioödeema ja muut yliherkkyysreaktiot on ilmoitettu.
ylin
VAROITUKSET JA VAROTOIMET
Lisääntynyt kuolleisuus ikääntyneillä potilailla, joilla on dementiaan liittyvä psykoosi
Antipsykoottiset lääkkeet lisäävät dementiaan liittyvän psykoosin aiheuttamien ikääntyneiden potilaiden kuolemanvaaraa kaikista syistä. Analyysit 17 dementiaan liittyvästä psykoosista tehdyssä lumelääkekontrolloidussa tutkimuksessa (modaalin kesto 10 viikkoa ja suurelta osin epätyypillisiä potilaita antipsykoottiset lääkkeet) paljasti huumehoitoa saaneiden potilaiden kuolemanriskin 1,6 - 1,7-kertaiseksi plasebohoitoa saaneiden potilaiden kanssa. Tyypillisen 10 viikon kontrolloidun tutkimuksen aikana huumeilla hoidettujen potilaiden kuolleisuus oli noin 4,5%, kun taas lumelääkkeellä hoidettujen potilaiden kuolleisuus oli noin 2,6%.
Vaikka kuoleman syyt olivat erilaisia, suurin osa kuolemista näytti olevan luonteeltaan joko sydän- ja verisuonitauteja (esim. Sydämen vajaatoiminta, äkillinen kuolema) tai tarttuvia (esim. Keuhkokuume). FANAPT-valmistetta ei ole hyväksytty dementiaan liittyvän psykoosin hoitoon.
Serebrovaskulaariset haittavaikutukset, mukaan lukien aivohalvaus, iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi
Plasebokontrolloiduissa tutkimuksissa dementiaa sairastavilla iäkkäillä potilailla potilaat satunnaistettiin risperidoniin, aripipratsolilla ja olantsapiinilla oli korkeampi aivohalvauksen ja ohimenevän iskeemisen kohtauksen, mukaan lukien kuolemaan johtava aivohalvaus. FANAPT-valmistetta ei ole hyväksytty dementiaan liittyvän psykoosin hoitoon.
QT-ajan pidentäminen
Avoimessa QTc-tutkimuksessa skitsofreniaa tai skitsoafektiivista häiriötä sairastavilla potilailla (n = 160) FANAPT liittyi QTc-ajan pitenemiseen 9 ms: lla iloperidoniannoksella 12 mg kahdesti päivässä. FANAPT: n vaikutusta QT-ajanjaksoon lisäsi CYP450 2D6- tai 3A4-metabolinen estäminen (vastaavasti 20 mg paroksetiini kerran päivässä ja 200 mg ketokonatsoli kahdesti päivässä). Metabolisen eston olosuhteissa sekä 2D6: lle että 3A4: lle FANAPT 12 mg kahdesti päivässä liitettiin QTcF: n keskimääräiseen nousuun lähtötasosta noin 19 ms.
Markkinoille saattamista edeltävän kliinisen ohjelman aikana ei havaittu torsade de pointes -tapauksia tai muita vakavia sydämen rytmihäiriöitä.
FANAPT: n käyttöä tulisi välttää yhdessä muiden lääkkeiden kanssa, joiden tiedetään pidentävän QTc: tä, mukaan lukien luokka 1A (esim. Kinidiini, prokainamidi) tai luokan III (esim. amiodaroni, sotaloli) rytmihäiriölääkkeet, psykoosilääkkeet (esim. klooripromatsiini, tioridatsiini), antibiootit (esim. gatifloksasiini, moksifloksasiini) tai mikä tahansa muu lääkeryhmä, jonka tiedetään pidentävän QTc-aikaa (esim. pentamidiini, levometadyyliasetaatti, metadoni). FANAPT-valmistetta tulisi välttää myös potilailla, joilla on synnynnäinen pitkä QT-oireyhtymä ja potilailla, joilla on aiemmin ollut sydämen rytmihäiriöitä.
Tietyt olosuhteet voivat lisätä torsade de pointes- ja / tai äkillisen kuoleman riskiä QTc-ajan pidentävien lääkkeiden käytön yhteydessä, mukaan lukien (1) bradykardia; (2) hypokalemia tai hypomagnesemia; (3) muiden lääkkeiden samanaikainen käyttö, jotka pidentävät QTc-aikaa; ja (4) QT-ajan synnynnäinen pidentyminen; (5) äskettäinen akuutti sydäninfarkti; ja / tai (6) kompensoimaton sydämen vajaatoiminta.
Varovaisuus on tarpeen, kun FANAPTia määrätään lääkkeiden kanssa, jotka estävät FANAPT-aineenvaihduntaa, ja potilaille, joiden CYP2D6-aktiivisuus on heikentynyt.
On suositeltavaa, että FANAPT-hoitoon harkittavat potilaat, joilla on merkittävän riskin riski elektrolyyttihäiriöillä on lähtötasolla seerumin kalium- ja magnesiummittauksia säännöllisin väliajoin seuranta. Hypokalemia (ja / tai hypomagnesemia) voi lisätä QT-ajan pitenemisen ja rytmihäiriön riskiä. FANAPT-hoitoa tulisi välttää potilailla, joilla on ollut merkittäviä sydän- ja verisuonisairauksia, esim. QT pidentyminen, äskettäinen akuutti sydäninfarkti, kompensoimaton sydämen vajaatoiminta tai sydämen rytmihäiriöt. FANAPT-hoito tulisi lopettaa, jos potilaalla todetaan jatkuvia QTc-mittauksia> 500 ms.
Jos FANAPTia käyttävillä potilailla esiintyy oireita, jotka voivat viitata sydämen rytmihäiriöiden esiintymiseen, esimerkiksi huimaus, sydämentykytys tai pyörtyminen, lääkärin tulee aloittaa lisäarviointi, mukaan lukien sydän seuranta.
Pahanlaatuinen neuroleptinen oireyhtymä (NMS)
Mahdollisesti fataalin oirekompleksin, jota joskus kutsutaan pahanlaatuiseksi neuroleptiseksi oireyhtymäksi (NMS), on raportoitu antipsykoottisten lääkkeiden, mukaan lukien FANAPT, annon yhteydessä. Kliinisiin oireisiin kuuluvat hyperpyreksia, lihasjäykkyys, muuttunut henkinen tila (mukaan lukien katatoniset oireet) ja todisteet itsenäisestä epävakaudesta (epäsäännöllinen pulssi tai verenpaine, takykardia, diaforeesi ja sydän rytmihäiriöt). Muita merkkejä voivat olla kohonnut kreatiinifosfokinaasi, myoglobinuria (rabdomyolyysi) ja akuutti munuaisten vajaatoiminta. Tämän oireyhtymän diagnosointi on monimutkaista. Diagnoosin saavuttamisessa on tärkeää tunnistaa tapaukset, joihin kliininen esitys sisältää sekä vakava lääketieteellinen sairaus että hoitamattomat tai riittämättömästi hoidetut ekstrapyramidaaliset merkit ja oireet (EPS). Muita tärkeitä näkökohtia differentiaalidiagnostiikassa ovat keskeinen antikolinerginen toksisuus, lämpöhalvaus, lääkekuume ja primaarinen keskushermosto (CNS) -patologia.
Tämän oireyhtymän hallintaan tulisi kuulua: (1) antipsykoottisten lääkkeiden ja muiden lääkkeiden, jotka eivät ole välttämättömiä samanaikaisessa terapiassa, lopettaminen välittömästi, (2) intensiivinen oireenmukainen hoito ja lääketieteellinen seuranta, ja (3) mahdollisten samanaikaisten vakavien lääketieteellisten ongelmien hoito, joille on saatavana erityishoitoa. NMS: n spesifisistä farmakologisista hoitojärjestelmistä ei ole yleistä sopimusta.
Jos potilas vaatii antipsykoottista lääkehoitoa NMS: stä toipumisen jälkeen, lääkehoidon mahdollista aloittamista uudelleen on harkittava huolellisesti. Potilasta on seurattava huolellisesti, koska NMS: n uusiutumista on ilmoitettu.
Tardiivi dyskinesia
Tardiivi dyskinesia on oireyhtymä, joka koostuu mahdollisesti peruuttamattomista, tahattomista, dyskineettisistä liikkeistä, jotka voivat kehittyä antipsykoottisilla lääkkeillä hoidetuilla potilailla. Vaikka oireyhtymä esiintyy eniten ikääntyneillä, etenkin vanhuksilla, sitä ei voida tehdä luottaa levinneisyysarvioihin ennustaakseen antipsykoottisen hoidon alkaessa potilaille todennäköisesti kehittyvän oireyhtymä. Ei tunneta, onko antipsykoottisilla lääkevalmisteilla eroja potentiaalisuudestaan aiheuttaa myöhäistä dyskinesiaa.
Tardivisen dyskinesian kehittymisen riskiin ja todennäköisyyteen, että se muuttuu peruuttamattomaksi, uskotaan kasvaa hoidon keston ja annetun antipsykoottisen lääkkeen kokonaismäärän perusteella lisääntyy. Oireyhtymä voi kuitenkin kehittyä, vaikkakin paljon harvemmin, suhteellisen lyhyiden hoitojaksojen jälkeen pienillä annoksilla.
Pitkäaikaisen dyskinesian vakiintuneille tapauksille ei ole tunnettua hoitoa, vaikka oireyhtymä voikin kestää osittain tai kokonaan, jos antipsykoottinen hoito lopetetaan. Itse antipsykoottinen hoito voi kuitenkin tukahduttaa (tai tukahduttaa osittain) oireyhtymän merkit ja oireet ja voi siten peittää taustalla olevan prosessin. Oireenmukaisen tukahduttamisen vaikutusta oireyhtymän pitkäaikaiseen kulkuun ei tunneta.
Nämä näkökohdat huomioon ottaen FANAPT tulisi määrätä tavalla, joka todennäköisimmin minimoi tardiivisen dyskinesian esiintymisen. Krooninen antipsykoottinen hoito tulisi yleensä varata potilaille, jotka kärsivät kroonisesta sairaudesta, jonka (1) tiedetään reagoivan antipsykoottiset lääkkeet ja (2) joille ei ole saatavana vaihtoehtoisia, yhtä tehokkaita, mutta mahdollisesti vähemmän haitallisia hoitoja, tai sopiva. Potilaille, jotka vaativat kroonista hoitoa, on haettava pienin annos ja lyhyin hoidon kesto, joka tuottaa tyydyttävän kliinisen vasteen. Hoidon jatkamisen tarve on arvioitava uudelleen määräajoin.
Jos FANAPT-hoitoa saavilla potilailla ilmenee tardiivisen dyskinesian oireita, lääkityksen lopettamista tulee harkita. Jotkut potilaat voivat kuitenkin tarvita FANAPT-hoitoa oireyhtymästä huolimatta.
Metaboliset muutokset
Epätyypillisiin antipsykoottisiin lääkkeisiin on liitetty aineenvaihdunnan muutoksia, jotka voivat lisätä sydän- ja verisuoni- / aivo-verisuoniriskiä. Näihin aineenvaihdunnan muutoksiin kuuluvat hyperglykemia, dyslipidemia ja painon nousu. Vaikka kaikkien epätyypillisten antipsykoottisten lääkkeiden on osoitettu aiheuttavan joitain metabolisia muutoksia, jokaisella luokan lääkkeellä on oma erityinen riskiprofiilinsa.
Hyperglykemia ja diabetes Mellitus
Hyperglykemiaa, joissakin tapauksissa äärimmäistä ja joka liittyy ketoasidoosiin tai hyperosmolaariseen koomaan tai kuolemaan, on ilmoitettu potilailla, joita on hoidettu epätyypillisillä antipsykoottisilla lääkkeillä, mukaan lukien FANAPT. Epätyypillisen antipsykoottisen käytön ja glukoosihäiriöiden välisen suhteen arviointi on monimutkainen mahdollisuudesta lisätä diabeteksen taustan riski skitsofreniapotilailla ja yleistyvä diabetes mellituksen esiintyvyys väestö. Kun otetaan huomioon nämä tunnustajat, epätyypillisen antipsykoottisen käytön ja hyperglykemiaan liittyvien haittavaikutusten välistä suhdetta ei ymmärretä täysin. Epidemiologiset tutkimukset kuitenkin viittaavat hyperglykemiaan liittyvien haittavaikutusten lisääntyneeseen riskiin potilailla, joita hoidetaan näihin tutkimuksiin sisältyvillä epätyypillisillä psykoosilääkkeillä.
Potilaita, joilla on todettu diabetes mellitusdiagnoosi ja jotka ovat aloittaneet epätyypillisillä antipsykoottisilla lääkkeillä, on seurattava säännöllisesti verensokerin hallinnan heikentymisen varalta. Potilaat, joilla on diabetes mellituksen riskitekijöitä (esim. Lihavuus, diabeteksen perheen historia) ja jotka aloittavat hoidon epätyypillisten psykoosilääkkeiden tulee olla paastoverensokeritutkimuksia hoidon alussa ja määräajoin hoidon aikana hoitoa. Kaikkia epätyypillisillä psykoosilääkkeillä hoidettuja potilaita on tarkkailtava hyperglykemian oireiden mukaan lukien polydipsia, polyuria, polyphagia ja heikkous. Potilaiden, joilla ilmenee hyperglykemian oireita epätyypillisillä antipsykoottisilla lääkkeillä, tulee suorittaa paastoverensokeritestit. Joissakin tapauksissa hyperglykemia on lakannut, kun epätyypillinen antipsykootti lopetettiin; jotkut potilaat kuitenkin vaativat antidiabeettisen hoidon jatkamista epäillyn lääkityksen lopettamisesta huolimatta.
Tiedot 4-viikkoisesta kiinteän annoksen tutkimuksesta skitsofreniaa sairastavilla aikuisilla koehenkilöillä, joista vedettiin paastoverenäytteitä, on esitetty taulukossa 1.
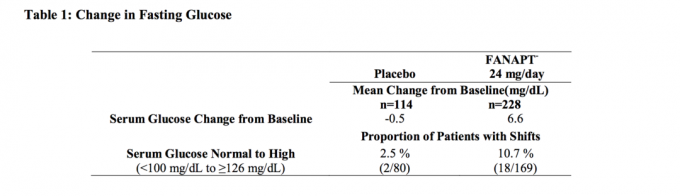
Kliinisistä tutkimuksista tehdyt glukoositietojen yhdistetyt analyysit, mukaan lukien pidemmät tutkimukset, on esitetty taulukossa 2.
dyslipidemia
Epätyypillisillä antipsykoottisilla lääkkeillä hoidetuilla potilailla on havaittu haittavaikutuksia lipideissä.
Taulukossa 3 esitetään tiedot lumelääkekontrolloidusta, 4 viikon, kiinteän annoksen tutkimuksesta, jossa vedettiin paastoverenäytteitä aikuisilla, joilla on skitsofrenia.

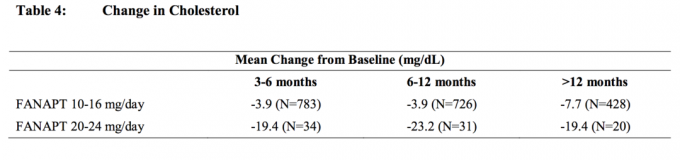
Taulukossa 4 ja taulukossa 5 esitetään kolesteroli- ja triglyseriditietojen yhdistelmäanalyysit kliinisistä tutkimuksista, mukaan lukien pitkäaikaiset tutkimukset.

Painonnousu
Painonnousu on havaittu epätyypillisessä antipsykoottisessa käytössä. Painon kliinistä seurantaa suositellaan.
Kaikissa lyhyen ja pitkän aikavälin tutkimuksissa keskimääräinen muutos lähtötilanteesta loppupisteessä oli 2,1 kg.
Painon muutokset (kg) ja niiden henkilöiden osuus, joiden painonnousu ≥7%, 4: sta lumelääkekontrolloidut, 4 tai 6 viikon, kiinteän tai joustavan annoksen tutkimukset aikuisilla koehenkilöillä esitetään Taulukko 6.

takavarikot
Lyhytaikaisissa lumekontrolloiduissa tutkimuksissa (4–6 viikkoa) kouristuskohtauksia esiintyi 0,1%: lla (1/1344) FANAPT-hoitoa saaneista potilaista, kun taas lumelääkeryhmässä 0,3% (2/587). Kuten muidenkin psykoosilääkkeiden kanssa, FANAPT-valmistetta tulee käyttää varoen potilaille, joilla on ollut kouristuskohtauksia tai tiloissa, jotka saattavat alentaa kouristuskynnystä. Kohteet, jotka alentavat kouristuskynnystä, voivat olla yleisempiä vähintään 65-vuotiailla.
Ortostaattinen hypotensio ja pyörtyminen
FANAPT voi aiheuttaa ortostaattista hypotensiota, joka liittyy huimaukseen, takykardiaan ja pyörtymiseen. Tämä heijastaa sen alfa-1-adrenergisiä antagonistia. Tuplasokeilla lumekontrolloiduissa lyhytaikaisissa tutkimuksissa, joissa annosta nostettiin hitaasti, kuten suositellaan edellä, pyörtymistä ilmoitettiin 0,4%: lla (5/1344) FANAPT-hoitoa saaneista potilaista, kun taas 0,2%: lla (1/587) plasebo. Ortostaattista hypotensiota ilmoitettiin 5%: lla potilaista, joille annettiin 20–24 mg / vrk, 3%: lla potilaista, joille annettiin 10–16 mg / vrk, ja 1%: lla potilaista, jotka saivat lumelääkettä. Nopeamman titrauksen odotetaan lisäävän ortostaattisen hypotension ja pyörtymisen nopeutta.
FANAPT-valmistetta tulee käyttää varoen potilailla, joilla tunnetaan sydän- ja verisuonisairaus (esim. Sydämen vajaatoiminta, sydäninfarktin historia, iskemia tai johtavuus) poikkeavuudet), aivo-verisuonisairaudet tai tilat, jotka altistavat potilaan hypotensioon (dehydraatio, hypovolemia ja verenpainelääkkeiden hoito) lääkitys). Ortostaattisten elintoimintojen seurantaa tulisi harkita potilailla, jotka ovat alttiita hypotensioon.
Leukopenia, neutropenia ja agranulosytoosi
Kliinisessä tutkimuksessa ja markkinoille saattamisen jälkeisessä kokemuksessa leukopenian / neutropenian tapahtumia on ilmoitettu liittyvän ajallisesti antipsykoottisiin lääkkeisiin. Agranulosytoosia (mukaan lukien kuolemaan johtavat tapaukset) on myös ilmoitettu.
Mahdollisia leukopenian / neutropenian riskitekijöitä ovat esiintynyt alhainen valkosolujen määrä (WBC) ja aiemmat lääkkeiden aiheuttamat leukopeniat / neutropeniat. Potilaiden, joilla on aiemmin ollut alhainen WBC-arvo tai joilla on aiemmin ollut lääkkeiden aiheuttamaa leukopeniaa / neutropeniaa, täydellistä verenkuvaa (CBC) tulee seurata usein hoidon ensimmäisten kuukausien aikana, ja sen tulisi lopettaa FANAPT-hoito, kun ensimmäinen merkki WBC-arvon laskusta on, jos muuta syytä ei esiinny tekijät.
Neutropeniaa sairastavia potilaita on seurattava huolellisesti kuumetta tai muita oireita tai infektion oireita varten ja hoidettava heti, jos tällaisia oireita tai oireita ilmenee. Potilaiden, joilla on vaikea neutropenia (absoluuttinen neutrofiilimäärä <1000 / mm3), tulisi lopettaa FANAPT-hoito ja seurata WBC: tä toipumiseen saakka.
hyperprolaktinemia
Kuten muidenkin dopamiini D2 -reseptoreita antagonisoivien lääkkeiden kanssa, FANAPT nostaa prolaktiinitasoja.
Hyperprolaktinemia voi tukahduttaa hypotalamuksen GnRH: n, mikä johtaa aivolisäkkeen gonadotropiinin erityksen vähentymiseen. Tämä puolestaan voi estää lisääntymistoimintoa heikentämällä nuoren sukupolven steroidogeneesiä sekä naisilla että miehillä. Galaktorrreaa, amenorreaa, gynekomastiaa ja impotenssia on ilmoitettu prolaktiinia nostavien yhdisteiden kanssa. Hypogonadismiin liittyvä pitkäaikainen hyperprolaktinemia voi vähentää luutiheyttä sekä naisilla että miehillä.
Kudosviljelykokeet osoittavat, että noin kolmasosa ihmisen rintasyövistä on prolaktiiniriippuvaisia in vitro, a Mahdollisesti tärkeä tekijä, jos näiden lääkkeiden määräämistä harkitaan potilaalla, jolla on aiemmin havaittu rinta syöpä. FANAPT: lla hoidetuilla hiirillä ja rotilla havaittiin nisäkkäiden rauhasten proliferatiivisia muutoksia ja seerumin prolaktiinin määrän nousua. Tähän päivään mennessä tehdyt kliiniset tutkimukset tai epidemiologiset tutkimukset eivät ole osoittaneet yhteyttä tämän lääkeryhmän kroonisen antamisen ja ihmisillä tapahtuvan tuumorigeneesin välille. käytettävissä olevia todisteita pidetään liian rajoittuneina voidakseen olla ratkaisevia tällä hetkellä.
Lyhytaikaisessa plasebokontrolloidussa tutkimuksessa (4 viikkoa) keskimääräinen muutos lähtötilanteesta päätepisteeseen plasman prolaktiinitasoissa FANAPT-valmisteella, joka oli 24 mg / vrk käsitelty ryhmä, kasvu oli 2,6 ng / ml verrattuna 6,3 ng / ml: n laskuun plasebo-ryhmän. Tässä tutkimuksessa plasman prolaktiinipitoisuuksia havaittiin 26%: lla FANAPT-hoitoa saaneista aikuisista verrattuna lumelääkeryhmän 12%: iin. Lyhytaikaisissa tutkimuksissa FANAPT liittyi prolaktiinipitoisuuden vaatimattomaan määrään verrattuna suurempiin prolaktiinipitoisuuksiin, joita havaittiin joidenkin muiden psykoosilääkkeiden kanssa. Kliinisten tutkimusten yhdistetyssä analyysissä, joka sisälsi myös pitkäaikaiset tutkimukset, 3210 aikuisella, jota hoidettiin iloperidonilla, gynekomastiaa todettiin kahdella miespuolisella (0,1%). verrattuna 0%: iin plasebohoitoa saaneilla potilailla, ja galaktorreaa ilmoitettiin kahdeksalla naishenkilöllä (0,2%) verrattuna 3 naishenkilöön (0,5%) plaseboa saaneilla potilailla potilaita.
Kehon lämpötilan sääntely
Antipsykoottisilla aineilla on syytetty kehon kykyyn alentaa kehon lämpötilaa. Asianmukaista hoitoa suositellaan, kun määrätään FANAPT-valmistetta potilaille, jotka kokevat olosuhteita, jotka voivat vaikuttaa ydinkehon nousuun. lämpötila, esimerkiksi harjoittamalla raskaasti, altistuminen äärimmäiselle kuumuudelle, samanaikaisen lääkityksen saaminen antikolinergisen vaikutuksen kanssa tai nestehukka.
dysfagia
Ruokatorven dysmotiliteetti ja aspiraatio on liitetty antipsykoottisten lääkkeiden käyttöön. Aspiraatiokeuhkokuume on yleinen ikäisten potilaiden sairastuvuuden ja kuolleisuuden syy. FANAPT-valmistetta ja muita antipsykoottisia lääkkeitä tulee käyttää varoen potilailla, joilla on aspiraatiopneumonia.
itsemurha
Itsemurhayrityksen mahdollisuus liittyy luonnostaan psykoottisiin sairauksiin, ja lääkehoidon tulee seurata riskialttiiden potilaiden tarkkaa valvontaa. FANAPT-reseptit tulee kirjoittaa pienimmälle määrälle tabletteja, jotka vastaavat potilaan hyvää hallintaa yliannostuksen riskin vähentämiseksi.
priapismi
Kolme priapismitapausta ilmoitettiin markkinoille saattamista edeltävässä FANAPT-ohjelmassa. Alfa-adrenergisiä salpaavia lääkkeitä on ilmoitettu aiheuttavan priapismia. FANAPT jakaa tämän farmakologisen vaikutuksen. Vakava priapismi voi vaatia kirurgista interventiota.
Kognitiivisen ja motorisen heikentymisen potentiaali
FANAPT, kuten muutkin psykoosilääkkeet, voi vahingoittaa harkintaa, ajattelua tai motorisia taitoja. Lyhytaikaisissa, lumekontrolloiduissa tutkimuksissa uneliaisuutta (mukaan lukien sedaatio) ilmoitettiin 11,9%: lla (104/874) aikuiset potilaat, joita hoidettiin FANAPT-valmisteella annoksilla 10 mg / vrk tai 5,3% (31/587) plasebo. Potilaita tulee varoittaa vaarallisten koneiden, mukaan lukien autot, käytöstä, kunnes he ovat kohtuullisen varmoja siitä, että FANAPT-hoito ei vaikuta heihin haitallisesti.
ylin
Haitalliset reaktiot
Kliinisten tutkimusten kokemus
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, haittavaikutusten määrät havaittiin lääkkeen kliinisessä tutkimuksessa ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa esiintyviin määriin, eivätkä ehkä heijasta kliinisissä tutkimuksissa havaittuja määriä harjoitella. Alla olevat tiedot on johdettu kliinisen tutkimuksen tietokannasta FANAPT: lle, joka koostuu 3229 potilaasta, jotka altistetaan FANAPT: lle vähintään 10 mg / vrk: n annoksilla skitsofrenian hoitoon. Näistä 999 sai FANAPTia vähintään kuuden kuukauden ajan, ja 657 sai altistumisen FANAPTille vähintään 12 kuukauden ajan. Kaikki nämä FANAPTia saaneet potilaat osallistuivat moniannoksisiin kliinisiin tutkimuksiin. FANAPT-hoidon olosuhteet ja kesto vaihtelivat suuresti ja sisältyivät (päällekkäisiin luokkiin), avoimiin ja kaksoissokkotutkimuksen vaiheet, potilaat ja avohoidot, kiinteän annoksen ja joustavan annoksen tutkimukset sekä lyhytaikaiset ja pitkäaikaiset valotus.
Näissä osioissa esitetyt tiedot on johdettu yhdistetyistä tiedoista neljästä lumelääkekontrolloidusta, 4- tai 6 viikosta, kiinteät tai joustavat annostutkimukset potilailla, jotka saivat FANAPTia vuorokausiannoksina 10–24 mg (N = 874).
Haittavaikutukset, jotka esiintyvät vähintään 2% FANAPT-hoitoa saaneilla potilailla ja useammin kuin lumelääke
Taulukossa 7 on lueteltu haittavaikutusten yhdistelmät, joita ilmoitettiin spontaanisti neljässä lumelääkekontrolloidussa, 4 tai 6 viikossa, kiinteän tai joustavan annoksen tutkimukset, joissa luetellaan ne reaktiot, joita tapahtui vähintään 2%: lla FANAPTilla hoidetuista potilaista ja joiden esiintyvyys FANAPT-hoitoa saaneilla potilailla oli suurempi kuin millä tahansa annosryhmällä kuin plasebo.

Annokseen liittyvät haittavaikutukset kliinisissä tutkimuksissa
Perustuu neljään lumekontrolloidun, 4 tai 6 viikon kiinteän tai joustavan annoksen tutkimuksesta koottuihin tietoihin haittavaikutukset, joita esiintyi yli 2%: lla esiintyvyys FANAPT-hoitoa saaneilla potilailla ja joiden esiintyvyys potilailla, joita hoidettiin FANAPT-valmisteella 20–24 mg / vrk, oli kaksi kertaa suurempi kuin Potilailla, joita hoidettiin FANAPT 10-16 mg / vrk, olivat: vatsan epämukavuus, huimaus, hypotensio, tuki- ja liikuntaelinten jäykkyys, takykardia ja paino lisääntynyt.
Yleiset ja lääkkeisiin liittyvät haittavaikutukset kliinisissä tutkimuksissa
Perustuu neljään lumekontrolloidun, 4 tai 6 viikon kiinteän tai joustavan annoksen tutkimuksesta koottuihin tietoihin, seuraavat haittavaikutukset esiintyivät ≥ 5%: n ilmaantuvuudessa hoidetuilla potilailla FANAPT: llä ja vähintään kahdesti plasebo-rotta e vähintään yhdellä annoksella: huimaus, suun kuivuminen, väsymys, nenän tukkoisuus, uneliaisuus, takykardia, ortostaattinen hypotensio ja paino lisääntynyt. Huimaus, takykardia ja painon nousu olivat ainakin kahdesti yleisimmät annoksilla 20 - 24 mg / päivä kuin 10 - 16 mg / päivä.
Extrapyramidaaliset oireet (EPS) kliinisissä tutkimuksissa
Yhdistetyt tiedot neljästä lumekontrolloidusta, 4 tai 6 viikon kiinteistä tai joustavista annoksista tehdyistä tutkimuksista antoivat tietoa EPS: stä. Näistä tutkimuksista kerätyt haittatapahtumatiedot osoittivat seuraavat EPS: hen liittyvien haittavaikutusten määrät, kuten taulukossa 8 esitetään.

Hoidon lopettamiseen kliinisissä tutkimuksissa liittyvät haittavaikutukset
Neljän lumelääkekontrolloidun, 4 tai 6 viikon, kiinteän tai joustavan annostutkimuksen yhdistettyjen tietojen perusteella ei ollut haittatapahtumien aiheuttaman lopetuksen esiintyvyyden ero FANAPT-hoidossa (5%) ja lumelääkkeellä (5%) potilaita. Hoidon keskeyttämiseen johtaneet haittatapahtumat olivat samanlaisia FANAPT- ja lumelääkehoitoa saaneilla potilailla.
Haittavaikutusten demografiset erot kliinisissä tutkimuksissa
Tutkimus populaatioryhmistä 4 lumelääkekontrolloidussa, 4 tai 6 viikon, kiinteässä tai joustavan annoksen tutkimuksissa ei havaittu näyttöä turvallisuuseroista iän perusteella, sukupuoli tai rotu.
Laboratoriokokeiden poikkeavuudet kliinisissä tutkimuksissa
FANAPT- ja lumelääkeryhmissä ei ollut eroja hematologian, virtsa-analyysin tai seerumin kemiamuutosten aiheuttaman lopetuksen esiintymistiheyden välillä.
Lyhytaikaisissa lumekontrolloiduissa tutkimuksissa (4 - 6 viikkoa) iloperidonilla hoidetuista potilaista oli 1,0% (13/1342) hematokriitti ainakin kerran laajennetun normaalin alueen alapuolella satunnaistamisen jälkeisessä hoidossa, verrattuna 0,3%: iin (2/585) plasebo. Alennetun hematokriitin pidentynyt normaalialue määritettiin jokaisessa näissä kokeissa arvona, joka oli 15% alle tutkimuksessa käytetyn keskitetyn laboratorion normaalin alueen.
Muut reaktiot FANAPT-valmisteen markkinoille saattamista edeltävän arvioinnin aikana
Seuraava on luettelo MedDRA-termeistä, jotka heijastavat haittavaikutuksia FANAPTilla hoidetuilla potilailla useilla annoksilla ≥ 4 mg / päivä missä tahansa tutkimusvaiheessa 3210 FANAPT-käsitellyn tietokannan avulla potilaita. Kaikki ilmoitetut reaktiot sisältyvät lukuun ottamatta niitä, jotka on jo lueteltu taulukossa 7, tai muita haittavaikutusten osia (6), niitä, joita tarkastellaan Varoitukset ja varotoimet (5): reaktio-ehdot, jotka olivat niin yleisiä, että ne eivät olleet tietoisia, reaktiot, joita ilmoitettiin vähemmän kuin 3 potilaalla ja jotka eivät olleet vakavia eikä elämää uhkaavia, reaktioita, jotka ovat muuten yleisiä taustareaktioina, ja reaktioita, joita ei pidetä todennäköisesti lääkkeinä liittyviä.
Reaktiot luokitellaan edelleen MedDRA-elinjärjestelmäluokittain ja luetellaan esiintymistiheyden mukaan seuraavan mukaisesti määritelmät: usein esiintyviä haittavaikutuksia esiintyy vähintään 1/100 potilaalla (tässä ilmoitetaan vain ne, joita ei ole lueteltu taulukossa 7) listaus); harvinaisia haittavaikutuksia ovat ne, joita esiintyy 1/100 - 1/1000 potilaalla; harvinaisia tapahtumia esiintyy vähemmän kuin 1/1000 potilaalla.
Veri- ja imusairaudet: harvinaiset - anemia, raudan puuteanemia; Harvinaiset leukopenia
Sydämen häiriöt: Useita - sydämentykytys; Harvinaiset - rytmihäiriöt, ensimmäisen asteen atrioventrikulaarilohko, sydämen vajaatoiminta (mukaan lukien kongestiivinen ja akuutti)
Korva- ja labyrinttihäiriöt: Harvinainen - kääntöpuoli, tinnitus
Endokriiniset häiriöt: Harvinaiset - kilpirauhasen vajaatoiminta
Silmäsairaudet: Usein - sidekalvotulehdus (mukaan lukien allerginen); Harvinaiset - silmien kuivaus, blefariitti, silmäluomien turvotus, silmien turvotus, linssisilmäisyydet, kaihi, hyperemia (mukaan lukien sidekalvo)
Ruoansulatuskanavan häiriöt: Harvinaiset - gastriitti, syljen hypersekrektio, fekaalinkontinenssi, suun haavaumat; Harvinainen - aftoosinen stomatiitti, pohjukaissuolihaava, hiatus-tyrä, liikakloorihydria, huulten haavaumat, refluksiesofagiitti, stomatiitti
Yleiset häiriöt ja hallinnolliset sijaintipaikat: Harvinaiset - turvotus (yleinen, sydänsairauksien aiheuttama pisteytyminen), kävelyvaikeudet, jano; Harvinainen - hypertermia
Maksa- ja sappihäiriöt: Harvinaiset - sappikivitauti
Tutkimukset: Usein: paino laski; Harvoin - hemoglobiini laski, neutrofiilien määrä kasvoi, hematokriitti laski
Aineenvaihdunta- ja ravitsemushäiriöt: Harvinaiset - lisääntynyt ruokahalu, kuivuminen, hypokalemia, nesteretentio
Tuki- ja liikuntaelinten ja sidekudosten häiriöt: toistuvat - lihaskipu, lihasspasmit; Harvinainen - torticollis
Hermosto: Häiriöt: parestesia, psykomotorinen hyperaktiivisuus, levottomuus, amnesia, nystagmus; Harvinainen - levoton jalkojen oireyhtymä
Psykiatriset häiriöt: Toistuvat - levottomuus, aggressio, harha; Harvoin - vihamielisyys, libido heikentynyt, vainoharhaisuus, anorgasmia, sekava tila, mania, katatonia, mielialan vaihtelut, paniikki hyökkäys, pakko-oireinen häiriö, bulimia nervosa, delirium, polydipsiapsykogeeninen, impulssinohjaushäiriö, merkittävä masennus
Munuaiset ja virtsatiet: Usein - virtsainkontinenssi; Harvoin - dysuria, pollakiuria, enureesi, munuaiskivitauti; Harvinaiset - virtsanpidätys, akuutti munuaisten vajaatoiminta
Lisääntymis- ja rintahäiriöt: Usein - erektiohäiriöt; Infrequen - kiveyskipu, amenorrhea, rintakipu; Harvinaiset - kuukautiset epäsäännölliset, gynekomastia, kuukautiskipu, verenvuoto, vaihdevuosien jälkeinen verenvuoto, eturauhastulehdus.
Hengitys-, rintakehä- ja välikarsinahäiriöt: Harvinaiset - nenäverenvuoto, astma, rinorrhea, sinus tukkeutuminen, nenän kuivuminen; Harvinaiset - kurkun kuivuminen, uniapnea-oireyhtymä, hengenahdistus hengissä
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on havaittu FANAPT-valmisteen hyväksynnän jälkeisen käytön aikana: taaksepäin tapahtuva siemensyöksy ja yliherkkyysreaktiot (mukaan lukien anafylaksia; angioedeema; kurkunpitävyys; suun ja nielun turvotus; kasvojen, huulten, suun ja kielen turvotus; nokkosihottuma; ihottuma; ja kutina). Koska näitä reaktioita ilmoitettiin vapaaehtoisesti epävarman koon populaatiosta, niiden esiintymistiheyttä ei voida luotettavasti arvioida tai syy-yhteyttä huumeiden altistumiseen ei voida määrittää.
ylin
Lääkkeiden yhteisvaikutukset
Kun otetaan huomioon FANAPTin ensisijaiset keskushermostoon kohdistuvat vaikutukset, on noudatettava varovaisuutta, kun sitä käytetään yhdessä muiden keskitetysti vaikuttavien lääkkeiden ja alkoholin kanssa. Alfa1-adrenergisen reseptorin antagonisminsa vuoksi FANAPT voi parantaa tiettyjen verenpainelääkkeiden vaikutusta.
Mahdollisuus muille lääkkeille vaikuttaa FANAPTiin
Iloperidoni ei ole substraatti CYP1A1-, CYP1A2-, CYP2A6-, CYP2B6-, CYP2C8-, CYP2C9-, CYP2C19- tai CYP2E1-entsyymeille. Tämä viittaa siihen, että iloperidonin vuorovaikutus näiden entsyymien estäjien tai indusoijien tai muiden tekijöiden, kuten tupakoinnin, kanssa on epätodennäköistä. Sekä CYP3A4 että CYP2D6 ovat vastuussa iloperidonin metaboliasta. CYP3A4: n (esim. Ketokonatsoli) tai CYP2D6: n (estävät fluoksetiini, paroksetiini) estäjät voivat estää iloperidonin eliminaatiota ja aiheuttaa kohonneita veren pitoisuuksia.
Ketokonatsoli: Ketokonatsolin (200 mg kahdesti päivässä 4 päivän ajan), voimakkaan CYP3A4-estäjän, samanaikainen antaminen 3 mg: n kerta-annoksen iloperidonilla 18–45-vuotiaat terveet vapaaehtoiset kasvattivat iloperidonin ja sen metaboliittien P88 ja P95 käyrän aluetta (AUC) 57%, 55% ja 35%, vastaavasti. Iloperidoniannokset tulisi vähentää noin puolella, kun niitä annetaan ketokonatsolin tai muiden voimakkaiden CYP3A4-estäjien (esim. Itrakonatsolin) kanssa. Heikompia estäjiä (esim. Erytromysiini, greippimehu) ei ole tutkittu. Kun CYP3A4-estäjä lopetetaan yhdistelmähoidosta, iloperidoniannos tulee palauttaa edelliselle tasolle.
Fluoksetiini: Fluoksetiinin (20 mg kahdesti päivässä 21 päivän ajan), voimakkaan CYP2D6: n estäjän, samanaikainen annos yhdellä 3 mg: n annoksella iloperidonia 23 terveelle vapaaehtoiselle, ikä 29 - 44 vuotta, jotka luokiteltiin laajoiksi CYP2D6-metaboloijiksi, kasvattivat iloperidonin ja sen metaboliitin P88 AUC: ta noin 2 - 3-kertaiseksi ja alensivat sen metaboliitin P95 AUC: ta puolikas. Iloperidoniannokset tulisi vähentää puoleen, kun sitä annetaan fluoksetiinin kanssa. Kun fluoksetiini lopetetaan yhdistelmähoidosta, iloperidoniannos tulee palauttaa edelliselle tasolle. Muilla vahvoilla CYP2D6-estäjillä odotetaan olevan samanlaisia vaikutuksia, ja he tarvitsevat asianmukaista annoksen pienentämistä. Kun CYP2D6-estäjä lopetetaan yhdistelmähoidosta, iloperidoniannos voidaan sitten nostaa edelliselle tasolle.
Paroksetiini: Paroksetiinin (20 mg / vrk 5–8 päivän ajan), voimakkaan CYP2D6-estäjän, samanaikainen anto useiden annoksien iloperidonin (8) kanssa. tai 12 mg kahdesti päivässä) skitsofreniaa sairastaville potilaille, joiden ikä oli 18–65-vuotiaita, nostivat keskimääräisiä vakaan tilan huippupitoisuuksia iloperidoni ja sen metaboliitti P88 noin 1,6-kertaisesti, ja sen metaboliitin P95 keskimääräiset vakaan tilan huippupitoisuudet pienenivät puolikas. Iloperidoniannokset tulee vähentää puoleen, kun sitä annetaan paroksetiinin kanssa. Kun paroksetiini lopetetaan yhdistelmähoidosta, iloperidoniannos tulee palauttaa edelliselle tasolle. Muilla vahvoilla CYP2D6-estäjillä odotetaan olevan samanlaisia vaikutuksia, ja he tarvitsevat asianmukaista annoksen pienentämistä. Kun CYP2D6-estäjä lopetetaan yhdistelmähoidosta, iloperidoniannos voidaan sitten nostaa aikaisemmille tasoille.
Paroksetiini ja ketokonatsoli: Paroksetiinin (20 mg kerran päivässä 10 päivän ajan), CYP2D6-estäjän ja ketokonatsolin (200 mg) samanaikainen anto kahdesti päivässä) useilla iloperidoniannoksilla (8 tai 12 mg kahdesti päivässä) skitsofreniapotilaille 18–65-vuotiaille potilaille iloperidonin ja sen metaboliitin P88 vakaan tilan pitoisuuksien nousu ja P95: n lasku 1,4-kertaisesti, kun läsnä on paroksetiini. Joten iloperidonin antaminen estäjien kanssa molemmilla sen metaboliareiteillä ei lisännyt kummankaan estäjän vaikutusta yksinään. Siksi iloperidoniannoksia tulee pienentää noin puolella, jos niitä annetaan samanaikaisesti sekä CYP2D6: n että CYP3A4: n estäjän kanssa.
FANAPT: n mahdollisuus vaikuttaa muihin lääkkeisiin
Ihmisen maksamikrosomeissa tehdyt in vitro -tutkimukset osoittivat, että iloperidoni ei estä olennaisesti mikrobien metaboliaa lääkkeet, jotka metaboloituvat seuraavien sytokromi P450 -entsyymien välityksellä: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 tai CYP2E1. Lisäksi in vitro -tutkimukset ihmisen maksan mikrosomeissa osoittivat, että iloperidonilla ei ole entsyymejä indusoivia vaikutuksia ominaisuudet, erityisesti seuraaville sytokromi P450 -isotsyymeille: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 ja CYP3A5.
Dekstrometorfaani: Terveillä vapaaehtoisilla tehdyssä tutkimuksessa kävi ilmi, että dekstrometorfaanin (80 mg: n annos) farmakokinetiikassa tapahtui muutoksia, kun 3 mg: n annos iloperidonin samanaikainen anto lisäsi kokonaisaltistusta 17% ja 26%: n nousua plasman enimmäispitoisuuksissa C max dekstrometorfaania. Siksi vuorovaikutus iloperidonin ja muiden CYP2D6-substraattien välillä on epätodennäköistä.
Fluoksetiini: Yhdellä 3 mg: n annoksella iloperidonia ei ollut vaikutusta fluoksetiinin (20 mg kahdesti päivässä) farmakokinetiikkaan.
Midatsolaami (herkkä CYP 3A4-substraatti): Skitsofreniapotilailla tehty tutkimus osoitti midatsolaamin kokonaisarvon nousun alle 50% altistuminen iloperidonin vakaan tilan ollessa (14 päivän oraalinen annostus jopa 10 mg iloperidonia kahdesti päivässä) eikä vaikutusta midatsolaami C: hen max. Siksi vuorovaikutus iloperidonin ja muiden CYP3A4-substraattien välillä on epätodennäköistä.
Lääkkeitä, jotka pidentävät QT-intervallia, FANAPT-valmistetta ei tule käyttää muiden lääkkeiden kanssa, jotka pidentävät QT-aikaa.
ylin
Käyttö tietyissä populaatioissa
Raskausaltistuksen rekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet FANAPT-valmisteelle raskauden aikana. Lisätietoja ota yhteyttä epätyypillisten psykoosilääkkeiden kansalliseen raskausrekisteriin numeroon 1-866-961-2388 tai käy http://womensmentalhealth.org/clinical-and -tutkimus-ohjelmat / pregnancyregistry /.
Riskien yhteenveto
Vastasyntyneillä, joiden äidit ovat alttiina psykoosilääkkeille, mukaan lukien FANAPT, raskauden kolmannella kolmanneksella, on riski ekstrapyramidaalisista ja / tai vieroitusoireista synnytyksen jälkeen. Rajalliset käytettävissä olevat tiedot FANAPT-valmisteesta raskaana olevilla naisilla eivät ole riittäviä tietoon huumausaineisiin liittyvästä vakavien synnynnäisten vikojen ja keskenmenon riskistä. Iloperidoni ei ollut teratogeeninen, kun sitä annettiin suun kautta raskaana oleville rotille organogeneesin aikana annoksina, jotka olivat jopa 26-kertaisia ihmisen suurimpaan suositusannokseen, joka on 24 mg / vrk, mg / m2. Se pidensi kuitenkin raskauden ja synnytyksen kestoa, lisäsi kuolleiden syntymää, varhaista kohdunsisäistä kuolemaa, lisääntyi kehitysviiveiden esiintyvyyttä ja vähensi synnytyksen jälkeistä poikasien eloonjäämistä. Iloperidoni ei ollut teratogeeninen, kun sitä annettiin suun kautta raskaana oleville kaniineille organogeneesin aikana annoksina, jotka olivat korkeintaan 20-kertaisia MRHD: tä mg / m2. Kuitenkin se lisäsi varhaisen kohdunsisäisen kuolemantapauksia ja vähensi sikiön elinkykyä korkeimmalla annoksella, joka oli myös äidille toksinen annos.
Suurten synnynnäisten vikojen ja keskenmenon taustariskiä ilmoitetulle populaatiolle ei tunneta. Yhdysvaltojen väestössä arvio kliinisesti tunnustetuista raskauksista johtuvien merkittävien synnynnäisten vikojen ja keskenmenon riskiä on vastaavasti 2 - 4% ja 15 - 20%.
Kliiniset näkökohdat
Sikiön / vastasyntyneen haittavaikutukset
Ekstrapyramidaaliset ja / tai vieroitusoireet, mukaan lukien levottomuus, hypertonia, hypotonia, vapina, uneliaisuus, uroskipu ja syöttöhäiriöitä on ilmoitettu vastasyntyneillä, joiden äidit olivat alttiina psykoosilääkkeille vuoden 2010 kolmannella kolmanneksella raskaus. Näiden oireiden vakavuus on vaihdellut. Jotkut vastasyntyneet toipuivat tunnin tai päivän sisällä ilman erityistä hoitoa; toiset vaativat pitkäaikaista sairaalahoitoa. Tarkkaile vastasyntyneitä ekstrapramidaalisten ja / tai vieroitusoireiden varalta ja hallitse oireita asianmukaisesti.
data
Eläintiedot
Alkion ja sikiön kehitystutkimuksessa raskaana oleville rotille annettiin 4, 16 tai 64 mg / kg / päivä (1,6, 6,5 ja 26 kertaa iloperidonin suurin suositeltava ihmisen annos (MRHD) on 24 mg / päivä (mg / m2) suun kautta suun kautta organogeneesin. Suurin annos aiheutti lisääntynyttä kohdunsisäistä kuolemaa, laskenut sikiön painoa ja pituutta, heikentynyt sikiön luuston luustuminen ja lisääntynyt pienten sikiön luurankojen poikkeavuuksien esiintyvyys ja muunnelmat; tämä annos aiheutti myös vähentyneen äidin ruoan kulutuksen ja painonnousun.
Alkion ja sikiön kehitystutkimuksessa raskaana oleville kaniineille annettiin 4, 10 tai 25 mg / kg / päivä (3, 8 ja 20 kertaa MRHD-arvo mg / m2 perusteella) iloperidonia organogeneesin aikana. Suurin annos aiheutti lisääntynyttä kohdunsisäisen kuoleman ja heikentyneen sikiön elinkykyä kauden aikana; tämä annos aiheutti myös toksisuutta äidille.
Lisäkokeissa, joissa rotille annettiin iloperidonia samanlaisina annoksina kuin yllä, alusta alkaen joko hedelmöityksestä tai alkaen raskauspäivänä 17 ja vieroituksen kautta jatkuneilla lisääntymisvaikutuksilla, mukaan lukien pitkittynyt raskaus ja synnytykset, lisääntyivät kuolleena syntyneiden määrät, lisääntynyt sikiön viskeraalisten variaatioiden esiintyvyys, laskenut sikiön ja pentujen painot ja vähentynyt synnytyksen jälkeinen koiranpentu eloonjääminen. Ei ollut mitään lääkevaikutuksia eloonjääneiden poikien hermo-käyttäytymiseen tai lisääntymiseen. Vaikuttamattomat annokset vaihtelivat 4 - 12 mg / kg lukuun ottamatta kuolleena syntyneiden määrän nousua, joka tapahtui pienimmällä testatulla annoksella 4 mg / kg, joka on 1,6-kertainen MRHD: n suhteen mg / m2. Äitien toksisuus havaittiin suurempina annoksina näissä tutkimuksissa.
Iloperidonimetaboliitti P95, joka on iloperidonin tärkein kiertävä metaboliitti ihmisissä, mutta jota ei esiinny merkitseviä määriä rotilla, annettiin raskaana oleville rotille organogeneesin aikana 20, 80 tai 200 mg: n oraalisina annoksina kg / vrk. Teratogeenisia vaikutuksia ei havaittu. Viivästynyt luuston luutuminen tapahtui kaikilla annoksilla. Merkittävää äidin toksisuutta ei saatu aikaan. P95-pitoisuudet plasmassa (AUC) suurimmalla testatulla annoksella olivat kaksi kertaa suuremmat kuin ihmisillä, jotka saivat iloperidonin MRHD: tä.
imetys
Riskien yhteenveto
Ei ole tietoa iloperidonin tai sen metaboliittien esiintymisestä äidinmaitoon iloperidonin vaikutukset imettävään lapseen eikä iloperidonin vaikutukset äidinmaitoon tuotantoon. Iloperidonia esiintyy rotan maidossa. Koska imettävillä vauvoilla voi olla vakavia haittavaikutuksia, neuvo naista olemaan imettämättä FANAPT-hoidon aikana.
Tiedot Radioaktiivisuuden siirtymistä imettävien rottien maitoon tutkittiin seuraamalla kerta-annosta [14C] iloperidonia annoksella 5 mg / kg. Maidon radioaktiivisuuskonsentraatio 4 tunnissa annoksen antamisen jälkeen oli lähes kymmenen kertaa suurempi kuin plasmassa samanaikaisesti. Maidon radioaktiivisuuspitoisuudet olivat kuitenkin laskeneet 24 tunniksi annoksen antamisen jälkeen maitoon, joka oli hiukan alempi kuin plasma. Maidon aineenvaihduntaprofiili oli kvalitatiivisesti samanlainen kuin plasmassa.
Lasten käyttö Turvallisuutta ja tehokkuutta lapsilla ja murrosikäisillä potilailla ei ole osoitettu.
Geriatrinen käyttö
FANAPT: n kliiniset tutkimukset skitsofrenian hoidossa eivät sisältäneet riittävää määrää yli 65-vuotiaat potilaat selvittääkseen, vastaavatko he eri tavalla kuin nuoremmat aikuiset potilaita. 325 potilaasta, joita hoidettiin FANAPT-valmisteella markkinoille saattamista edeltävissä tutkimuksissa, 25 (0,5%) oli ≥65-vuotiaita eikä ≥75-vuotiaita potilaita.
Iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan FANAPT: llä, on suurempi kuoleman riski verrattuna lumelääkkeeseen. FANAPT-valmistetta ei ole hyväksytty dementiaan liittyvän psykoosin hoitoon.
Munuaisten vajaatoiminta
Koska FANAPT metaboloituu voimakkaasti ja alle 1% lääkkeestä erittyy muuttumattomana, pelkästään munuaisten vajaatoiminnalla ei todennäköisesti ole merkittävää vaikutusta FANAPTin farmakokinetiikkaan. Munuaisten vajaatoiminnalla (kreatiniinipuhdistuma <30 ml / min) oli minimaalinen vaikutus iloperidonin (annettuna 3 mg: n kerta-annoksena) ja sen metaboliittien P88 ja P95 Cmax-arvoon millä tahansa mitatusta 3analyytistä. AUC0– ∞ kasvoi 24%, laski 6% ja nousi 52% iloperidonilla, P88 ja P95, vastaavasti potilailla, joilla oli munuaisten vajaatoiminta.
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa FANAPT-valmisteeseen potilailla, joilla on lievä maksan vajaatoiminta. Potilaat, joilla on kohtalainen maksan vajaatoiminta, voivat vaatia annoksen pienentämistä. FANAPT-valmistetta ei suositella potilaille, joilla on vaikea maksan vajaatoiminta.
Aikuisilla, joilla oli lievä maksan vajaatoiminta, iloperidonin, P88: n tai P95: n (kokonaismäärä tai sitoutumaton) farmakokinetiikassa ei havaittu merkitsevää eroa terveisiin aikuisten kontrolleihin verrattuna. Potilailla, joilla oli kohtalainen maksan vajaatoiminta, aktiivinen metaboliitti P88 oli suurempi (2-kertainen) ja muuttuvampi havaittiin verrattuna terveisiin kontrolleihin, kun taas altistuminen iloperidonille ja P95: lle oli yleensä samanlainen (muutos alle 50% verrattuna kontrolli). Koska tutkimusta vaikeista maksan vajaatoiminnasta kärsivillä henkilöillä ei ole tehty, FANAPT-valmistetta ei suositella potilaille, joilla on vaikea maksan vajaatoiminta.
Tupakoinnin tila
Ihmisen maksaentsyymejä käyttävien in vitro -tutkimusten perusteella FANAPT ei ole CYP1A2: n substraatti; tupakoinnilla ei siksi pitäisi olla vaikutusta FANAPT-valmisteen farmakokinetiikkaan.
raskaus
ylin
Huumeiden väärinkäyttö ja riippuvuus
Hallittu aine
FANAPT ei ole valvottu aine.
Väärinkäyttö
FANAPTia ei ole systemaattisesti tutkittu eläimissä tai ihmisissä sen väärinkäytön, suvaitsevaisuuden tai fyysisen riippuvuuden suhteen. Vaikka kliinisissä tutkimuksissa ei havaittu taipumusta huumeiden etsimiseen, nämä havainnot eivät olleet systemaattisia, eikä se ole mahdollista ennustaa tämän kokemuksen perusteella, missä määrin keskushermostoon vaikuttavaa lääkettä, FANAPTia, käytetään väärin, väärinkäytetään ja / tai väärinkäytetään kerran markkinoidaan. Tämän seurauksena potilaita tulisi arvioida huolellisesti huumeiden väärinkäytön suhteen, ja tällaisten potilaiden tulisi olla tarkkaan havaittu FANAPT-väärinkäytön tai väärinkäytön oireiden varalta (esim. suvaitsevaisuuden kehitys, annoksen korottaminen, huumeiden etsiminen) käyttäytyminen).
ylin
yliannostus
Ihmisen kokemus
Markkinoille saattamista edeltävissä tutkimuksissa, joihin osallistui yli 3210 potilasta, FANAPT oli vahingossa tai tahallisesti yliannostus dokumentoitu kahdeksalla potilaalla, jotka vaihtelevat välillä 48 mg - 576 mg kerralla ja 292 mg kolmen päivän aikana aikana. Näistä tapauksista ei ilmoitettu kuolemantapauksia. Suurin vahvistettu FANAPT-valmisteen yksittäinen nauttiminen oli 576 mg; tälle potilaalle ei havaittu haitallisia fyysisiä vaikutuksia. Seuraavaksi suurin vahvistettu FANAPT-nielu oli 438 mg 4 vuorokauden aikana; ekstrapramidaalisia oireita ja QTc-intervalli 507 ms, ilmoitettiin tälle potilaalle, jolla ei ollut sydämen jälkiseurauksia. Tämä potilas jatkoi FANAPT-hoitoa vielä 11 kuukauden ajan.
Yleensä ilmoitetut oireet ja oireet olivat FANAPT-valmisteen tunnettujen farmakologisten vaikutusten (esim. Uneliaisuus ja sedaatio, takykardia ja hypotensio) liioittelusta johtuvia oireita ja oireita.
Yliannostuksen hallinta
FANAPT: lle ei ole erityistä vastalääkettä. Sen vuoksi olisi ryhdyttävä asianmukaisiin tukitoimenpiteisiin. Akuutin yliannostuksen yhteydessä lääkärin on luotava ja ylläpidettävä hengitysteitä ja varmistettava riittävä hapetus ja tuuletus. Mahalaukun huuhtelu (intubaation jälkeen, jos potilas on tajuton) ja aktiivihiilen antaminen yhdessä laksatiivin kanssa. Yliannostuksen seurauksena pään ja kaulan tukkeutumisen, kouristuskohtausten tai dystonisen reaktion mahdollisuus voi aiheuttaa aspiraatiovaaran aiheuttaman oksentelun aiheuttaman riskin. Sydän- ja verisuonitarkkailu tulisi aloittaa välittömästi, ja siihen tulisi sisältyä jatkuva EKG-seuranta mahdollisten rytmihäiriöiden havaitsemiseksi. Jos annetaan rytmihäiriöitä aiheuttavaa terapiaa, disopyramidia, prokainamidia ja kinidiiniä ei tule käyttää, koska niillä on QT-ajan pidentäviä vaikutuksia, jotka saattavat olla lisäaineita FANAPT-valmisteeseen. Samoin on kohtuullista olettaa, että bretyliumin alfa-salpaavat ominaisuudet saattavat olla additiivisia FANAPT: n ominaisuuksiin, johtaen ongelmaiseen hypotensioon. Hypotensio ja verenkierron romahtaminen on hoidettava sopivilla toimenpiteillä, kuten laskimonsisäisillä nesteillä tai sympatomimeettisillä aineilla. (epinefriiniä ja dopamiinia ei tule käyttää, koska beeta-stimulaatio voi pahentaa hypotensiota FANAPT-indusoidun alfa-arvon yhteydessä saarto). Antikolinergisiä lääkkeitä tulee antaa vakavissa ekstrapyramidaalioireissa. Tiivistä lääketieteellistä valvontaa tulisi jatkaa, kunnes potilas toipuu.
ylin
Kuvaus
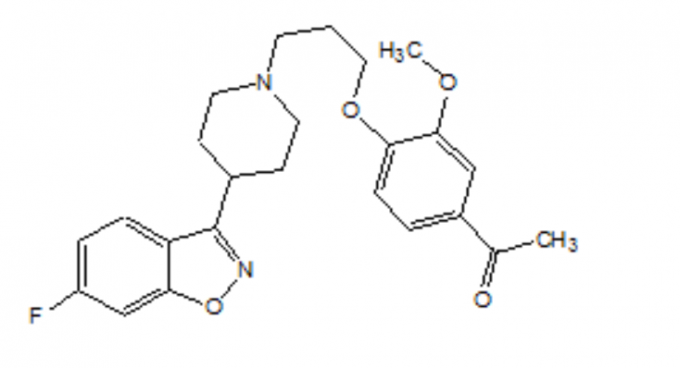
FANAPT on epätyypillinen antipsykootti, joka kuuluu piperidinyylibentsisoksatsolijohdannaisten kemialliseen luokkaan. Sen kemiallinen nimi on 4 '- [3- [4- (6-fluori-1,2-bentsisoksatsol-3-yyli) piperidino] propoksi] -3'-metoksiasetofenoni. Sen molekyylikaava on C24H27FN2O4 ja sen molekyylipaino on 426,48. Rakennekaava on:
Iloperidoni on valkoista tai luonnonvalkoista hienoksi kiteistä jauhetta. Se on käytännössä liukenematon veteen, liukenee hyvin vähän 0,1 N HCl: iin ja liukenee vapaasti kloroformiin, etanoliin, metanoliin ja asetonitriiliin.
FANAPT-tabletit on tarkoitettu käytettäväksi vain suun kautta. Jokainen kierros, päällystämätön
tabletti sisältää 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg tai 12 mg iloperidonia. Ei-aktiiviset aineosat ovat: laktoosimonohydraatti, mikrokiteinen selluloosa, hydroksipropyylimetyyliselluloosa, krospovidoni, magnesiumstearaatti, kolloidinen piitä
dioksidi ja puhdistettu vesi (poistetaan prosessin aikana). Tabletit ovat valkoisia, pyöreitä, litteitä, viistoreunaisia ja merkitty logolla ””, jonka toisella puolella on painatus ja tabletin lujuus ”1”, “2”, “4”, “6”, “8”, “10”, tai ”12”, toisella puolella kohokuvioitu.
ylin
Kliininen farmakologia
Toimintamekanismi
Iloperidonin vaikutusmekanismia skitsofreniassa ei tunneta. Iloperidonin tehokkuutta voidaan kuitenkin välittää yhdistelmällä dopamiinityypin 2 (D2) ja serotoniinityypin 2 (5-HT2) antagonismia.
Iloperidoni muodostaa aktiivisen metaboliitin, P88, jolla on in vitro -reseptoriin sitoutumisprofiili samanlainen kuin emälääkkeellä.
farmakodynamiikka
Iloperidoni toimii antagonistina, jolla on korkea (nM) affiniteetti sitoutuen serotoniini 5-HT2A dopamiini D2: een ja D3-reseptorit ja norepinefriini-NEa1-reseptorit (Ki-arvot 5,6, 6,3, 7,1 ja 0,36 nM, vastaavasti). Iloperidonilla on kohtalainen affiniteetti dopamiini D4- ja serotoniini 5-HT6- ja 5 -HT7-reseptoreihin (Ki-arvot 25, 43 ja 22, nM ) ja matala affiniteetti serotoniini 5-HT1A-, dopamiini D1- ja histamiini H1 -reseptoreihin (Ki-arvot 168, 216 ja 437 nM, vastaavasti). Iloperidonilla ei ole merkittävää affiniteettia (Ki> 1000 nM) kolinergisiin muskariinireseptoreihin. Iloperidonimetaboliitin P88 affiniteetti on yleensä yhtä suuri tai pienempi kuin emoyhdisteen, kun taas metaboliitin P95 vain osoittaa affiniteettia 5-HT2A: n (Ki-arvo 3,91) ja NEa1A-, NEa1B-, NEa1D- ja NEa2C-reseptorien suhteen (Ki-arvot 4,7, 2,7, 8,8 ja 4,7 nM vastaavasti).
farmakokinetiikkaa
Iloperidonin, P88: n ja P95: n havaitut keskimääräiset eliminaation puoliintumisajat CYP2D6: n laajoissa metaboloijissa (EM) ovat 18, 26 ja 23 tuntia, ja huonoissa metaboloijissa (PM) ovat vastaavasti 33, 37 ja 31 tuntia. Vakaan tilan pitoisuudet saavutetaan 3 - 4 päivän sisällä annostelusta. Iloperidonin kertyminen on ennustettavissa kerta-annoksen farmakokinetiikasta. Iloperidonin farmakokinetiikka on enemmän kuin annoksellista. Iloperidoni eliminoituu pääasiassa maksan metabolian kautta, johon osallistuu 2 P450-isotsyymiä, CYP2D6 ja CYP3A4.
Imeytyminen: Iloperidoni imeytyy hyvin tabletin antamisen jälkeen, huippupitoisuudet plasmassa tapahtuvat 2 - 4 tunnissa; kun taas tablettiformulaation suhteellinen hyötyosuus verrattuna oraaliliuokseen on 96%. Iloperidonin antaminen tavanomaisen rasva-aterian kanssa ei vaikuttanut merkittävästi Cmax-arvoon tai AUC-arvoon iloperidonia, P88 tai P95, mutta viivästyttivät Tmax-arvoa 1 tunnilla iloperidonilla, 2 tunnilla P88: lla ja 6 tunnilla P95. FANAPT voidaan antaa riippumatta aterioista.
Jakautuminen: Iloperidonin näennäinen puhdistuma (puhdistuma / hyötyosuus) on 47 - 102 l / h, näennäinen jakautumistilavuus on 1340 - 2800 l. Terapeuttisissa konsentraatioissa sitoutumattoman iloperidonin osuus plasmassa on ~ 3% ja jokaisesta metaboliitista (P88 ja P95) ~ 8%.
Metabolia ja eliminaatio: Iloperidoni metaboloituu pääasiassa kolmella biotransformaatioreitillä: karbonyylin pelkistys, hydroksylaatio (CYP2D6: n välittämä) ja O-demetylaatio (CYP3A4: n välittämä). Iloperidonimetaboliitteja on 2 hallitsevaa, P95 ja P88. Iloperidonimetaboliitti P95 edustaa 47,9% iloperidonin ja sen metaboliittien AUC: stä vakaassa tilassa laajoissa metaboloijissa (EM) ja 25% huonoissa metaboloijissa (PM). Aktiivisen metaboliitin P88 osuus on 19,5% ja 34,0% plasman kokonaisaltistuksesta EM: ssä ja PM: ssä.
Noin 7–10% valkoihoisista ja 3–8% mustista / afrikkalaisista amerikkalaisista puuttuu kyky metaboloida CYP2D6 substraatit ja luokitellaan heikoiksi metaboloijiksi (PM), kun taas loput ovat välituotteita, laajoja tai ultrarapidia metaboloivissa. FANAPT: n samanaikainen käyttö tunnettujen voimakkaiden CYP2D6-estäjien, kuten fluoksetiinin, kanssa johtaa 2,3-kertaiseen iloperidoniplasman altistumisen lisääntyminen, ja sen vuoksi puolet FANAPT-annoksesta tulisi olla annettuna.
Samoin CYP2D6: n PM-hiukkasilla on suurempi altistuminen iloperidonille verrattuna EM: iin ja PM: ien tulisi vähentää niiden annosta puoleen. Laboratoriotestit ovat saatavilla CYP2D6-hiukkasten tunnistamiseksi.
Suurin osa radioaktiivisista aineista otettiin talteen virtsaan (keskimäärin 58,2% ja 45,1% EM: ssä ja PM: ssä), jolloin ulosteiden osuus annostellusta radioaktiivisuudesta oli 19,9% (EM) - 22,1% (PM).
Kuljettajan vuorovaikutus: Iloperidoni ja P88 eivät ole P-gp: n substraatteja ja iloperidoni on heikko P-gp: n estäjä.
ylin
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi: Elinikäisiä karsinogeenisuustutkimuksia tehtiin CD-1-hiirillä ja Sprague Dawley -roottilla. Iloperidonia annettiin suun kautta annoksina 2,5, 5,0 ja 10 mg / kg / päivä CD-1-hiirille ja 4, 8 ja 16 mg / kg / päivä Sprague Dawley -rotat (vastaavasti 0,5, 1,0 ja 2,0 kertaa ja 1,6, 3,2 ja 6,5 kertaa, MRHD 24 mg / vrk, mg / m2 perusta). Pahanlaatuisten rintarauhaskasvaimien esiintyvyys lisääntyi naisilla hiirillä, joita hoidettiin vain pienimmällä annoksella (2,5 mg / kg / päivä). Rotilla tehdyissä kasvaimissa ei havaittu hoitoon liittyvää lisääntymistä.
Iloperidonimetaboliitin P95, joka on iloperidonin tärkein kiertävä metaboliitti ihmisissä, mutta jota ei esiinny merkittävissä määrin hiirissä tai rotilla, arvioitiin elinikäisessä karsinogeenisuustutkimuksessa Wistar-rotilla suun kautta annettavilla annoksilla 25, 75 ja 200 mg / kg / päivä miehillä ja 50, 150 ja 250 (vähennettynä 400: sta) mg / kg / päivä naaraita. Huumeisiin liittyviä neoplastisia muutoksia tapahtui miehillä, aivolisäkkeessä (pars distalis adenoma) kaikilla annoksilla ja haimassa (saarekesolujen adenooma) suurilla annoksilla. P95: n (AUC) plasmatasot miehillä testatuilla annoksilla (25, 75 ja 200 mg / kg / päivä) olivat vastaavasti noin 0,4, 3 ja 23 kertaa, kun ihminen altistui P95: lle iloperidonin MRHD: llä.
Mutageneesi: Iloperidoni oli negatiivinen Ames-testissä sekä hiiren in vivo -luuytimen ja rotan maksan mikrotumatesteissä. Iloperidoni aiheutti kromosomaalisia poikkeavuuksia kiinanhamsterin munasarjasoluissa (CHO) in vitro pitoisuuksissa, jotka myös aiheuttivat sytotoksisuutta.
Iloperidonimetaboliitti P95 oli negatiivinen Ames-testissä, V79-kromosomipoikkeavuustestissä ja hiiren in vivo -luuytimen mikrotumakokeessa.
Hedelmällisyyden heikkeneminen: Iloperidoni laski hedelmällisyyttä annoksilla 12 ja 36 mg / kg tutkimuksessa, jossa hoidettiin sekä uros- että naarasrottia. Vaikuttamaton annos oli 4 mg / kg, mikä on 1,6-kertainen MRHD: n ollessa 24 mg / päivä, mg / m2.
ylin
Kliiniset tutkimukset
FANAPT: n tehoa skitsofrenian hoidossa tuki 2 plasebo- ja aktiivisesti kontrolloidut lyhytaikaiset (4 ja 6 viikkoa) tutkimukset ja yksi pitkäaikainen lumelääkekontrolloitu satunnaistettu peruuttamiskoe. Kaikkiin tutkimuksiin osallistui potilaita, jotka täyttivät skitsofrenian DSM-III / IV-kriteerit.
Näissä tutkimuksissa käytettiin kolmea instrumenttia psykiatristen oireiden ja oireiden arviointiin. Positiivisen ja negatiivisen oireyhtymän asteikko (PANSS) ja lyhyt psykiatrinen arviointiasteikko (BPRS) ovat molemmat moniosaisia inventaarioita.
yleisen psykopatologian tutkimuksia, joita käytetään yleensä lääkkeiden hoidon vaikutusten arvioimiseksi skitsofreniassa. Kliinisen globaalin vaikutelman (CGI) arviointi heijastaa ammattitaitoisen tarkkailijan vaikutelmaa, joka on täysin perehtynyt skitsofrenian ilmenemismuotoihin, potilaan yleisestä kliinisestä tilasta.
6 viikon lumelääkekontrolloidussa tutkimuksessa (n = 706) käytettiin 2 joustavaa FANAPT-annosaluetta (12-16 mg / päivä tai 20-24 mg / päivä) verrattuna lumelääkkeeseen ja aktiiviseen kontrolliin (risperidoni). Ryhmässä 12-16 mg / päivä FANAPT: n titrausohjelma oli 1 mg kahdesti päivässä päivinä 1 ja 2, 2 mg kahdesti päivässä päivinä 3 ja 4, 4 mg kahdesti päivässä päivinä 5 ja 6 ja 6 mg kahdesti päivässä. päivittäin päivänä 7. Ryhmässä 20 - 24 mg / päivä FANAPT: n titrausohjelma oli 1 mg kahdesti päivässä päivänä 1, 2 mg kahdesti päivässä päivänä 2, 4 mg kahdesti päivässä päivänä 3, 6 mg kahdesti päivässä päivinä 4 ja 5, 8 mg kahdesti päivässä päivänä 6 ja 10 mg kahdesti päivässä päivänä 7. Ensisijainen päätetapahtuma oli muutos lähtötilanteeseen BPRS-kokonaispistemäärässä hoidon lopussa (päivä 42). Sekä 12 - 16 mg / päivä että 20 - 24 mg / päivä FANAPT: n annosalueet olivat parempia kuin lumelääke BPRS: n kokonaispistemäärässä. Aktiivinen vertailun vastainen antipsykoottinen lääke näytti olevan parempi kuin FANAPT tässä tutkimuksessa kahden ensimmäisen ajanjakson aikana viikkoa, havainto, joka voidaan osittain selittää nopeammalla titrauksella, joka oli siihen mahdollista huume. Tämän tutkimuksen potilailla, jotka olivat jatkaneet hoitoa vähintään 2 viikkoa, iloperidonilla näytti olevan olevan verrattavissa oleva tehokkuus aktiiviseen kontrolliin.
Neljän viikon, lumekontrolloidussa tutkimuksessa (n = 604) käytettiin yhtä kiinteää annosta FANAPT-valmistetta (24 mg / päivä) verrattuna lumelääkkeeseen ja aktiiviseen kontrolliin (ziprasidoni). Tämän tutkimuksen titrausohjelma oli samanlainen kuin 6 viikon tutkimuksen titrausohjelma. Tämä tutkimus sisälsi FANAPT-titrauksen aloittamalla 1 mg kahdesti päivässä päivänä 1 ja lisäämällä arvoon 2, 4, 6, 8, 10 ja 12 mg kahdesti päivässä päivinä 2, 3, 4, 5, 6 ja 7. Ensisijainen päätetapahtuma oli muutos lähtötasoon nähden PANSS-kokonaispistemäärässä hoidon lopussa (päivä 28). 24 mg / vrk FANAPT-annos oli parempi kuin lumelääke PANSS-kokonaispistemäärässä. FANAPTilla näytti olevan samanlainen tehokkuus kuin aktiivisella kontrollilääkkeellä, joka myös tarvitsi hitaan titrauksen tavoiteannokseen.
Pidemmän aikavälin tutkimuksessa kliinisesti vakaat aikuiset avohoitopotilaat (n = 303), jotka täyttivät skitsofrenian DSM-IV-kriteerit ja jotka pysyivät vakaina 12 viikon hoidon jälkeen avoin hoito joustavilla FANAPT-annoksilla (8 mg / päivä - 24 mg / päivä annettuna kahdesti vuorokaudessa) satunnaistettiin plaseboon tai jatkamaan heidän nykyisen FANAPT-annoksensa (8 mg / päivä - 24 mg / päivä annettuna kahdesti päivässä) tarkkailun mahdollisen uusiutumisen varalta kaksoissokkotutkimuksen aikana ehkäisyvaihe. Vakautumisen avoimen vaiheen aikana määriteltiin olevan vakiintuneella FANAPT-annoksella, joka ei muuttunut tehon vuoksi 4 viikossa ennen satunnaistamista, joiden CGI-vakavuusaste on ≤4 ja PANSS: n kokonaispistemäärä ≤70, pistemäärä ≤4 jokaisella seuraavalla yksittäisellä PANSS-kohteella (P1-harhavirheet, P2-käsitteellinen hajoaminen, P3-hallusinatiivinen käyttäytyminen, P6-epäluuloisuus / vaino, P7-vihamielisyys tai G8-yhteistyökyvyttömyys), eikä sairaalahoitoa tai hoitotason nousua hoidettavana pahenemisvaiheet. Relapsi tai lähestyvä relapsi kaksoissokkotonta uusiutumisen ehkäisyvaiheen aikana määriteltiin mille tahansa seuraava: sairaalahoito skitsofrenian pahenemisesta johtuen, PANSS-kokonaispistemäärän nousu (paheneminen) ≥30%, CGI-
Parannuspiste ≥6, potilaalla oli itsemurha-, murha- tai aggressiivista käyttäytymistä tai hänellä oli tarve muihin psykoosilääkkeisiin.

Väliaikaisen analyysin perusteella riippumaton tietojen seurantakomitea päätti tutkimuksen lopettaa varhaisessa vaiheessa tehokkuuden osoittamisen vuoksi. Väliaikaisen analyysin tulosten perusteella, jotka vahvistettiin lopullisessa analyysitiedotteessa, potilailla, joita hoidettiin FANAPTilla oli tilastollisesti merkitsevä pidempi aika uusiutumiseen tai lähestyvään uusiutumiseen kuin potilailla, jotka saivat plasebo. Kuvio 1 näyttää arvioidun kumulatiivisen osuuden potilaista, joilla on uusiutuminen tai lähestyvä uusiutuminen, lopullisen tietojoukon perusteella.
ylin
Kuinka toimitetaan / varastointi ja käsittely
FANAPT-tabletit ovat valkoisia, pyöreitä ja merkitty logolla, joiden toisella puolella on painatus, ja toisella puolella tabletin lujuus ”1”, “2”, “4”, “6”, “8”, “10” tai “12”. puolella. Tabletit toimitetaan seuraavilla vahvuuksilla ja pakkauskokoonpanoilla:
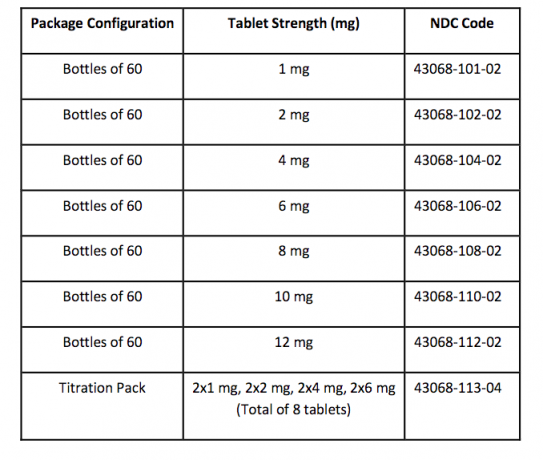
varastointi
Säilytä FANAPT-tabletteja valvotussa huoneenlämpötilassa, 25 ° C (77 ° F); retket sallittu 15 ° C - 30 ° C (59 ° - 86 ° F) [Katso USP: n kontrolloima huoneenlämpötila]. Suojaa FANAPT-tabletit valolta ja kosteudelta.
Potilaan neuvottelutiedot
Lääkäreitä kehotetaan keskustelemaan seuraavista aiheista potilaiden kanssa, joille he määräävät FANAPT: in:
QT-välin pidennys
Potilaita tulisi neuvoa ottamaan heti yhteys lääkäriin, jos he tuntevat heikotusta, menettävät tajuntansa tai sydämentykytys. Potilaita tulisi neuvoa olemaan ottamatta FANAPTia muiden lääkkeiden kanssa, jotka aiheuttavat QT-ajan pidentymistä. Potilaita tulisi kehottaa ilmoittamaan lääkärilleen, että he käyttävät FANAPTia ennen uuden lääkkeen ottamista.
Pahanlaatuinen neuroleptinen oireyhtymä
Potilaille ja heidän hoitajilleen on neuvottava, että joskus mahdollisesti kuolemaan johtava oirekompleksi viitataan kuten NMS, on raportoitu antipsykoottisten lääkkeiden, mukaan lukien FANAPT, antamisen yhteydessä. NMS: n oireita ovat hyperpyreksia, lihasjäykkyys, muuttunut henkinen tila ja todisteet autonomisesta
epävakaus (epäsäännöllinen pulssi tai verenpaine, takykardia, diaforeesi ja sydämen rytmihäiriöt).
Metaboliset muutokset
Potilaiden tulee olla tietoisia hyperglykemian (korkea verensokeri) ja diabetes mellituksen oireista. Potilaat, joilla on diagnosoitu diabetes, potilaat, joilla on diabeteksen riskitekijät, tai ne, joilla nämä kehittyvät hoidon aikana esiintyvien oireiden on seurattava verensokeriaan hoidon alussa ja määräajoin hoidon aikana hoitoa. Potilaille on neuvottava, että painonnousu on tapahtunut FANAPT-hoidon aikana. Painon kliinistä seurantaa suositellaan.
Ortostaattinen hypotensio
Potilaita tulee neuvoa ortostaattisen hypotension vaarasta, etenkin hoidon aloittamisen, hoidon aloittamisen tai annoksen suurentamisen yhteydessä.
Häiriöt kognitiiviseen ja motoriseen suorituskykyyn
Koska FANAPT voi heikentää harkintaa, ajattelua tai motorisia taitoja, potilaita tulee varoittaa käyttäessäsi vaarallisia koneita, mukaan lukien autot, kunnes he ovat kohtuullisen varmoja siitä, että FANAPT-hoito ei vaikuta niihin haitallisesti.
raskaus
Kerro potilaille, että Fanapt-valmisteen käyttö kolmannella kolmanneksella voi aiheuttaa ekstrapyramidaalisia ja / tai vieroitusoireita vastasyntyneellä. Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalle, jonka raskaus on tiedossa tai epäillään.
Raskausrekisteri
Kerro potilaille, että on olemassa raskauden altistumisrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet FANAPT-valmisteelle raskauden aikana
imetys
Suosittele, että naiset eivät imetä FANAPT-hoidon aikana.
Samanaikainen lääkitys
Potilaita tulisi neuvoa ilmoittamaan lääkärilleen, jos he käyttävät tai suunnittelevat ottavansa reseptejä tai ylimääräisiä lääkkeitä, koska yhteisvaikutukset ovat mahdollisia.
alkoholi
Potilaita tulisi neuvoa välttämään alkoholia FANAPT-hoidon aikana.
Lämpöaltistus ja kuivuminen
Potilaita tulee neuvoa asianmukaisesta hoidosta ylikuumenemisen ja kuivumisen välttämiseksi.
Jakaja:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 USA
Vanda ja Fanapt® ovat Vanda Pharmaceuticals Inc.:n rekisteröityjä tavaramerkkejä. Yhdysvalloissa ja muissa maissa.
takaisin alkuun
Fanapt (Iloperidone) reseptioppaat (PDF)
Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötarkoituksia, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysymyksiä käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta.
viimeksi päivitetty 13. heinäkuuta
takaisin: Psykiatristen lääkkeiden farmakologian kotisivu



