Namenda: Alzheimerin lääkitys
Namenda on lääke, jota käytetään Alzheimerin taudin hoidossa. Yksityiskohtaiset tiedot Namendan käytöstä, annostuksesta, sivuvaikutuksista.
Tuotemerkki: Namenda
Yleinen nimi: Memantiinihydrokloridi
Namenda (memantiinihydrokloridi) on lääkitys, jota käytetään Alzheimerin taudin hoidossa. Yksityiskohtaiset tiedot alla olevasta Namendan käytöstä, annostuksesta ja sivuvaikutuksista.
Sisällys:
Kuvaus
farmakologia
Käyttöaiheet ja käyttö
Vasta
varotoimet
Huumeiden yhteisvaikutukset
Haitalliset reaktiot
yliannos
annostus
toimitetaan
Potilasohjeet
Namendan potilastiedot (selkeästi englanniksi)
Kuvaus
Namenda® (memantiinihydrokloridi) on suun kautta aktiivinen NMDA-reseptoriantagonisti. Memantiinihydrokloridin kemiallinen nimi on 1-amino-3,5-dimetyyliadamantaanihydrokloridi, jolla on seuraava rakennekaava:
Lähde: Forest Laboratories, Yhdysvaltain jakelija tai Namenda.
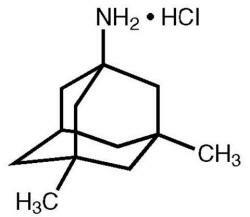
Molekyylikaava on C12H21N · HCl ja molekyylipaino on 215,76.
Memantine HCl esiintyy hienona valkoisena tai luonnonvalkoisena jauheena ja liukenee veteen. Namenda on saatavana tabletteina tai oraaliliuoksena. Namenda on saatavana suun kautta annettavaksi kapselinmuotoisina kalvopäällysteisinä tabletteina, jotka sisältävät 5 mg ja 10 mg memantiinihydrokloridia. Tabletit sisältävät myös seuraavat inaktiiviset aineosat: mikrokiteinen selluloosa, laktoosimonohydraatti, kolloidinen piidioksidi, talkki ja magnesiumstearaatti. Lisäksi seuraavat inaktiiviset aineosat ovat läsnä kalvopäällysteen komponenteina: hypromelloosi, triasetiini, titaanidioksidi, FD&C keltainen # 6 ja FD&C sininen # 2 (5 mg tablettia), musta rautaoksidi (10 mg tablettia). Namenda oraaliliuos sisältää memantiinihydrokloridia vahvuutena, joka vastaa 2 mg memantiinihydrokloridia millilitrassa. Oraaliliuos sisältää myös seuraavat inaktiiviset aineosat: sorbitoliliuos (70%), metyyliparabeeni, propyyliparabeeni, propeeniglykoli, glyseriini, luonnollinen piparminttuaromi # 104, sitruunahappo, natriumsitraatti ja puhdistettu vettä.
Kliininen farmakologia
Vaikutusmekanismi ja farmakodynamiikka
Keskushermoston N-metyyli-D-aspartaatti (NMDA) -reseptorien jatkuva aktivointi eksitatiivisen aminohapon glutamaatin on oletettu edistävän osaltaan oireyhtymän oireita Alzheimerin tauti. Memantiinin oletetaan antavan terapeuttisen vaikutuksensa vaikutuksena matalaan tai kohtalaiseen affiniteettiin ei-kilpailukykyinen (avoimen kanavan) NMDA-reseptoriantagonisti, joka sitoutuu ensisijaisesti NMDA-reseptoriohjattuun kationikanavat. Ei ole todisteita siitä, että memantiini estäisi tai hidastaisi neurodegeneraatiota potilailla, joilla on Alzheimerin tauti.
Memantiini osoitti alhaista tai vähäpätöistä affiniteettia GABA: n, bentsodiatsepiinin, dopamiinin, adrenergisten, histamiini- ja glysiinireseptoreiden ja jännitteestä riippuvien Ca 2+-, Na +- tai K + -kanavien suhteen. Memantiinilla oli myös antagonistisia vaikutuksia 5HT3-reseptorissa samankaltaisella vahvuudella kuin NMDA-reseptori ja estäneet nikotiiniset asetyylikoliinireseptorit, joilla on kuudesosa - kymmenesosa teho.
In vitro -tutkimukset ovat osoittaneet, että memantiini ei vaikuta asetyylikoliiniesteraasin palautuvaan estymiseen donepetsiilin, galantamiinin tai takriinin toimesta.
farmakokinetiikkaa
Memantiini imeytyy hyvin suun kautta antamisen jälkeen ja sillä on lineaarinen farmakokinetiikka terapeuttisella annosalueella. Se erittyy pääasiassa virtsaan, muuttumattomana, ja sen terminaalinen eliminaation puoliintumisaika on noin 60-80 tuntia.
Imeytyminen ja jakautuminen
Oraalisen annon jälkeen memantiini imeytyy voimakkaasti, huippupitoisuudet saavutetaan noin 3–7 tunnissa. Ruoalla ei ole vaikutusta memantiinin imeytymiseen. Memantiinin keskimääräinen jakautumistilavuus on 9 - 11 l / kg ja sitoutuminen plasman proteiineihin on heikko (45%).
Aineenvaihdunta ja eliminaatio
Memantiini metaboloituu osittain maksassa. Noin 48% annetusta lääkkeestä erittyy muuttumattomana virtsaan; loput muunnetaan ensisijaisesti kolmeksi polaariseksi metaboliitiksi, joilla on minimaalinen NMDA-reseptori antagonistinen aktiivisuus: N-glukuronidikonjugaatti, 6-hydroksimemantiini ja 1-nitroso-deaminoitu memantiinia. Yhteensä 74% annetusta annoksesta erittyy lähtölääkkeen ja N-glukuronidikonjugaatin summana. Maksan mikrosomaalisella CYP450-entsyymijärjestelmällä ei ole merkittävää merkitystä memantiinin metaboliassa. Memantiinin terminaalinen eliminaation puoliintumisaika on noin 60 - 80 tuntia. Munuaisten puhdistumiseen sisältyy aktiivinen tubulaarinen eritys, jota säätelee pH: sta riippuvainen tubulaarinen imeytyminen.
Erityisväestöt
Munuaisten vajaatoiminta: Memantiinin farmakokinetiikkaa arvioitiin sen jälkeen kun annettiin 20 mg memantiini-HCl: tä kerta-annoksena kerta-annoksella 8 potilaalla, joilla oli lievä munuaisten vajaatoiminta. (kreatiniinipuhdistuma, CLcr,> 50 - 80 ml / min), 8 henkilöä, joilla oli kohtalainen munuaisten vajaatoiminta (CLcr 30 - 49 ml / min), 7 henkilöä, joilla oli vaikea munuaisten vajaatoiminta (CLcr 5 - 29 ml / min) ja 8 tervettä henkilöä (CLcr> 80 ml / min) vastaavat ikää, painoa ja sukupuolta mahdollisimman tarkasti munuaisten vajaatoiminta. Keskimääräinen AUC 0- (ääretön) nousi 4%, 60% ja 115% henkilöillä, joilla oli lievä, kohtalainen ja vaikea munuaisten vajaatoiminta, verrattuna terveisiin henkilöihin. Terminaalisen eliminaation puoliintumisaika kasvoi 18%, 41% ja 95% henkilöillä, joilla oli lievä, kohtalainen ja vaikea munuaisten vajaatoiminta, verrattuna terveisiin henkilöihin.
Annoksen muuttamista ei suositella potilaille, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Annosta tulee pienentää potilailla, joilla on vaikea munuaisten vajaatoiminta (ks. ANNOSTUS JA ANTOTAPA).
vanhukset: Namendan farmakokinetiikka nuorilla ja iäkkäillä henkilöillä on samanlainen.
sukupuoli: Kun Namenda 20 mg b.i.d. -annosta annettiin useita kertoja, naisilla oli noin 45% suurempi altistus kuin miehillä, mutta altistumisessa ei ollut eroja, kun ruumiinpaino otettiin huomioon.
Huumeiden ja lääkkeiden yhteisvaikutukset
Mikrosomaalisten entsyymien substraatit: In vitro -tutkimukset osoittivat, että memantiini ei indusoi sytokromi P450 -entsyymien CYP1A2, CYP2C9, CYP2E1 ja CYP3A4 / 5 pitoisuuksissa, jotka ylittävät tehokkuuteen liittyvät pitoisuudet. Lisäksi in vitro -tutkimukset ovat osoittaneet, että memantiini estää minimaalisesti CYP450-entsyymejä CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 ja CYP3A4. Nämä tiedot osoittavat, että farmakokineettisiä yhteisvaikutuksia näiden entsyymien metaboloimien lääkkeiden kanssa ei odoteta.
Mikrosomaalisten entsyymien estäjät: Koska memantiini metaboloituu minimaalisesti ja suurin osa annoksesta erittyy muuttumattomana virtsaan, vuorovaikutus memantiinin ja CYP450-entsyymejä estävien lääkkeiden välillä on epätodennäköistä. Namendan samanaikainen käyttö AChE-estäjän donepetsiili-HCl: n kanssa ei vaikuta kummankaan yhdisteen farmakokinetiikkaan.
Lääkkeet, jotka on poistettu munuaisten kautta: Memantiini eliminoituu osittain putkimaisella erityksellä. In vivo -tutkimukset ovat osoittaneet, että diureettisen hydroklooritiatsidi / triamtereenin (HCTZ / TA) useat annokset eivät vaikuttaneet memantiinin AUC: iin tasapainotilassa. Memantiini ei vaikuttanut TA: n biologiseen hyötyosuuteen, ja laski HCTZ: n AUC: tä ja Cmax: ta noin 20%. Memantiinin samanaikainen käyttö antihyperglykeemisen lääkkeen Glucovance®: n (glyburidi ja metformiini-HCI) kanssa ei vaikuttanut memantiinin, metformiinin ja glyburidin farmakokinetiikkaan. Memantiini ei modifioinut Glucovance®: n seerumin glukoosipitoisuutta alentavia vaikutuksia, mikä viittaa farmakodynaamisen vuorovaikutuksen puutteeseen.
Huumeet, jotka tekevät virtsasta emäksisen: Memantiinin puhdistuma laski noin 80% emäksisissä virtsaolosuhteissa, pH 8. Siksi virtsan pH: n muutokset emäksiseen tilaan voivat johtaa lääkkeen kertymiseen ja mahdollisten haittavaikutusten lisääntymiseen. Virtsan alkalistavien lääkkeiden (esim. Hiilihappoanhydraasin estäjät, natriumbikarbonaatti) odotetaan vähentävän memantiinin poistumista munuaisten kautta.
Plasman proteiineihin vahvasti sitoutuneet lääkkeet: Koska memantiinin sitoutuminen plasmaproteiineihin on vähäistä (45%), vuorovaikutus sellaisten lääkkeiden kanssa, jotka sitoutuvat voimakkaasti plasmaproteiineihin, kuten varfariini ja digoksiini, on epätodennäköistä.
KLIINISET TUTKIMUKSET
Namendan (memantiinihydrokloridin) tehokkuus hoidossa potilaille, joilla on kohtalainen tai vaikea Alzheimerin tauti, osoitettiin kahdessa satunnaistetussa, Yhdysvalloissa tehdyt kaksoissokkotetut, lumekontrolloidut kliiniset tutkimukset (tutkimukset 1 ja 2), joissa arvioitiin sekä kognitiivinen että päivittäinen toiminta. Näihin kahteen tutkimukseen osallistuneiden potilaiden keskimääräinen ikä oli 76 ja vaihteluväli 50–93 vuotta. Noin 66% potilaista oli naisia ja 91% potilaista oli valkoihoisia.
Kolmas Latviassa suoritettu tutkimus (tutkimus 3) otti mukaan potilaita, joilla oli vaikea dementia, mutta ei arvioinut kognitiivista toimintaa suunnitelluna päätetapahtumana.
Tutkimuksen lopputulokset: Jokaisessa Yhdysvaltain tutkimuksessa Namendan tehokkuus määritettiin käyttämällä molempia välineitä suunniteltu arvioimaan kokonaistoimintaa hoitajaan liittyvän arvioinnin avulla ja mittaavan välineen avulla kognitio. Molemmat tutkimukset osoittivat, että Namenda-hoitoa saaneilla potilailla parani merkittävästi molemmissa toimenpiteissä lumelääkkeeseen verrattuna.
Päivittäistä toimintaa arvioitiin molemmissa tutkimuksissa käyttämällä modifioitua Alzheimerin taudin yhteistoimintatutkimusta - päivittäisen elämän inventaarion aktiivisuutta (ADCS-ADL). ADCS-ADL koostuu kattavasta paketista ADL-kysymyksiä, joita käytetään mittaamaan potilaiden toimintakykyä. Jokaiselle ADL-tuotteelle annetaan luokitus korkeimmasta riippumattoman suorituskyvyn tasosta menettämiseen asti. Tutkija suorittaa kartoituksen haastattelemalla potilaan käyttäytymiseen perehtynyttä hoitajaa. Joukko 19 tuotetta, mukaan lukien arviot potilaan kyvystä syödä, pukeutua, uida, puhelinta, matkustaa, tehdä ostoksia, ja suorittaa muita kotitöitä on validoitu potilaiden arvioimiseksi, joilla on kohtalainen tai vaikea dementia. Tämä on muokattu ADCS-ADL, jonka pisteytysalue on 0 - 54, ja alhaisemmat pisteet osoittavat suurempaa toimintahäiriötä.
Namendan kykyä parantaa kognitiivista suorituskykyä arvioitiin molemmissa tutkimuksissa vakavan vajaatoiminnan akulla (SIB), moniosainen instrumentti, joka on validoitu kognitiivisen toiminnan arviointiin potilailla, joilla on kohtalainen tai vaikea dementia. SIB tutkii kognitiivisen suorituskyvyn valittuja näkökohtia, mukaan lukien huomion, suuntautumisen, kielen, muistin, visospatiaalisen kyvyn, rakenteen, käytännön ja sosiaalisen vuorovaikutuksen elementit. SIB-pisteytysalue on 0 - 100, ja matalammat pisteet osoittavat suurempaa kognitiivista heikkenemistä.
Tutkimus 1 (kaksikymmentäkahdeksan viikon tutkimus)
28 viikon pituisessa tutkimuksessa 252 potilasta, joilla oli kohtalainen tai vaikea todennäköinen Alzheimerin tauti (diagnosoitu DSM-IV: llä ja NINCDS-ADRDA: lla) kriteerit, joissa mini-mielentilan tutkintotulokset> / = 3 ja! - = 14 ja globaalin heikentymisasteikon vaiheet 5-6) satunnaistettiin Namendaan tai plasebo. Namendaan satunnaistetuille potilaille hoito aloitettiin annoksella 5 mg kerran päivässä, ja sitä lisättiin viikoittain 5 mg / päivä jaettuna annoksiksi 20 mg / päivä (10 mg kahdesti päivässä).
Vaikutukset ADCS-ADL: ään
Kuvio 1 esittää aikataulun muutokselle lähtötasosta ADCS-ADL-pistemäärässä potilailla kahdessa hoitoryhmässä, jotka suorittivat tutkimuksen 28 viikkoa. 28 hoitoviikolla ADCS-ADL-muutospisteiden keskimääräinen ero Namendaa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin oli 3,4 yksikköä. Namenda-hoito oli tilastollisesti merkitsevästi parempi kuin lumelääke, kun käytettiin kaikkien potilaiden perustana olevaa analyysiä ja siirrettiin viimeistä tutkimushavaintoaan eteenpäin (LOCF-analyysi).
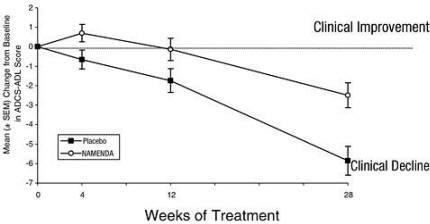
Kuvio 1: ADCS-ADL-pistemäärän muutoksen lähtötahti potilaille, jotka ovat suorittaneet hoidon 28 viikkoa.
Kuvio 2 esittää kumulatiivisia prosenttimääriä potilaita jokaisesta hoitoryhmästä, jotka olivat saavuttaneet ainakin muutoksen X-akselilla esitetyssä ADCS-ADL: ssä.
Käyrät osoittavat, että molemmilla Namendaan ja lumelääkkeeseen osoitetuilla potilailla on laaja vastealue ja yleensä heikkeneminen (a negatiivinen muutos ADCS-ADL: ssä verrattuna lähtötasoon), mutta että Namenda-ryhmässä on todennäköisemmin pienempi lasku tai parannus. (Kumulatiivisessa jakautumisnäytössä käyrä tehokasta käsittelyä varten siirretään käyrän vasemmalle puolelle lumelääke, kun taas tehoton tai vahingollinen hoito päällekkäin tai siirretään käyrän oikealle puolelle plasebo.)

Kuvio 2: Kumulatiivinen prosentuaalinen osuus potilaista, jotka ovat suorittaneet 28 viikon kaksoissokkotutkimuksen määritetyillä muutoksilla lähtötasosta ADCS-ADL-pisteet.
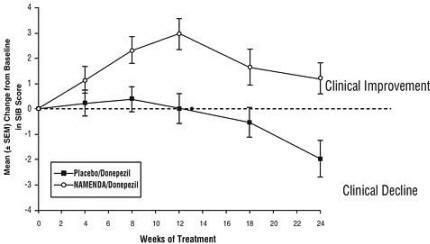
Vaikutukset SIB: hen: Kuvio 3 näyttää ajanjakson, jolloin muutos lähtötilanteesta tapahtui SIB-pisteissä kahdella hoitoryhmällä tutkimuksen 28 viikon ajan. 28 hoitoviikolla Namenda-hoitoa saaneiden potilaiden SIB-muutospisteiden keskimääräinen ero verrattuna lumelääkettä saaneisiin potilaisiin oli 5,7 yksikköä. Käyttämällä LOCF-analyysiä, Namenda-hoito oli tilastollisesti merkitsevästi parempi kuin lumelääke.
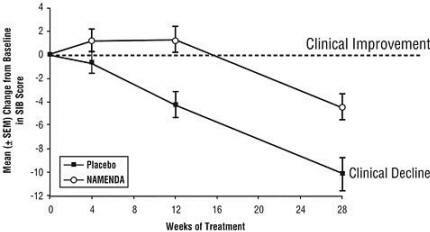
Kuvio 3: SIB-pisteet muutos lähtötasosta potilaille, jotka ovat suorittaneet 28 hoitoviikkoa.
Kuvio 4 näyttää kummankin hoitoryhmän potilaiden kumulatiiviset prosenttimäärät, jotka olivat saavuttaneet ainakin X-akselilla esitetyn SIB-pisteet-muutoksen mitan.
Käyrät osoittavat, että molemmilla Namendaan ja lumelääkkeeseen osoitetuilla potilailla on laaja vaste- ja osoittavat yleensä heikkenemistä, mutta että Namenda-ryhmä osoittaa todennäköisemmin pienemmän laskun tai parannus.
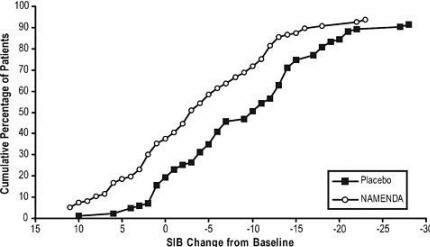
Kuvio 4: Kumulatiivinen prosentuaalinen osuus potilaista, jotka ovat suorittaneet 28 viikkoa kaksoissokkotutkimuksen spesifisillä muutoksilla lähtötasosta SIB-pisteet.
Tutkimus 2 (24 viikon tutkimus) 24 viikon pituisessa tutkimuksessa 404 potilasta, joilla oli kohtalainen tai vaikea todennäköinen Alzheimerin tauti (diagnosoitu NINCDS-ADRDA-kriteereillä, mini-mielentilan tutkimuksella) tulokset ≥ 5 ja ≤ 14) joita oli hoidettu donepetsiilillä vähintään 6 kuukautta ja jotka olivat saaneet vakaata annosta donepetsiili kolmen viimeksi kuluneen kuukauden aikana satunnaistettiin Namendaan tai plaseboon saaneen edelleen donepezil. Namendaan satunnaistetuille potilaille hoito aloitettiin annoksella 5 mg kerran päivässä, ja sitä lisättiin viikoittain 5 mg / päivä jaettuna annoksiksi annokseksi 20 mg / päivä (10 mg kahdesti päivässä).
Vaikutukset ADCS-ADL: iin: Kuvio 5 näyttää ajanjakson, jolloin ADCS-ADL-pisteet muuttuvat lähtötasosta kahdessa hoitoryhmässä tutkimuksen 24 viikon ajan. 24 hoitoviikolla ADCS-ADL-muutospisteiden keskimääräinen ero Namendan / donepetsiilin suhteen hoidetut potilaat (yhdistelmähoito) verrattuna potilaisiin, jotka saivat lumelääkettä / donepetsiiliä (monoterapia), oli 1,6 yksikköä. Käyttämällä LOCF-analyysiä, Namenda / donepetsiilihoito oli tilastollisesti merkitsevästi parempi kuin plasebo / donepetsiili.

Kuvio 5: ADCS-ADL-pistemäärän muutoksen lähtötaso potilaille, jotka ovat suorittaneet hoidon 24 viikkoa.
Kuvio 6 esittää kumulatiivisia prosenttimääriä potilaita jokaisesta hoitoryhmästä, jotka olivat saavuttaneet ainakin X-akselilla osoitetun ADCS-ADL: n paranemisen mitat.
Käyrät osoittavat, että molemmilla Namenda / donepetsiili- ja plasebo- / donepetsiilihoitoa saaneilla potilailla on laaja vaste- ja osoittavat yleensä heikkenemistä, mutta että Namenda / donepetsiiliryhmä osoittaa todennäköisemmin pienemmän laskun tai parannus.

Kuvio 6: Kumulatiivinen prosentuaalinen osuus potilaista, jotka ovat suorittaneet 24 viikon kaksoissokkohoidon määritetyillä muutoksilla lähtötasosta ADCS-ADL-pisteet.
Vaikutukset SIB: hen: Kuvio 7 näyttää ajanjakson, jolloin muutos lähtötilanteesta tapahtui SIB-pisteissä kahdella hoitoryhmällä tutkimuksen 24 viikon ajan. 24 hoitoviikolla Namenda / donepetsiilihoitoa saaneiden potilaiden SIB-muutospisteiden keskimääräinen ero verrattuna lumelääke / donepetsiilihoitoa saaneisiin potilaisiin oli 3,3 yksikköä. Käyttämällä LOCF-analyysiä, Namenda / donepetsiilihoito oli tilastollisesti merkitsevästi parempi kuin plasebo / donepetsiili.
Kuvio 7: SIB-pisteet muutos lähtötasosta potilaille, jotka ovat suorittaneet hoidon 24 viikkoa.
Kuvio 8 esittää kumulatiivisten prosentuaalisten prosenttimäärien potilaita jokaisesta hoitoryhmästä, jotka olivat saavuttaneet ainakin X-akselilla osoitetun SIB-pistemäärän parantumisen mitan.
Käyrät osoittavat, että molemmilla potilailla, joille on osoitettu Namenda / donepetsiili ja plasebo / donepetsiili, on laaja alue vastauksista, mutta että Namenda / donepetsiiliryhmä osoittaa todennäköisemmin parannusta tai pienempää laskuun.
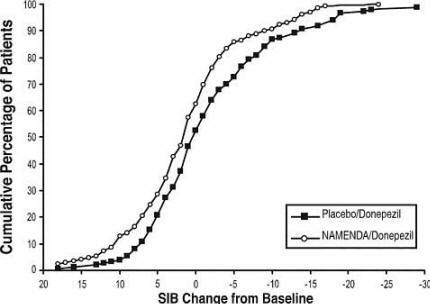
Kuvio 8: Kumulatiivinen prosentuaalinen osuus potilaista, jotka ovat suorittaneet 24 viikon kaksoissokkohoidon SIB-pisteiden spesifisillä muutoksilla lähtötasosta.
Tutkimus 3 (kaksitoista viikkoa kestävä tutkimus) 12 viikon pituisessa kaksoissokkotutkimuksessa, joka tehtiin Latvian hoitokodeissa, 166 dementiaa sairastavaa potilasta DSM-III-R: hen, mini-mielentilan tutkimuksen pisteytys <10 ja globaalin heikentymisasteikon asteikko 5 - 7 satunnaistettiin joko Namendaan tai Namendaan plasebo. Namendaan satunnaistetuille potilaille hoito aloitettiin 5 mg: lla kerran päivässä ja nostettiin 10 mg: aan kerran päivässä viikon kuluttua. Ensisijaiset tehon mitat olivat geriatristen potilaiden käyttäytymisasteikkoasteikon hoito-riippuvuussuhteen ala-asteikko (BGP), joka on päivittäisen toiminnan mittari, ja kliininen globaali muutoksen vaikutelma (CGI-C), kokonaisen kliinisen mitta vaikutus. Tässä tutkimuksessa ei käytetty kelvollista kognitiivisen toiminnan mittaa. Tilastollisesti merkitsevä hoitoero 12 vuorokaudessa, joka suosii Namendaa lumelääkkeeseen nähden, havaittiin molemmissa ensisijaisissa tehon mittareissa. Koska saapuneet potilaat olivat sekoitus Alzheimerin tautia ja verisuonidementiaa, yritettiin erottaa kaksi ryhmää ja kaikki Myöhemmin potilaille nimitettiin joko verisuoni-dementia tai Alzheimerin tauti tutkimuksen Hachinski-iskeemiasteikon pistemäärien perusteella merkintä. Vain noin 50 prosentilla potilaista oli aivojen tietokoneistettu tomografia. Alzheimerin tautia sairastavan alaryhmän kohdalla sekä BGP: ssä että CGI-C: ssä havaittiin tilastollisesti merkitsevä hoitovaikutus, joka suosii Namendaa plasebolla 12 viikon kohdalla.
Käyttöaiheet ja käyttö
Namenda (memantiinihydrokloridi) on tarkoitettu Alzheimerin tyypin keskivaikean tai vaikean dementian hoitoon.
Vasta
Namenda (memantiinihydrokloridi) on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä memantiinihydrokloridille tai valmisteen muille apuaineille.
varotoimet
Tietoja potilaille ja hoitajille: Hoitajia tulee neuvoa suositellussa antamisessa (kaksi kertaa päivässä yli 5 mg: n annoksille) ja annoksen suurentamiseksi (vähintään yhden viikon väliaika annoksen nostamisen välillä).
Neurologiset olosuhteet:
Namenda-valmistetta ei ole systemaattisesti arvioitu kouristushäiriöiden potilailla. Namendan kliinisissä tutkimuksissa kouristuskohtauksia esiintyi 0,2%: lla Namendalla hoidetuista potilaista ja 0,5%: lla plaseboa saaneista potilaista.
Uro-oireet
Oireet, jotka nostavat virtsan pH: ta, voivat vähentää memantiinin poistumista virtsaan, mikä johtaa memantiinin pitoisuuksien nousuun plasmassa.
Erityisväestöt
Maksan vajaatoiminta
Namendalla tapahtuu osittainen maksa-aineenvaihdunta, noin 48% annetusta annoksesta erittyy virtsaan muuttumattomana lääkkeenä tai lähtölääkkeen ja N-glukuronidikonjugaatin summana (74%). Memantiinin farmakokinetiikkaa maksan vajaatoiminnasta kärsivillä potilailla ei ole tutkittu, mutta sen odotetaan vaikuttavan vain vaatimattomasti.
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Annoksen pienentämistä suositellaan potilaille, joilla on vaikea munuaisten vajaatoiminta (ks KLIININEN FARMAKOLOGIA ja ANNOSTELU JA HALLINNOINTI ).
Huumeiden ja lääkkeiden yhteisvaikutukset
N-metyyli-D-aspartaatti (NMDA) antagonistit: Namendan yhdistettyä käyttöä muiden NMDA-antagonistien (amantadiini, ketamiini ja dekstrometorfaani) kanssa ei ole arvioitu systemaattisesti, ja tällaiseen käyttöön tulisi suhtautua varoen.
Namendan vaikutukset mikrosomaalisten entsyymien substraateihin: In vitro -tutkimukset, jotka tehtiin CYP450-entsyymien markkeerisubstraateilla (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4), osoittivat näiden entsyymien estävän minimaalisesti memantiini. Lisäksi in vitro -tutkimukset osoittavat, että memantiini ei indusoi tehokkuuteen liittyviä pitoisuuksia sytokromi P450 -entsyymien CYP1A2, CYP2C9, CYP2E1 ja CYP3A4 / 5 kanssa. Näiden entsyymien kautta metaboloituvien lääkkeiden kanssa ei odoteta olevan farmakokineettisiä yhteisvaikutuksia.
Mikrosomaalisten entsyymien estäjien ja / tai substraattien vaikutukset Namendaan: Memantiini eliminoituu pääasiassa munuaisten kautta, ja lääkkeiden, jotka ovat CYP450-järjestelmän substraatteja ja / tai estäjiä, ei odoteta muuttavan memantiinin metaboliaa.
Asetyylikoliiniesteraasin (AChE) estäjät: Namendan samanaikainen käyttö AChE-estäjän donepetsiili-HCl: n kanssa ei vaikuttanut kummankaan yhdisteen farmakokinetiikkaan. 24 viikon kontrolloidussa kliinisessä tutkimuksessa potilailla, joilla oli kohtalainen tai vaikea Alzheimerin tauti, haittavaikutukset memantiinin ja donepetsiilin yhdistelmällä havaittu tapahtumaprofiili oli samanlainen kuin pelkällä donepetsiililla.
Munuaisten mekanismien kautta eliminoidut lääkkeet: Koska memantiini eliminoituu osittain putkimaisella erityksellä, saman munuaisen kationista järjestelmää käyttävien lääkkeiden samanaikainen anto, mukaan lukien hydroklooritiatsidi (HCTZ), triamtereeni (TA), metformiini, simetidiini, ranitidiini, kinidiini ja nikotiini voivat johtaa muuttuneisiin plasmatasoihin molemmista tekijöistä. Namendan ja HCTZ / TA: n samanaikainen anto ei kuitenkaan vaikuttanut memantiinin tai TA: n biologiseen hyötyosuuteen, ja HCTZ: n hyötyosuus laski 20%. Lisäksi memantiinin samanaikainen antaminen antihyperglykeemisen lääkkeen Glucovance®: n (glyburidi ja metformiini-HCl) kanssa ei vaikuttanut memantiinin, metformiinin ja glyburidin farmakokinetiikkaan. Lisäksi memantiini ei muuttanut Glucovance®: n seerumin glukoosipitoisuutta alentavaa vaikutusta.
Huumeet, jotka tekevät virtsasta emäksisen: Memantiinin puhdistuma laski noin 80% emäksisissä virtsaolosuhteissa, pH 8. Siksi virtsan pH: n muutokset kohti emäksistä tilaa voivat johtaa lääkkeen kertymiseen ja mahdollisten haittavaikutusten lisääntymiseen. Virtsan pH: ta muuttaa ruokavalio, lääkkeet (esim. Hiilihappoanhydraasin estäjät, natriumbikarbonaatti) ja potilaan kliininen tila (esim. Munuaisputkihappoasidoosi tai vakavat virtsateiden infektiot). Siksi memantiiniä tulisi käyttää varoen näissä olosuhteissa.
Karsinogeneesi, mutageneesi ja hedelmällisyyden heikkeneminen
Karsinogeenisuudesta ei ollut näyttöä 113-viikkoisessa oraalisessa tutkimuksessa hiirillä annoksilla, jotka olivat korkeintaan 40 mg / kg / päivä (kymmenenkertainen ihmisen suositeltuun enimmäisannokseen [MRHD], mg / m 2). Karsinogeenisuudesta ei myöskään havaittu rotilla, joille annettiin suun kautta jopa 40 mg / kg / päivä 71 viikon ajan. mitä seurasi 20 mg / kg / päivä (20 ja 10 kertaa MRHD, vastaavasti mg / m 2) 128 viikon ajan.
Memantiini ei tuottanut todisteita genotoksisuudesta, kun sitä arvioitiin in vitro S. typhimurium tai E. colin käänteismutaatiomääritys, in vitro kromosomaalisen aberraation testi ihmisen lymfosyyteissä, in vivo sytogeneetinen määritys kromosomivaurioille rotilla ja in vivo hiiren mikrotumamääritys. Tulokset olivat epäselviä in vitro geenimutaatiomäärityksessä, jossa käytettiin kiinalaisen hamsterin V79-soluja.
Rotilla ei havaittu heikentyneen hedelmällisyyden tai lisääntymiskyvyn heikkenemistä, kun annettiin korkeintaan 18 mg / kg / päivä (9 kertaa MRHD mg / m 2) suun kautta 14 päivästä ennen parittelua raskauden ja imetyksen aikana naisilla tai 60 päivää ennen parittelua urokset.
raskaus
Raskausluokka B: Memantiini, joka oli annettu suun kautta raskaana oleville rotille ja kaniineille organogeneesin aikana, ei ollut teratogeeninen korkeimpiin testattuihin annoksiin saakka (18 mg / kg / vrk rotilla ja 30 mg / kg / vrk kaneilla, mikä on vastaavasti 9 ja 30 kertaa ihmisen suurin suositeltu annos [MRHD] mg / m 2 perusta).
Lievää äidille myrkyllisyyttä, pienentyneitä pentujen painoja ja lisääntynyttä haihtumattomien kohdunkaulan selkärangan esiintyvyyttä havaittiin suun kautta annettaessa annos 18 mg / kg / vrk tutkimuksessa, jossa rotille annettiin suun kautta annettavaa memantiiniä aloittaen ennen parittelua ja jatkaen synnytyksen jälkeen aikana. Lievä äitiysmyrkyllisyys ja pienentynyt pentujen paino havaittiin myös tällä annoksella tutkimuksessa, jossa rottia hoidettiin raskauden päivästä 15 synnytyksen jälkeen. Näiden vaikutusten vaikutukseton annos oli 6 mg / kg, mikä on 3-kertainen MRHD: n suhteen mg / m 2.
Memantiinista raskaana olevilla naisilla ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. Memantiiniä tulisi käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan vaaran.
Imettävät äidit
Ei tiedetä, erittyykö memantiini ihmisen rintamaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta annettaessa memantiinia imettävälle äidille.
Lasten käyttö
Memantiinin turvallisuudesta ja tehosta ei ole osoitettu riittäviä ja hyvin hallittuja tutkimuksia missään lasten sairaudessa.
Haitalliset reaktiot
Tässä jaksossa kuvatut kokemukset perustuvat tutkimuksiin potilailla, joilla on Alzheimerin tauti ja vaskulaarinen dementia.
Lopettamiseen johtavat haitalliset tapahtumat: Plasebokontrolloiduissa tutkimuksissa, joissa dementiapotilaat saivat Namendan annoksia korkeintaan 20 mg / päivä, haittavaikutusten vuoksi lopetuksen todennäköisyys oli sama Namenda-ryhmässä kuin lumelääkkeessä ryhmä. Mikään yksittäinen haittavaikutus ei liittynyt hoidon keskeyttämiseen vähintään 1 prosentilla Namenda-hoitoa saaneista potilaista ja lumelääkettä suuremmalla nopeudella.
Valvotuissa kokeissa ilmoitetut haittatapahtumat: Namendan (memantiinihydrokloridi) tutkimuksissa ilmoitetut haittatapahtumat heijastavat tarkkaan seurattuissa olosuhteissa saatuja kokemuksia erittäin valitussa potilaspopulaatiossa. Käytännössä tai muissa kliinisissä tutkimuksissa näitä esiintyvyysarvioita ei ehkä sovelleta, koska käyttöolosuhteet, raportointikäyttäytyminen ja hoidettavien potilaiden tyypit voivat olla erilaisia. Taulukossa 1 on lueteltu hoidossa esiintyviä oireita ja oireita, joita ilmoitettiin vähintään 2 prosentilla plasebokontrolloiduista potilaista dementiakokeet ja joiden esiintyvyys oli suurempi Namendalla hoidetuilla potilailla kuin niillä, joita hoidettiin plasebo. Haitallisia tapahtumia ei esiintynyt vähintään 5%: n esiintymistiheydellä ja kaksinkertaisesti lumelääketasolla.
Vartalojärjestelmä |
Plasebo (N = 922) % |
Namenda (N = 940) % |
Keho kokonaisuutena | ||
Väsymys |
1 | 2 |
Kipu |
1 | 3 |
Sydän ja verisuoni | ||
verenpainetauti |
2 | 4 |
Keski- ja perifeerinen hermosto | ||
Huimaus |
5 | 7 |
Päänsärky |
3 | 6 |
Ruoansulatuskanavan järjestelmä | ||
Ummetus |
3 | 5 |
oksentelu |
2 | 3 |
Tuki- ja liikuntaelimistö | ||
Selkäkipu |
2 | 3 |
Psykiatriset häiriöt | ||
sekaannus |
5 | 6 |
uneliaisuus |
2 | 3 |
Hallusinaatio |
2 | 3 |
Hengityselimet | ||
Yskiminen |
3 | 4 |
hengenahdistus |
1 | 2 |
Muita haitallisia tapahtumia, joita esiintyi vähintään 2% Namenda-hoitoa saaneilla potilailla, mutta suuremmalla tai yhtä suurella prosentilla lumelääkkeellä, olivat levottomuus, pudotus, aiheutunut vamma, virtsainkontinenssi, ripuli, keuhkoputkentulehdus, unettomuus, virtsateiden infektiot, influenssan kaltaiset oireet, epänormaali kävely, masennus, ylempien hengitysteiden infektiot, ahdistus, ääreisödeema, pahoinvointi, ruokahaluttomuus ja nivelkipu.
Haittavaikutusten kokonaisprofiili ja yksittäisten haittavaikutusten esiintymisaste potilaiden alaryhmässä, joilla on kohtalainen tai vaikea Alzheimerin tauti eivät poikenneet edellä kuvatusta yleisen dementian profiilista ja esiintyvyysluvuista väestö.
Vital Sign muutokset: Namenda- ja lumeryhmiä verrattiin elintärkeiden merkintöjen (pulssi, systolinen verenpaine, diastolinen veri) keskimääräiseen muutokseen lähtötasosta (1) paine ja paino) ja (2) potilaiden esiintyvyys, jotka täyttävät kriteerit mahdollisesti kliinisesti merkittävistä muutoksista lähtötasoon nähden näissä muuttujia. Namendalla hoidetuilla potilailla ei ollut kliinisesti merkittäviä muutoksia elintärkeissä merkkeissä. Namendan ja lumelääkkeen selkärangan ja pysyvän elintoimintojen vertailu iäkkäillä normaaleilla koehenkilöillä osoitti, että Namenda-hoitoon ei liity ortostaattisia muutoksia.
Laboratorion muutokset: Namenda- ja plaseboryhmiä verrattiin suhteessa (1) keskimääräiseen muutokseen lähtötasosta erilaisissa seerumin kemiaissa, hematologiassa ja virtsa-analyysimuuttujat ja (2) potilaiden esiintyvyys, jotka täyttävät kriteerit mahdollisesti kliinisesti merkittävistä muutoksista lähtötasoon nähden näissä muuttujia. Nämä analyysit eivät paljastaneet mitään kliinisesti merkittäviä muutoksia Namenda-hoitoon liittyvissä laboratoriokokeiden parametreissa.
EKG-muutokset: Namenda- ja lumelääkeryhmiä verrattiin suhteessa (1) erilaisten EKG-parametrien keskimääräiseen muutokseen lähtötasosta ja (2) potilaiden esiintyvyys näissä potilaissa, jotka täyttävät kriteerit mahdollisesti kliinisesti merkittävistä muutoksista lähtötasoon nähden muuttujia. Nämä analyysit eivät paljastaneet mitään kliinisesti merkittäviä muutoksia EKG-parametreissa, jotka liittyivät Namenda-hoitoon.
Muut kliinisissä tutkimuksissa havaitut haittavaikutukset
Namendaa on annettu noin 1350 dementiapotilaalle, joista yli 1200 sai enimmäissuosituksen 20 mg / vrk. Potilaat saivat Namenda-hoitoa jopa 884 vuorokauden ajan, joista 862 potilasta sai vähintään 24 viikon hoidon ja 387 potilasta saivat vähintään 48 viikkoa hoitoa.
Hoitoon nousseet merkit ja oireet, joita esiintyi 8 kontrolloidun kliinisen tutkimuksen ja 4 avoimen tutkimuksen aikana kliiniset tutkijat kirjasivat tutkimukset haittavaikutuksiksi käyttämällä omaa terminologiaaan valinnassa. Jotta saataisiin kokonaisarvio niiden henkilöiden osuudesta, joilla on saman tyyppisiä tapahtumia, tapahtumat ryhmitettiin pienempään joukkoon WHO: n terminologiaa käyttäviä standardisoituja luokkia, ja tapahtumien esiintymistiheydet laskettiin kaikille opinnot.
Kaikki vähintään kahdessa potilaassa esiintyvät haittatapahtumat otetaan mukaan, lukuun ottamatta niitä, jotka on jo lueteltu taulukossa 1, myös WHO: n termeillä yleensä informatiivisia, vähäisiä oireita tai tapahtumia, jotka eivät todennäköisesti aiheuta lääkkeitä, esimerkiksi koska ne ovat yleisiä tutkimuksessa väestö. Tapahtumat luokitellaan kehon mukaan ja luetellaan käyttämällä seuraavia määritelmiä: usein esiintyvät haittavaikutukset - ne, joita esiintyy vähintään 1/100 potilaalla; harvinaiset haittavaikutukset - sellaiset, joita esiintyy 1/100–1/1000 potilaalla. Nämä haittavaikutukset eivät välttämättä liity Namenda-hoitoon, ja useimmissa tapauksissa niitä havaittiin samanlaisella esiintymisellä plasebohoitoa saaneilla potilailla kontrolloiduissa tutkimuksissa.
Keho kokonaisuutena: Usein: pyörtyminen. Harvinaiset: hypotermia, allerginen reaktio.
Sydän ja verisuoni: Usein: sydämen vajaatoiminta. Harvinaiset: angina pectoris, bradykardia, sydäninfarkti, tromboflebiitti, eteisvärinä, hypotensio, sydämenpysähdys, posturaalinen hypotensio, keuhkoembolia, keuhkoödeema.
Keski- ja perifeerinen hermosto: Usein: ohimenevä iskeeminen kohtaus, aivoverisuonitapaturma, huimaus, ataksia, hypokineesia. Harvinaiset: parestesia, kouristukset, ekstrapyramidaalihäiriöt, hypertonia, vapina, afaasia, hyestesia, epänormaali koordinaatio, hemiplegia, hyperkinesia, tahattomat lihasten supistukset, stupor, aivojen verenvuoto, neuralgia, ptoosi, neuropatia.
Ruoansulatuskanavan järjestelmä: Harvinainen: gastroenteriitti, divertikuliitti, maha-suolikanavan verenvuoto, melena, ruokatorven haavauma.
Hemi- ja imusairaudet: Usein: anemia. Harvinainen: leukopenia.
Aineenvaihdunta- ja ravitsemushäiriöt: Usein: lisääntynyt alkalinen e-fosfataasi, vähentynyt paino. Harvinaiset: kuivuminen, hyponatremia, pahentunut diabetes mellitus.
Psykiatriset häiriöt: Toistuva: aggressiivinen reaktio. Harvinaiset: harhaluulot, persoonallisuushäiriöt, emotionaalinen heikkous, hermostuneisuus, unihäiriöt, lisääntynyt libido, psykoosi, amnesia, apatia, paranoidinen reaktio, epänormaali ajattelu, epänormaali itku, ruokahalu lisääntynyt, paroniria, delirium, depersonalisaatio, neuroosi, itsemurha yrittää.
Hengityselimet: Usein: keuhkokuume. Harvinaiset: apnea, astma, hemoptysis.
Iho ja liitteet: Yleinen: ihottuma. Harvoin esiintyvät: ihon haavaumat, kutina, selluliitti, ihottuma, ihottuma, erytemaattinen ihottuma, hiustenlähtö, urtikaria.
Erityiset aistit: Yleinen: kaihi, sidekalvotulehdus. Harvinaiset: makula lutea rappeutuminen, heikentynyt näkökyky, heikentynyt kuulo, tinnitus, blefariitti, näön hämärtyminen, sarveiskalvon opasiteetti, glaukooma, sidekalvon verenvuoto, silmäkipu, verkkokalvon verenvuoto, kseroftalmia, diplopia, epänormaalit oireet, likinäköisyys, verkkokalvon irtoaminen.
Virtsajärjestelmä: Toistuva: usein virtsaaminen. Harvinaiset: dysuria, hematuria, virtsaretentio.
Namendan markkinoinnin jälkeen ilmoitetut tapahtumat, sekä Yhdysvalloissa että Yhdysvalloissa
Vaikka syy-yhteyttä memantiinihoitoon ei ole löydetty, seuraavien haittavaikutusten on ilmoitettu liittyvän ajallisesti memantiinihoitoon eikä niitä ole kuvattu muualla merkinnöissä: atrioventrikulaarinen tukkeuma, luunmurtuma, karpaalitunnelin oireyhtymä, aivoinfarkti, rintakipu, claudication, koliitti, dyskinesia, dysfagia, gastriitti, maha-ruokatorven refluksi, grand mal -kouristukset, kallonsisäinen verenvuoto, maksan vajaatoiminta, hyperlipidemia, hypoglykemia, ileus, impotenssi, pahoinvointi, pahanlaatuinen neuroleptinen oireyhtymä, akuutti haimatulehdus, aspiraatiokeuhkokuume, akuutti munuaisten vajaatoiminta, pidentynyt QT-aika, levottomuus, Stevens-Johnsonin oireyhtymä, äkillinen kuolema, supraventrikulaarinen takykardia, takykardia, tardiivi dyskinesia ja trombosytopenia.
ELÄINTEN MYRKYLLISYYS
Memantiinin aiheuttamat neuronaaliset leesiot (tyhjentyminen ja nekroosi) moninapaisissa ja pyramidaalisissa soluissa takaosan aivokuoren kerroksissa III ja IV cingulate ja retrosplenial neocortices rotilla, samanlaisia kuin mitä tiedetään tapahtuvan jyrsijöillä, joille annetaan muita NMDA-reseptoriantagonisteja. Vaurioita havaittiin yhden memantiiniannoksen jälkeen. Tutkimuksessa, jossa rotille annettiin päivittäisiä suun kautta annettavia memantiiniannoksia 14 päivän ajan, hermostokroosin vaikutukseton annos oli 6-kertainen suurimpaan suositeltuun ihmisannokseen mg / m 2. NMDA-reseptoriantagonistien aiheuttamaa keskushermostoimisen tyhjentymisen ja nekroosin indusointipotentiaalia ihmisillä ei tunneta.
Huumausaineiden väärinkäyttö ja riippuvuus
Valvottu aineluokka: Memantine HCl ei ole valvottu aine.
Fyysinen ja psykologinen riippuvuus: Memantiini-HCl on matalan tai kohtalaisen affiniteettia kilpailematon NMDA-antagonisti, joka ei tuottanut mitään todisteita lääkkeenhakusta käyttäytymis- tai vieroitusoireet lopettamisen jälkeen 2 504 potilaalla, jotka osallistuivat terapeuttisiin kliinisiin tutkimuksiin annoksia. Markkinoinnin jälkeiset tiedot, jotka on kerätty takautuvasti Yhdysvaltojen ulkopuolella, eivät ole antaneet näyttöä huumausaineiden väärinkäytöstä tai riippuvuudesta.
yliannos
Koska yliannostuksen hallintastrategiat kehittyvät jatkuvasti, on suositeltavaa ottaa yhteyttä myrkkyjen hallintakeskus määrittelemään viimeisimmät suositukset minkä tahansa yliannostuksen hallitsemiseksi huume.
Kuten kaikissa yliannostapauksissa, on käytettävä yleisiä tukitoimenpiteitä ja hoidon on oltava oireenmukaista. Memantiinin eliminaatiota voidaan parantaa virtsan happamoittamisella. Enintään 400 mg: n memantiiniannoksen dokumentoidussa tapauksessa potilaalla oli levottomuutta, psykoosia, visuaalisia hallusinaatioita, uneliaisuutta, hupia ja tajuttomuutta. Potilas toipui ilman pysyviä jälkiseurauksia.
Annostelu ja hallinnointi
Namendan (memantiinihydrokloridin) annos, jonka on osoitettu olevan tehokas kontrolloiduissa kliinisissä tutkimuksissa, on 20 mg / päivä.
Namendan suositeltu aloitusannos on 5 mg kerran päivässä. Suositeltava tavoiteannos on 20 mg / päivä. Annosta on nostettava 5 mg: n välein kerrallaan 10 mg / päivä (5 mg kahdesti päivässä), 15 mg / päivä (5 mg ja 10 mg erillisinä annoksina) ja 20 mg / päivä (10 mg kahdesti päivässä). Pienin suositeltu annoskorotusväli on yksi viikko.
Namenda voidaan ottaa ruuan kanssa tai ilman.
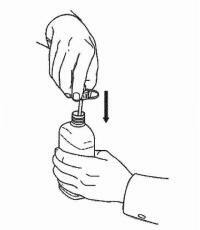
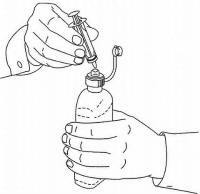
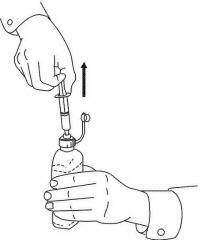
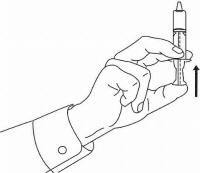
Potilaita / omaishoitajia on opastettava, miten Namenda Oral Solution -annostelulaitetta käytetään. Heille tulisi tiedottaa tuotteen mukana toimitetusta potilasohjeesta. Potilaita / hoitajia tulee neuvoa osoittamaan kaikki ratkaisun käyttöä koskevat kysymykset lääkärilleen tai apteekkihenkilökunnalle.
Annokset erityisryhmissä
Tavoiteannosta 5 mg kahdesti vuorokaudessa suositellaan potilaille, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma 5 - 29 ml / min perustuen Cockroft-Gault-yhtälöön):
Uroksille: CLcr = [140-ikä (vuotta)] · Paino (kg) / [72 · seerumin kreatiniini (mg / dl)]
Naisilla: CLcr = 0,85 · [140-ikä (vuotta)] · Paino (kg) / [72 · seerumin kreatiniini (mg / dl)]
Kuinka toimitetaan
5 mg tabletti:
Pullo 60 NDC # 0456-3205-60
10 - 10 yksikköannos NDC # 0456-3205-63
Kapselin muotoiset, kalvopäällysteiset tabletit ovat kellanruskeita, lujuudella (5) on toisella puolella kohokuviointi ja toisella puolella FL.
10 mg tabletti:
Pullo 60 NDC # 0456-3210-60
10 - 10 yksikköannos NDC # 0456-3210-63
Kapselin muotoiset, kalvopäällysteiset tabletit ovat harmaita, lujuudella (10) on toisella puolella kohokuviointi ja toisella puolella FL.
Titrauspakkaus:
PVC / alumiiniläpipainopakkaus, joka sisältää 49 tablettia. 28 - 5 mg ja 21 - 10 mg tabletit. NDC # 0456-3200-14
5 mg: n kapselin muotoiset, kalvopäällysteiset tabletit ovat kellanruskeita, lujuudella (5) on toisella puolella merkintä ja FL toisella. 10 mg: n kapselin muotoiset kalvopäällysteiset tabletit ovat harmaita, lujuudella (10) on toisella puolella kohokuvio ja toisella FL.
Suullinen ratkaisu:
Oraaliliuosten annossuositukset ovat samat kuin tabletteille. Oraaliliuos on kirkas, alkoholiton, sokeriton ja piparminttua maustettu.
2 mg / ml oraaliliuos (10 mg = 5 ml)
12 fl. oz. (360 ml) pullo NDC # 0456-3202-12
Varastoi 25 ° C: ssa (77 ° F); matkat sallitaan lämpötilaan 15-30 ° C (59-86 ° F) [katso USP: n kontrolloima huoneenlämpötila].
Forest Pharmaceuticals, Inc.
Forest Laboratories, Inc: n tytäryhtiö
St. Louis, MO 63045
Lisenssi Merz Pharmaceuticals GmbH: lta
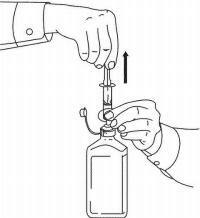
Potilaan ohjeet NAMENDA®-oraaliliuokselle
Noudata alla olevia ohjeita käyttääksesi Namenda® Oral Solution -annostelulaitetta.
TÄRKEÄÄ: Lue nämä ohjeet ennen Namenda®-oraaliliuoksen käyttöä.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
TÄRKEÄ: Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötapoja, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysymyksiä käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta. Viimeksi päivitetty 4.7.2007.
Lähde: Forest Laboratories, Namendan yhdysvaltalainen jakelija.
Namendan potilastiedot (selkeästi englanniksi)
takaisin: Psykiatristen lääkkeiden farmakologian kotisivu



