Glukofaga diabeteksen hoidossa
Tuotemerkki: Glucophage
Yleinen nimi: metformiinihydrokloridi
Annosmuoto: depottabletit
Sisällys:
Kuvaus
Kliininen farmakologia
Käyttöaiheet ja käyttö
Vasta
varoitukset
varotoimet
Lääkkeiden yhteisvaikutukset
Haitalliset reaktiot
yliannos
annostus
toimitetaan
Glukohage, metformiinihydrokloridi, potilastiedot (selkeästi englanniksi)
Kuvaus
Glucophage® (metformiinihydrokloridi) tabletit ja Glucophage® XR (metformiinihydrokloridi) pidennetyn vapautumisen tabletit ovat oraalisia verenpainelääkkeitä, joita käytetään tyypin 2 diabeteksen hoidossa. Metformiinihydrokloridi (N, N-dimetyyli-imidikarboni-imidi-diamidihydrokloridi) ei ole kemiallisesti tai farmakologisesti sukua muille oraalisten antihyperglykeemisten aineiden luokille. Rakennekaava on esitetty:
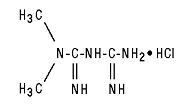
Metformiinihydrokloridi on valkoinen tai luonnonvalkoinen kiteinen yhdiste, jonka molekyylikaava on C4H11N5-HCl ja jonka molekyylipaino on 165,63. Metformiinihydrokloridi liukenee vapaasti veteen ja on käytännössä liukenematon asetoniin, eetteriin ja kloroformiin. Metformiinin pKa on 12,4. Metformiinihydrokloridin 1-prosenttisen vesiliuoksen pH on 6,68.
Glukofagetabletit sisältävät 500 mg, 850 mg tai 1000 mg metformiinihydrokloridia. Jokainen tabletti sisältää inaktiivisia aineosia povidonia ja magnesiumstearaattia. Lisäksi 500 mg: n ja 850 mg: n tablettien päällyste sisältää hypromelloosia ja 1000 mg: n tablettien päällyste sisältää hypromelloosia ja polyeteeniglykolia.
Glucophage XR sisältää 500 mg tai 750 mg metformiinihydrokloridia vaikuttavana aineena.
Glucophage XR 500 mg -tabletit sisältävät inaktiiviset aineosat natriumkarboksimetyyliselluloosa, hypromelloosi, mikrokiteinen selluloosa ja magnesiumstearaatti.
Glucophage XR 750 mg -tabletit sisältävät inaktiiviset aineosat natriumkarboksimetyyliselluloosa, hypromelloosi ja magnesiumstearaatti.
Järjestelmäkomponentit ja Performance-Glucophage XR käsittävät kaksoishydrofiilisen polymeerimatriisijärjestelmän. Metformiinihydrokloridi yhdistetään lääkkeen vapautumista säätelevän polymeerin kanssa "sisäisen" faasin muodostamiseksi, joka sitten sisällytetään erillisinä partikkeleina toisen polymeerin "ulkoiseen" faasiin. Antamisen jälkeen ruoansulatuskanavasta (GI) tuleva neste tulee tablettiin, aiheuttaen polymeerien hydraatin ja turvotuksen. Lääke vapautuu hitaasti annosmuodosta diffuusioprosessilla geelimatriisin läpi, joka on oleellisesti riippumaton pH: sta. Hydratoitu polymeerijärjestelmä ei ole jäykkä, ja sen odotetaan hajottavan normaalilla peristaltiikalla ruoansulatuskanavassa. Tabletin biologisesti inertit komponentit voivat toisinaan pysyä ehjinä GI-kuljetuksen aikana ja ne eliminoituvat ulosteessa pehmeänä, hydratoituneena massana.
ylin
Kliininen farmakologia
Toimintamekanismi
Metformiini on antihyperglykeeminen aine, joka parantaa glukoosinsietokykyä tyypin 2 diabeteksen potilailla, alentaen sekä perus- että ruoanjälkeistä plasman glukoositasoa. Sen farmakologiset vaikutusmekanismit eroavat muista oraalisten antihyperglykeemisten aineiden luokista. Metformiini vähentää maksan glukoosin tuotantoa, vähentää glukoosin imeytymistä suolistossa ja parantaa insuliiniherkkyyttä lisäämällä perifeerisen glukoosin imeytymistä ja käyttöä. Toisin kuin sulfonyyliureat, metformiini ei tuota hypoglykemiaa joko tyypin 2 diabeteksen potilailla tai normaaleilla koehenkilöillä (paitsi erityisissä olosuhteissa, ks. VAROTOIMET) eikä aiheuta hyperinsulinemiaa. Metformiinihoidolla insuliinin eritys pysyy muuttumattomana, kun taas paastoinsuliinitasot ja päivän kestävä plasmainsuliinivaste voivat todella laskea.
farmakokinetiikkaa
Imeytyminen ja hyötyosuus
Paasto-olosuhteissa annetun 500 mg: n Glucophage -tablettien absoluuttinen biologinen hyötyosuus on noin 50–60%. Tutkimukset, joissa käytettiin yksittäisiä suun kautta annettavia Glucophage 500 - 1500 mg ja 850 - 2550 mg, osoittavat, että annoksen suhteellisuus annosten kasvaessa, mikä johtuu vähentyneestä imeytymisestä eikä muutoksesta poistaminen. Ruoka vähentää metformiinin imeytymistä ja hidastaa sitä hieman, kuten osoittaa noin 40% pienempi keskimääräinen huippuplasma plasmassa konsentraatio (Cmax), 25% pienempi pinta plasmakonsentraatio aikakäyrän (AUC) alapuolella ja 35 minuutin pidentyminen huipulle plasmakonsentraatio (Tmax) annettuna yksi 850 mg: n metformiinitabletti ruoan kanssa, verrattuna saman tabletin voimakkuuteen annettu paasto. Näiden laskujen kliinistä merkitystä ei tunneta.
Yhden suun kautta otetun Glucophage XR -annoksen jälkeen Cmax saavutetaan keskimäärin 7 tunnin ja välillä 4 - 8 tuntia. Huippupitoisuudet plasmassa ovat noin 20% alhaisemmat kuin samaan Glucophage-annokseen, mutta imeytymisaste (mitattuna AUC: lla) on samanlainen kuin Glucophage.
Vakaassa tilassa AUC ja Cmax ovat vähemmän kuin annoksessa suhteelliset Glucophage XR: lle välillä 500 - 2000 mg, joka annetaan kerran päivässä. Huippupitoisuudet plasmassa ovat noin 0,6, 1,1, 1,4 ja 1,8 ug / ml vastaavasti 500, 1000, 1500 ja 2000 mg kerran vuorokaudessa. Metformiinin imeytymisaste (mitattuna AUC: lla) Glucophage XR: stä 2000 mg: n kerran päivässä -annoksella on samanlainen kuin sama päivittäinen kokonaisannos kuin Glucophage -tabletteilla, jotka ovat 1000 mg kahdesti päivässä. Toistuvan Glucophage XR -annostuksen jälkeen metformiini ei kertynyt plasmaan.
Glucophage XR: stä saatavan metformiinin Cmax- ja AUC-arvojen variaatiot potilaiden sisällä ovat verrattavissa Glucophagen kanssa.
Vaikka metformiinin imeytymisaste (mitattuna AUC: lla) Glucophage XR -tableteista lisääntynyt noin 50%, kun sitä annettiin ruuan kanssa, ruoalla ei ollut vaikutusta Cmax - ja Tmax - arvoihin metformiini. Sekä korkea- että matalarasvaisilla aterioilla oli sama vaikutus Glucophage XR: n farmakokinetiikkaan.
Jakelu
Metformiinin näennäinen jakautumistilavuus (V / F) 850 mg Glucophage-kerta-annoksen kerta-annoksen jälkeen oli keskimäärin 654 ± 358 l. Metformiini sitoutuu merkityksettömästi plasmaproteiineihin, toisin kuin sulfonyyliureat, jotka sitoutuvat proteiineihin yli 90%. Metformiini jakautuu punasoluiksi, todennäköisimmin ajan funktiona. Glucophagen tavanomaisilla kliinisillä annoksilla ja annosteluohjelmilla metformiinin vakaan tilan plasmapitoisuudet saavutetaan 24–48 tunnissa ja ovat yleensä
Aineenvaihdunta ja eliminaatio
Suonensisäiset kerta-annostutkimukset normaaleilla koehenkilöillä osoittavat, että metformiini erittyy muuttumattomana virtsassa, eikä se metaboloidu maksassa (metaboliitteja ei ole havaittu ihmisissä) eikä sappia erittyminen. Munuaisten puhdistuma (ks pöytä 1) on noin 3,5 kertaa suurempi kuin kreatiniinipuhdistuma, mikä osoittaa, että tubulaarinen eritys on tärkein metformiinin eliminaatioreitti. Oraalisen annon jälkeen noin 90% imeytyneestä lääkkeestä eliminoituu munuaisteiden kautta ensimmäisen 24 tunnin aikana, plasman eliminaation puoliintumisaika noin 6,2 tuntia. Veressä eliminaation puoliintumisaika on noin 17,6 tuntia, mikä viittaa siihen, että punasolujen massa voi olla jakautumisosasto.
Erityisväestöt
Potilaat, joilla on tyypin 2 diabetes
Kun normaalia munuaisten toimintaa esiintyy, metformiinin yhden tai useamman annoksen farmakokinetiikassa ei ole eroja tyypin 2 diabeteksen ja normaalien henkilöiden välillä (ks. pöytä 1), eikä metformiinia kumuloidu kummassakaan ryhmässä tavanomaisilla kliinisillä annoksilla.
Glucophage XR: n farmakokinetiikka on verrattavissa tyypin 2 diabetekseen potilailla, jotka ovat terveillä normaaleilla aikuisilla.
Munuaisten vajaatoiminta
Potilailla, joilla munuaisten toiminta on heikentynyt (mitatun kreatiniinipuhdistuman perusteella), puoliintumisaika plasmassa ja veressä metformiini pitkittyy ja munuaispuhdistuma pienenee suhteessa kreatiniinipuhdistuman vähenemiseen (ks pöytä 1; myös nähdä VAROITUKSET).
Maksan vajaatoiminta
Metformiinin farmakokineettisiä tutkimuksia ei ole tehty potilailla, joilla on maksan vajaatoiminta.
Geriatria
Rajoitetut tiedot kontrolloiduista glukofagin farmakokineettisistä tutkimuksista terveillä iäkkäillä henkilöillä viittaavat siihen, että kokonaisplasma metformiinin puhdistuma vähenee, puoliintumisaika pidentyy ja Cmax nousee terveisiin nuoriin verrattuna aiheista. Näiden tietojen perusteella näyttää siltä, että metformiinin farmakokinetiikan muutos ikääntymisen myötä johtuu pääasiassa munuaisten toiminnan muutoksesta (ks. pöytä 1). Glucophage (metformiinihydrokloridi) -tabletit ja Glucophage XR (metformiinihydrokloridi) depottablettien hoitoa ei tule aloitetaan 80-vuotiailla potilailla, paitsi jos kreatiniinipuhdistuman mittaus osoittaa, että munuaisten toiminta ei ole heikentynyt (katso VAROITUKSET ja ANNOSTELU JA HALLINNOINTI).
Taulukko 1: Valitse keskimääräiset (± S.D.) Metformiinin farmakokinetiikkaparametrit yhden tai useamman suun kautta annettavan glukofaagiannoksen jälkeen
| Aiheryhmät: Glukofagiannos (aiheiden lukumäärä) |
Cmaxb (µg / ml) |
TmaxC (H) |
Munuaisten puhdistuma (Ml / min) |
|---|---|---|---|
| Kaikki annokset paastoina lukuun ottamatta moniannoskokeiden ensimmäisiä 18 annosta | |||
| b Huippupitoisuus plasmassa | |||
| C Aika huippupitoisuuden saavuttamiseen plasmassa | |||
| d Viiden tutkimuksen yhdistetyt tulokset (keskiarvo): keskimääräinen ikä 32 vuotta (alue 23-59 vuotta) | |||
| e Kineettinen tutkimus, joka tehtiin annoksen 19 jälkeen paaston jälkeen | |||
| f Iäkkäät potilaat, keski-ikä 71 vuotta (vaihteluväli 65-81 vuotta) | |||
| g CLop = kreatiniinipuhdistuma normalisoituna kehon pinta-alaan 1,73 m2 | |||
| Terveet, diabeettiset aikuiset: | |||
| 500 mg kerta-annos (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg kerta-annos (74)d | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg kolme kertaa päivässä 19 annostae (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Aikuiset, joilla on tyypin 2 diabetes: | |||
| 850 mg kerta-annos (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg kolme kertaa päivässä 19 annostae (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| vanhuksetf, terveet ei-diabeettiset aikuiset: | |||
| 850 mg kerta-annos (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Munuaisten vajaatoiminta aikuiset: | |||
| 850 mg kerta-annos | |||
| Lievä (CLopg 61 - 90 ml / min) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Kohtalainen (CLop 31 - 60 ml / min) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Vakava (CLop 10-30 ml / min) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
lastentautioppi
Yhden suun kautta otetun 500 mg: n Glucophage -tablettien antamisen jälkeen ruoan kanssa metformiinin keskimääräinen geometrinen Cmax ja AUC poikkesivat alle 5% lasten tyypin 2 diabeetikot (12-16-vuotiaat) ja sukupuolen ja painon mukaiset terveet aikuiset (20-45-vuotiaat), joilla kaikilla on normaali munuainen toimia
sukupuoli
Metformiinin farmakokineettiset parametrit eivät eronneet merkitsevästi normaalien koehenkilöiden ja tyypin 2 diabetestä sairastavien välillä sukupuolen perusteella analysoituna (miehet = 19, naiset = 16). Samoin kontrolloiduissa kliinisissä tutkimuksissa tyypin 2 diabeteksen potilailla Glucophagen antihyperglykeeminen vaikutus oli vertailukelpoinen miehillä ja naisilla.
Rotu
Metformiinin farmakokineettisiä parametreja rodun perusteella ei ole tehty. Kontrolloiduissa kliinisissä glukofagin tutkimuksissa tyypin 2 diabeetikoilla potilailla antihyperglykeeminen vaikutus oli verrattavissa valkoisilla (n = 249), mustilla (n = 51) ja latinalaisamerikoilla (n = 24).
Kliiniset tutkimukset
Glucophage
Tuplasokeassa, lumekontrolloidussa, monikeskuksessa Yhdysvaltojen kliinisessä tutkimuksessa, johon osallistui lihavia potilaita, joilla oli tyypin 2 diabetes, joiden hyperglykemiaa ei hoidettu riittävästi pelkästään ruokavalion hallinnalla (plasman glukoosin [FPG] lähtötaso paastolla noin 240 mg / dL), hoito Glucophage-valmisteella (enintään 2550 mg / päivä) 29 viikon ajan, johti merkittävään paastonneen ja ruokavalion jälkeisen plasman glukoosin (PPG) ja hemoglobiinin A1c (HbA1c) keskimääräiset nettovähennykset olivat vastaavasti 59 mg / dL, 83 mg / dL ja 1,8% lumelääkeryhmään verrattuna (ks. Taulukko 2).
Taulukko 2: Glukofagi vs. plasebo Yhteenveto keskimääräisistä muutoksista lähtötasoon nähden * paastoamalla plasmaplasmaglukoosissa, HbA1c, ja kehon paino, viimeisessä vierailussa (29 viikon tutkimus)
| Glucophage (N = 141) |
Plasebo (N = 145) |
p-arvo | |
|---|---|---|---|
| * Kaikki potilaat, jotka saavat ruokavaliohoitoa lähtötilanteessa | ** Ei tilastollisesti merkitsevä | ||
| FPG (mg / dL) lähtötilanteessa Muutos lopullisessa vierailussa |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Hemoglobiini A1c (%) lähtötilanteessa Muutos lopullisessa vierailussa |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Paino (lbs) lähtötilanteessa Muutos lopullisessa vierailussa |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
29 viikon kaksoissokkoutettu, plasebokontrolloitu tutkimus glukofaagista ja glyburidista, yksinään ja yhdistelmänä, tehtiin liikalihavilla potilailla, joilla oli tyyppi 2 diabetes, joka ei onnistunut saavuttamaan riittävää glykeemistä kontrollia glyburidin enimmäisannoksilla (lähtötason FPG on noin 250 mg / dL) (ks. taulukko 3). Yhdistelmähoitoon satunnaistettuja potilaita aloitettiin hoito Glucophage 500 mg: lla ja 20 mg glyburidilla. Kokeen neljän ensimmäisen viikon jokaisen viikon lopussa näillä potilailla glukofaagiannos oli noussut 500 mg, jos he eivät olisi saavuttaneet tavoitetta paastonneen plasman glukoosiarvosta. Viikon 4 jälkeen tällaisia annostussäätöjä tehtiin kuukausittain, tosin yhdenkään potilaan ei sallittu ylittävän 2500 mg: n Glucophage-annosta. Vain glukofaagiryhmän potilaat (metformiini ja lumelääke) noudattivat samaa titrausohjelmaa. Kokeen lopussa noin 70% yhdistelmäryhmän potilaista käytti Glucophage 2000 mg / 20 mg glyburidia tai Glucophage 2500 mg / glyburide 20 mg. Potilaat, jotka satunnaistettiin jatkamaan glyburidin käyttöä, kokivat glykeemisen kontrollin heikkenemistä FPG: n, PPG: n ja HbA1c: n keskimääräisellä nousulla vastaavasti 14 mg / dl, 3 mg / dL ja 0,2%. Sitä vastoin glukofageihin satunnaistetuilla (korkeintaan 2500 mg / päivä) koettiin lievää paranemista FPG: n, PPG: n ja HbA1c: n keskimääräisellä laskulla vastaavasti 1 mg / dl, 6 mg / dl ja 0,4%. Glukofagin ja glyburidin yhdistelmä oli tehokas vähentämään FPG-, PPG- ja HbA1c-tasoja vastaavasti 63 mg / dl, 65 mg / dL ja 1,7%. Pelkästään glyburidikäsittelyn tuloksiin verrattuna, nettoerot yhdistelmähoidossa olivat -77 mg / dl, -68 mg / dL ja -1,9% (ks. Taulukko 3).
Taulukko 3: Yhdistetty glukofagi / Glyburide (Comb) vs Glyburide (Glyb) tai Glucophage (GLU) Monoterapia: Yhteenveto keskimääräisistä muutoksista lähtötasoon nähden * paastoamalla plasmaplasmaglukoosissa, HbA1c, ja kehon paino, viimeisessä vierailussa (29 viikon tutkimus)
| p-arvot | ||||||
|---|---|---|---|---|---|---|
| Kampa (N = 213) |
Glyb (N = 209) |
GLU (N = 210) |
Glyb vs Kampa |
GLU vs. Kampa |
GLU vs. Glyb |
|
| * Kaikki potilaat, jotka saivat glyburidia 20 mg / vrk lähtötasolla | ** Ei tilastollisesti merkitsevä | |||||
| Paasto-plasmaglukoosi (mg / dL) | ||||||
| lähtötilanteessa Muutos lopullisessa vierailussa |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Hemoglobiini A1c (%) | ||||||
| lähtötilanteessa Muutos lopullisessa vierailussa |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Paino (lbs) | ||||||
| lähtötilanteessa Muutos lopullisessa vierailussa |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
Paastoveren glukoosipitoisuuden laskun suuruus sen jälkeen, kun lääkitys on aloitettu Glukofagi (metformiinihydrokloridi) Tablettihoito oli verrannollinen paaston määrään hyperglykemia. Tyypin 2 diabeteksen potilailla, joilla paasto-glukoosikonsentraatio oli suurempi, plasman glukoosipitoisuuden ja glykosyloidun hemoglobiinin pitoisuudet laskivat enemmän.
Kliinisissä tutkimuksissa Glucophage laski yksinään tai yhdessä sulfonyyliurean kanssa keskimääräistä paastoseerumia triglyseridien, kokonaiskolesterolin ja LDL: n kolesterolitasot, eikä niillä ollut haitallisia vaikutuksia muihin lipiditasoihin (ks Taulukko 4).
Taulukko 4: Yhteenveto seerumin lipidimuuttujien keskimääräisestä prosentuaalisesta muutoksesta lähtötasoon viimeisessä vierailussa (29 viikon tutkimukset)
| Glukofagi vs. lumelääke | Yhdistetty glukofagi / glyburidi vs. monoterapia |
||||
|---|---|---|---|---|---|
| Glucophage (N = 141) |
Plasebo (N = 145) |
Glucophage (N = 210) |
Glucophage / glyburide (N = 213) |
glyburide (N = 209) |
|
| Kokonaiskolesteroli (mg / dL) | |||||
| lähtötilanteessa Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Triglyseridien kokonaismäärä (mg / dL) | |||||
| lähtötilanteessa Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-kolesteroli (mg / dL) | |||||
| lähtötilanteessa Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-kolesteroli (mg / dl) | |||||
| lähtötilanteessa Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
Päinvastoin kuin sulfonyyliureat, Glucophage-potilaiden ruumiinpaino pysyi vakaana tai jopa laski jonkin verran (ks. Taulukot 2 ja 3).
24 viikon, kaksoissokkotettu, plasebokontrolloitu tutkimus glukofagea plus insuliini vs. insuliini plus lumelääke oli Tyypin 2 diabeteksen potilailla, jotka eivät onnistuneet saavuttamaan riittävää glykeemistä kontrollia pelkästään insuliinin suhteen (ks Taulukko 5). Potilaat, jotka satunnaistettiin saamaan glukofagea plus insuliinia, saavuttivat HbA1c: n vähenemisen 2,10%, kun taas insuliinin ja lumelääkkeen saavuttama HbA1c: n vähennys oli 1,56%. Glykeemisen kontrollin paraneminen saavutettiin viimeisessä tutkimusvierailussa 16% vähemmän insuliinia, 93,0 U / vko vs. 110,6 U / vrk, Glukofage + insuliini vs. insuliini + lumelääke, vastaavasti, p = 0,04.
Taulukko 5: Yhdistetty glukofagi / insuliini vs. plasebo / insuliini Yhteenveto keskimääräisistä muutoksista lähtötasosta HbA: ssa1c ja päivittäinen insuliiniannos
| Glucophage / insuliini (N = 26) |
Plasebo/ insuliini (N = 28) |
hoito Ero Keskiarvo ± SE |
|
|---|---|---|---|
|
Tilastollisesti merkitsevä käyttämällä kovarianssianalyysiä perustasoon kovariaattina (p = 0,04) Ei merkitsevä varianssianalyysillä (arvot esitetään taulukossa) | |||
| b Tilastollisesti merkitsevä insuliinille (p = 0,04) | |||
| Hemoglobiini A1c (%) | |||
| lähtötilanteessa Muutos lopullisessa vierailussa |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43 |
| Insuliiniannos (U / päivä) | |||
| lähtötilanteessa Muutos lopullisessa vierailussa |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77b |
Toinen kaksoissokkoutettu, plasebokontrolloitu tutkimus (n = 51), jossa käytettiin 16 viikon satunnaistettua hoitoa, osoitti, että tyypin 2 diabeteksen potilailla, joilla kontrolloitiin insuliinia 8 viikon ajan keskimääräisen HbA1c: n ollessa 7,46 ± 0,97%, glukofagen lisäys ylläpitää samanlaista glykeemistä kontrollia (HbA1c 7,15 ± 0,61 vs. 6,97 ± 0,62 glukofagelle plus insuliini ja lumelääke plus) insuliini, vastaavasti) 19 prosentilla vähemmän insuliinia verrattuna lähtötilanteeseen (lasku 23,68 ± 30,22 verrattuna kasvuun 0,43 ± 25,20 yksikköä glukofaagilla plus insuliinilla ja plasebolla plus insuliinilla), p <0,01). Lisäksi tämä tutkimus osoitti, että Glukofagin ja insuliinin yhdistelmä johti vähenemiseen painon ollessa 3,11 ± 4,30 naulaa, kun taas lumelääke plus insuliini lisääntyivät 1,30 ± 6,08 naulaa, p = 0,01.
Glucophage XR
Glucophage XR: n 24 viikon kaksoissokkotettu, lumekontrolloitu tutkimus, joka otettiin kerran päivässä ilta-aterian yhteydessä, tehtiin tyypin 2 diabeteksen potilaat, jotka eivät onnistuneet saavuttamaan glykeemistä kontrollia ruokavalion ja liikunnan avulla (HbA1c 7,0% -10,0%, FPG 126-270 mg / dl). Tutkimukseen osallistuneilla potilailla HbA1c: n keskimääräinen lähtötilanne oli 8,0% ja FPG: n keskimääräinen lähtötaso oli 176 mg / dl. 12 viikon hoidon jälkeen keskimääräinen HbA1c oli kasvanut lähtötasosta 0,1% ja keskimääräinen FPG laskenut lähtötasosta 2 mg / dl lumelääkeryhmässä, verrattuna keskimääräisen HbA1c: n laskuun 0,6% ja keskimääräisen FPG: n laskuun 23 mg / dl potilailla, joita hoidettiin Glucophage XR 1000 mg: lla kerran päivittäin. Myöhemmin hoitoannos nostettiin 1500 mg: aan kerran päivässä, jos HbA1c oli <7,0%, mutta <8,0% (potilaat, joilla HbA1c â .0 .0 8,0%, keskeytettiin tutkimuksesta). Viimeisessä vierailussa (24 viikkoa) keskimääräinen HbA1c oli noussut 0,2% lähtötasosta plasebopotilailla ja laskenut 0,6% Glucophage XR: llä.
Glucophage XR: n 16 viikon kaksoissokkotettu, plasebokontrolloitu, annos-vaste -tutkimus kerran päivässä ilta-aterian yhteydessä tai kahdesti päivässä aterian yhteydessä, tehtiin tyypin 2 diabeetikoilla, joilla ei ollut onnistuttu saavuttamaan glykeemistä kontrollia ruokavalion ja liikunnan avulla (HbA1c 7,0% -11,0%, FPG 126-280 mg / dl). Muutokset glykeemisessä kontrollissa ja kehon painossa esitetään taulukossa 6.
Taulukko 6: Yhteenveto HbA: n keskimääräisistä muutoksista lähtötasoon nähden *1c, Plasmaglukoosin paasto ja kehon paino viimeisellä vierailulla (16 viikon tutkimus)
| Glucophage XR | Plasebo | |||||
|---|---|---|---|---|---|---|
| 500 mg Kerran Päivittäin |
1000 mg Kerran Päivittäin |
1500 mg Kerran Päivittäin |
2000 mg Kerran Päivittäin |
1000 mg Kahdesti Päivittäin |
||
| * Kaikki potilaat, jotka saavat ruokavaliohoitoa lähtötilanteessa | ||||||
| Kaikki vertailut plaseboon nähden | ||||||
| ** Ei tilastollisesti merkitsevä | ||||||
| Hemoglobiini A1c (%) | (N = 115) | (N = 115) | (N = 111) | (N = 125) | (N = 112) | (N = 111) |
| lähtötilanteessa | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Muutos lopullisessa vierailussa | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| p-arvo | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dL) | (N = 126) | (N = 118) | (N = 120) | (N = 132) | (N = 122) | (N = 113) |
| lähtötilanteessa | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Muutos lopullisessa vierailussa | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| p-arvo | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Paino (lbs) | (N = 125) | (N = 119) | (N = 117) | (N = 131) | (N = 119) | (N = 113) |
| lähtötilanteessa | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Muutos lopullisessa vierailussa | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| p-arvo | NS ** | NS ** | NS ** | NS ** | NS ** | - |
Lumelääkkeeseen verrattuna glykeemisen kontrollin paranemista havaittiin kaikilla Glucophage XR: n (metformiini) annostasoilla hydrokloridi) pidennetyn vapautumisen tabletteihin ja hoitoon ei liittynyt merkittäviä painon muutoksia (katso ANNOSTELU JA HALLINNOINTI annossuosituksia Glucophage ja Glucophage XR).
24-viikkoinen, kaksoissokkoutettu, satunnaistettu tutkimus Glucophage XR: stä, otettuna kerran päivässä ilta-aterian yhteydessä, ja Glucophage (metformiinihydrokloridi) -tableteista, otettuna kahdesti päivässä (yhdessä aamiainen ja ilta-ateria), suoritettiin potilaille, joilla oli tyypin 2 diabetes, joita oli hoidettu 500 mg: n Glukofagella kahdesti päivässä vähintään 8 viikkoa ennen tutkimukseen alkua. Glukofage-annosta ei välttämättä titrattu tietyn glykeemisen tason saavuttamiseksi ennen tutkimuksen aloittamista. Potilaat olivat päteviä tutkimukseen, jos HbA1c oli 8,5% ja FPG oli 200 mg / dl. Muutokset glykeemisessä kontrollissa ja kehon painossa esitetään taulukossa 7.
Taulukko 7: Yhteenveto HbA: n keskimääräisistä muutoksista lähtötasoon * verrattuna1c, Paasto plasmaglukoosia ja kehon painoa viikolla 12 ja viimeisellä vierailulla (24 viikon tutkimus)
| Glucophage 500 mg Kahdesti päivässä |
Glucophage XR | ||
|---|---|---|---|
| 1000 mg Kerran päivässä |
1500 mg Kerran päivässä |
||
| * Kaikki potilaat, jotka saivat Glucophage 500 mg kahdesti päivässä lähtötilanteessa | |||
| n = 68 | |||
| Hemoglobiini A1c (%) | (N = 67) | (N = 72) | (N = 66) |
| lähtötilanteessa | 7.06 | 6.99 | 7.02 |
| Vaihda 12 viikossa | 0.14 | 0.23 | 0.04 |
| (95% CI) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Muutos lopullisessa vierailussa | 0.14 | 0.27 | 0.13 |
| (95% CI) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dL) | (N = 69) | (N = 72) | (N = 70) |
| lähtötilanteessa | 127.2 | 131.0 | 131.4 |
| Vaihda 12 viikossa | 12.9 | 9.5 | 3.7 |
| (95% CI) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Muutos lopullisessa vierailussa | 14.0 | 11.5 | 7.6 |
| (95% CI) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Paino (lbs) | (N = 71) | (N = 74) | (N = 71) |
| lähtötilanteessa | 210.3 | 202.8 | 192.7 |
| Vaihda 12 viikossa | 0.4 | 0.9 | 0.7 |
| (95% CI) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Muutos lopullisessa vierailussa | 0.9 | 1.1 | 0.9 |
| (95% CI) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
12 viikon hoidon jälkeen keskimääräinen HbA-arvo nousi1c kaikissa ryhmissä; Glucophage XR 1000 mg -ryhmässä 0,23%: n nousu lähtötasosta oli tilastollisesti merkitsevä (ks ANNOSTELU JA HALLINNOINTI).
Lipidiparametrien muutokset aikaisemmin kuvatussa lumelääkekontrolloidussa Glucophage XR: n annos-vaste-tutkimuksessa esitetään taulukossa 8.
Taulukko 8: Yhteenveto suurimpien lipidimuuttujien keskimääräisistä prosentuaalisista muutoksista lähtötasoon nähden * viimeisessä vierailussa (16 viikon tutkimus)
| Glucophage XR | Plasebo | |||||
|---|---|---|---|---|---|---|
| 500 mg Kerran Päivittäin |
1000 mg Kerran Päivittäin |
1500 mg Kerran Päivittäin |
2000 mg Kerran Päivittäin |
1000 mg Kahdesti Päivittäin |
||
| * Kaikki potilaat, jotka saavat ruokavaliohoitoa lähtötilanteessa | ||||||
| Kokonaiskolesteroli (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| lähtötilanteessa | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Triglyseridien kokonaismäärä (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| lähtötilanteessa | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-kolesteroli (mg / dL) | (N = 119) | (N = 113) | (N = 109) | (N = 126) | (N = 117) | (N = 107) |
| lähtötilanteessa | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-kolesteroli (mg / dl) | (N = 120) | (N = 108) | (N = 108) | (N = 125) | (N = 117) | (N = 108) |
| lähtötilanteessa | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Lipidiparametrien muutokset aikaisemmin kuvatussa tutkimuksessa Glucophage ja Glucophage XR esitetään taulukossa 9.
Taulukko 9: Yhteenveto suurten lipidimuuttujien keskimääräisistä prosentuaalisista muutoksista lähtötasoon nähden * viimeisessä vierailussa (24 viikon tutkimus)
| Glucophage | Glucophage XR | ||
|---|---|---|---|
| 500 mg Kahdesti päivässä |
1000 mg Kerran päivässä |
1500 mg Kerran päivässä |
|
| * Kaikki potilaat, jotka saivat Glucophage 500 mg kahdesti päivässä lähtötilanteessa | |||
| Kokonaiskolesteroli (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| lähtötilanteessa | 199.0 | 201.9 | 201.6 |
| Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa | 0.1% | 1.3% | 0.1% |
| Triglyseridien kokonaismäärä (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| lähtötilanteessa | 178.0 | 169.2 | 206.8 |
| Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa | 6.3% | 25.3% | 33.4% |
| LDL-kolesteroli (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| lähtötilanteessa | 122.1 | 126.2 | 115.7 |
| Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa | −1.3% | −3.3% | −3.7% |
| HDL-kolesteroli (mg / dl) | (N = 68) | (N = 70) | (N = 65) |
| lähtötilanteessa | 41.9 | 41.7 | 44.6 |
| Keskimääräinen prosentuaalinen muutos lopullisessa vierailussa | 4.8% | 1.0% | -2.1% |
Lasten kliiniset tutkimukset
Tupla-sokeassa, lumekontrolloidussa tutkimuksessa 10-16-vuotiailla lapsipotilailla, joilla oli tyypin 2 diabetes (keskimääräinen FPG 182,2 mg / dl), hoito Glucophage-hoidolla (vuoteen 2000 asti) mg / päivä) jopa 16 viikon ajan (hoidon keskimääräinen kesto 11 viikkoa) johti FPG: n keskimääräiseen keskimääräiseen nettovähenemiseen 64,3 mg / dl plaseboon verrattuna (ks. taulukko 10).
Taulukko 10: Glukofagi vs. plasebo (lastenlääke) Yhteenveto plasman glukoosin ja kehon painon keskimääräisistä muutoksista lähtötasoon nähden * viimeisen vierailun aikana
| Glucophage | Plasebo | p-arvo | |
|---|---|---|---|
| Lasten potilaiden keski-ikä on 13,8 vuotta (vaihteluväli 10-16 vuotta) | |||
| * Kaikki potilaat, jotka saavat ruokavaliohoitoa lähtötilanteessa | |||
| ** Ei tilastollisesti merkitsevä | |||
| FPG (mg / dL) | (N = 37) | (N = 36) | |
| lähtötilanteessa Muutos lopullisessa vierailussa |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Paino (lbs) | (N = 39) | (N = 38) | |
| lähtötilanteessa Muutos lopullisessa vierailussa |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
ylin
Käyttöaiheet ja käyttö
Glukofagi (metformiinihydrokloridi) Tabletit on tarkoitettu lisäaineeksi ruokavalioon ja liikuntaan glykeemisen hoidon parantamiseksi aikuisilla ja tyypin 2 diabetes mellitusta sairastavilla lapsilla.
Glucophage XR (metformiinihydrokloridi) depottabletit on tarkoitettu lisäaineeksi ruokavalioon ja liikuntaan glykeemisen tason parantamiseksi aikuisilla, joilla on tyypin 2 diabetes mellitus.
ylin
Vasta
Glucophage ja Glucophage XR ovat vasta-aiheisia potilaille, joilla:
Munuaissairaus tai munuaisten toimintahäiriöt (esim. Seerumin kreatiniinitasojen â ‰ ¥ 1,5 mg / dl [miehet], â ‰ ¥ 1,4 mg / dl [naiset] tai epänormaalien ehdotusten perusteella kreatiniinipuhdistuma), joka voi johtua myös sellaisista tiloista, kuten sydän- ja verisuonten romahtaminen (sokki), akuutti sydäninfarkti ja septikemia (katso VAROITUKSET ja VAROTOIMET).
Tunnettu yliherkkyys metformiinihydrokloridille.
Akuutti tai krooninen metabolinen asidoosi, mukaan lukien diabeettinen ketoasidoosi, kooman kanssa tai ilman. Diabeettinen ketoasidoosi tulee hoitaa insuliinilla.
Glucophage ja Glucophage XR on lopetettava väliaikaisesti potilaille, joille tehdään radiologisia tutkimuksia, joihin sisältyy jodistettujen varjoaineiden suonensisäinen antaminen, koska tällaisten tuotteiden käyttö voi johtaa äkilliseen muutokseen munuaisten toiminta. (Katso myös VAROTOIMET.)
ylin
varoitukset
Maitohappoasidoosi:
Maitohappoasidoosi on harvinainen, mutta vakava aineenvaihduntakomplikaatio, joka voi ilmetä metformiinin kertymisen seurauksena Glucophage- tai Glucophage XR -hoidon aikana; kun se tapahtuu, se on tappava noin 50%: lla tapauksista. Maitohappoasidoosia voi esiintyä myös useiden patofysiologisten tilojen, mukaan lukien diabetes mellituksen, yhteydessä ja aina kun esiintyy merkittävää kudoksen hypoperfuusiaa ja hypoksemiaa. Maitohappoasidoosille on ominaista kohonnut veren laktaattitasot (> 5 mmol / l), vähentynyt veren pH, elektrolyyttihäiriöt, joissa on lisääntynyt anioniväli, ja lisääntynyt laktaatti / pyruvaattisuhde. Kun metformiini saatetaan maitohappoasidoosin syyksi, metformiinin tasot plasmassa ovat> 5 ug / ml.
Maitohappoasidoosin ilmoitettu esiintyvyys metformiinihydrokloridia saaneilla potilailla on hyvin pieni (noin 0,03 tapausta / 1000 potilasvuotta, noin 0,015 kuolemaan johtanutta tapausta / 1000) potilasvuotta). Kliinisissä tutkimuksissa metformiinille altistuneilla yli 20 000 potilasvuotta potilasvuonna ei ollut ilmoitettu maitohappoasidoosista. Raportoituja tapauksia on esiintynyt pääasiassa diabeetikoilla, joilla on merkittävä munuaisten vajaatoiminta, mukaan lukien molemmat luontaiset munuaiset tauti ja munuaisten hypoperfuusio, usein useiden samanaikaisten lääketieteellisten / kirurgisten ongelmien ja useiden samanaikaisten lääkitys. Potilaat, joilla on kongestiivinen sydämen vajaatoiminta ja jotka vaativat farmakologista hoitoa, erityisesti potilaat, joilla on epävakaa tai akuutti kongestiivinen sydämen vajaatoiminta, jolla on riski hypoperfuusioon ja hypoksemiaan, on lisääntynyt maitohappiriski havaitsemiseksi. Maitohappoasidoosin riski kasvaa munuaisten vajaatoiminnan asteen ja potilaan iän myötä. Tämän vuoksi maitohappoasidoosin riskiä voidaan vähentää merkittävästi seuraamalla munuaisten toimintaa säännöllisesti potilaat, jotka käyttävät Glucophage tai Glucophage XR: tä ja käyttävät pienintä tehokasta annosta Glucophage- tai Glucophage-valmistetta XR. Erityisesti vanhusten hoidon yhteydessä on seurattava huolellisesti munuaisten toimintaa. Glucophage- tai Glucophage XR -hoitoa ei tule aloittaa 80-vuotiailla potilailla, ellei mitattu kreatiniiniarvoa. puhdistuma osoittaa, että munuaisten toiminta ei ole heikentynyt, koska nämä potilaat ovat alttiimpia kehittämään maitoa havaitsemiseksi. Lisäksi Glucophage ja Glucophage XR on vältettävä viipymättä kaikissa tiloissa, jotka liittyvät hypokemiaan, nestehukkaan tai sepsiseen. Koska maksan vajaatoiminta voi merkittävästi rajoittaa kykyä puhdistaa laktaattia, glukofagea ja Glukofagea XR: tä tulisi yleensä välttää potilailla, joilla on kliinisiä tai laboratoriotutkimuksia maksasta sairaus. Potilaita tulee varoittaa alkoholin liiallisesta käytöstä, joko akuutista tai kroonisesta, ottamisen aikana Glucophage tai Glucophage XR, koska alkoholi tehostaa metformiinihydrokloridin vaikutuksia laktaattiin aineenvaihduntaa. Lisäksi Glucophage ja Glucophage XR on lopetettava väliaikaisesti ennen kaikkia intravaskulaarisia radiokontrastitutkimuksia ja kaikkia kirurgisia toimenpiteitä (ks. Myös VAROTOIMET).
Maitohappoasidoosin puhkeaminen on usein hienovaraista, ja siihen liittyy vain epäspesifisiä oireita, kuten pahoinvointi, myalgiat, hengitysvaikeudet, lisääntyvä uneliaisuus ja epäspesifinen vatsan vajaatoiminta. Siihen voi liittyä hypotermiaa, hypotensiota ja resistenttejä bradyarytmioita, joilla on selkeämpi asidoosi. Potilaan ja potilaan lääkärin on oltava tietoinen tällaisten oireiden mahdollisesta merkityksestä, ja potilasta on kehotettava ilmoittamaan asiasta välittömästi lääkärille, jos niitä ilmenee (ks. Myös VAROTOIMET). Glucophage ja Glucophage XR tulee vetää, kunnes tilanne selviää. Seerumin elektrolyytit, ketonit, verensokeri ja tarvittaessa veren pH, laktaattitasot ja jopa veren metformiinin tasot voivat olla hyödyllisiä. Kun potilas on vakiintunut jollakin Glucophage- tai Glucophage XR -annoksella, maha-suolikanavan oireet, jotka ovat yleisiä hoidon aloittamisen aikana, eivät todennäköisesti liity lääkkeisiin. Maha-suolikanavan oireiden esiintyminen myöhemmin voi johtua maitohappoasidoosista tai muusta vakavasta sairaudesta.
Paastoisissa laskimonsisäisten plasmalaktaattitasot normaalin ylärajan yläpuolella, mutta alle 5 mmol / l potilailla, jotka käyttävät Glukofagea tai Glucophage XR: ää, eivät välttämättä osoita lähestyvästä maitohappoasidoosista, ja se voi olla selitettävissä muilla mekanismeilla, kuten huonosti hoidettu diabetes tai liikalihavuus, voimakas fyysinen aktiivisuus tai näytteen tekniset ongelmat käsittely. (Katso myös VAROTOIMET.)
Maitohappoasidoosia tulisi epäillä kaikilla diabeetikoilla, joilla on metabolinen asidoosi, joilla ei ole näyttöä ketoasidoosista (ketonuria ja ketonemia).
Maitohappoasidoosi on sairaalahoito, jota on hoidettava sairaalassa. Maitohappoasidoosipotilaalla, joka käyttää Glucophage- tai Glucophage XR -hoitoa, lääkitys tulee lopettaa välittömästi ja aloittaa heti yleiset tukitoimenpiteet. Koska metformiinihydrokloridi on dialysoitavissa (puhdistuma jopa 170 ml / min hyvissä hemodynaamisissa olosuhteissa olosuhteet), nopeaa hemodialyysihoitoa suositellaan asidoosin korjaamiseksi ja kertyneen poistamiseksi metformiini. Tällainen hoito johtaa usein oireiden nopeaan kääntymiseen ja palautumiseen. (Katso myös VASTA ja VAROTOIMET.)
ylin
varotoimet
yleinen
Makrovaskulaariset tulokset - Kliinisissä tutkimuksissa ei ole saatu vakuuttavaa näyttöä makrovaskulaarisen riskin vähentämisestä Glucophage tai Glucophage XR: lla tai muulla diabeteksen vastaisella lääkkeellä.
Munuaisten toiminnan seuranta - Metformiinin tiedetään erittyvän olennaisesti munuaisten ja munuaisten kautta metformiinin kertymisen ja maitohappoasidoosin riski kasvaa munuaisten vajaatoiminnan asteen kanssa toimia. Siksi potilaat, joiden seerumin kreatiniinitasot ovat ikäänsä yli normaalin ylärajan, eivät saa saada Glucophage- tai Glucophage XR -tabletteja. Potilailla, joilla on pitkä ikä, Glucophage ja Glucophage XR on titrattava huolellisesti määrittämiseksi pienin annos riittävän glykeemisen vaikutuksen saavuttamiseksi, koska ikääntymiseen liittyy munuaisten vajaatoiminta toimia. Iäkkäillä potilailla, etenkin 80-vuotiailla, munuaisten toimintaa on seurattava säännöllisesti, ja yleensä Glucophage- ja Glucophage XR -tuotteita ei tulisi titrata suurimpaan annokseen (ks. VAROITUKSET ja ANNOSTELU JA HALLINNOINTI).
Munuaistoiminta on arvioitava ja varmistettava normaalina ennen Glucophage- tai Glucophage XR -hoidon aloittamista ja vähintään vuosittain sen jälkeen. Potilailla, joilla munuaisten toimintahäiriöiden odotetaan kehittyvän, munuaisten toiminta on arvioitava useammin ja Glucophage tai Glucophage XR lopetetaan, jos todiste munuaisten vajaatoiminnasta on esittää.
Samanaikaisten lääkkeiden käyttö, jotka voivat vaikuttaa munuaisten toimintaan tai metformiinin jakautumiseen - samanaikaiset lääkkeet, jotka voivat vaikuttaa munuaisten toimintaan tai johtaa munuaisten toimintaan huomattava hemodynaaminen muutos tai voi häiritä metformiinin, kuten kationisten lääkkeiden, poistumista munuaisten tubulaarisen erityksen kautta (ks. VAROTOIMET: Lääkkeiden yhteisvaikutukset), tulee käyttää varoen.
Radiologiset tutkimukset, joissa käytetään suonensisäisesti joditettuja varjoaineita (esimerkiksi laskimonsisäinen urogrammi, laskimonsisäinen kolangiografia, angiografia ja tietokonetomografia (CT) skannataan intravaskulaarisilla varjoaineilla) - intravaskulaariset kontrastitutkimukset joditetut materiaalit voivat johtaa akuuttiin munuaisten toiminnan muutokseen, ja niihin on liitetty maitohappoasidoosia saaneilla potilailla metformiini (ks VASTA). Siksi potilaille, joille tällainen tutkimus on suunnitteilla, Glucophage tai Glucophage XR tulee lopettaa väliaikaisesti tutkimusajankohtana tai ennen sitä. ja keskeytetään 48 tunnin ajan toimenpiteen jälkeen ja palautetaan vasta kun munuaisten toiminta on arvioitu uudelleen ja todettu normaali.
Hypoksiset tilat - sydän- ja verisuonten romahtaminen (sokki) mistä tahansa syystä, akuutti kongestiivinen sydämen vajaatoiminta, akuutti sydänlihaksen infarkti ja muut tilat, joille on ominaista hypoksemia, on liitetty maitohappoasidoosiin ja voivat myös aiheuttaa prerenal atsotemia. Kun tällaisia tapahtumia esiintyy Glucophage- tai Glucophage XR -hoitoa saavilla potilailla, lääkitys tulee lopettaa viipymättä.
Kirurgiset toimenpiteet - Glukofage- tai Glucophage XR -hoito tulee keskeyttää väliaikaisesti kaikille kirurgisille toimenpiteille (paitsi vähäiset toimenpiteet, joihin ei liity rajoitetun ruoan ja nesteiden saannin kanssa), eikä sitä tule aloittaa uudelleen, ennen kuin potilaan suun kautta otto on jatkanut ja munuaisten toiminta on arvioitu normaali.
Alkoholin saanti - Alkoholin tiedetään voimistavan metformiinin vaikutusta laktaattimetaboliaan. Siksi potilaita tulee varoittaa liiallisesta alkoholin käytöstä, akuutista tai kroonisesta, kun he saavat Glucophage- tai Glucophage XR -hoitoa.
Maksan vajaatoiminta - koska maksan vajaatoiminta on yhdistetty joihinkin maitohappoasidoositapauksiin, Glukofagea ja Glucophage XR: tä tulisi yleensä välttää potilailla, joilla on kliinisiä tai laboratoriokokeellisia todisteita maksasta sairaus.
B12-vitamiinitasot - 29 viikon kestävissä kontrolloiduissa kliinisissä tutkimuksissa glukofagin lasku normaalin alle aikaisemmin normaalit seerumin B12-vitamiinitasot, ilman kliinisiä oireita, havaittiin noin 7%: lla potilaita. Tällainen lasku, joka johtuu mahdollisesti häiriöistä B12-imeytymiseen B12-luontaisesta tekijäkompleksista, on kuitenkin hyvin liittyy harvoin anemiaan ja näyttää olevan palautuvaa nopeasti, kun lopetetaan Glucophage tai B12-vitamiini täydentämistä. Hematologisten parametrien mittaamista suositellaan vuosittain Glucophage- tai Glucophage XR -potilailla, ja kaikki ilmeiset poikkeavuudet tulisi tutkia ja hallita asianmukaisesti (ks. VAROTOIMET: Laboratoriotestit).
Tietyt henkilöt (henkilöt, joilla B12-vitamiinin tai kalsiumin saanti tai imeytyminen ovat riittämättömiä) näyttävät olevan alttiita kehittämään epätavallisia B12-vitamiinitasoja. Näille potilaille rutiiniset seerumin B12-vitamiinimittaukset 2 - 3 vuoden välein voivat olla hyödyllisiä.
Muutos kliinisessä tilassa potilailla, joilla on aikaisemmin hallittu tyypin 2 diabetes - potilas, jolla on tyypin 2 diabetes aikaisemmin hyvin hallinnassa Glucophage tai Glucophage XR kehittyy laboratoriopoikkeamia tai kliininen sairaus (etenkin epämääräinen ja huonosti määritelty sairaus) on arvioitava viipymättä ketoasidoosin tai maitohappojen varalta havaitsemiseksi. Arviointiin tulisi sisältyä seerumin elektrolyyttien ja ketonien, verensokerin ja tarvittaessa veren pH: n, laktaatin, pyruvaatin ja metformiinin tasot. Jos jommankumman muodon asidoosi tapahtuu, Glucophage tai Glucophage XR on lopetettava välittömästi ja aloitettava muut asianmukaiset korjaavat toimenpiteet (ks. Myös VAROITUKSET).
Hypoglykemia - Hypoglykemiaa ei esiinny potilailla, jotka saavat pelkästään Glucophage- tai Glucophage XR -tabletteja tavanomaisissa käyttöolosuhteissa, mutta se voi esiintyä, kun kalorien saanti on puutteellinen, kun rasittavaa liikuntaa ei kompensoida kaloripitoisuudella, tai samanaikaisen käytön aikana muiden glukoosipitoisuutta alentavien aineiden (kuten sulfonyyliureoiden ja insuliinin) kanssa tai etanolia.
Iäkkäät, heikentyneet tai aliravitut potilaat ja ne, joilla on lisämunuaisen tai aivolisäkkeen vajaatoiminta tai alkoholimyrkytys, ovat erityisen alttiita hypoglykemialle. Hypoglykemiaa voi olla vaikea tunnistaa vanhuksilla ja ihmisillä, jotka käyttävät beeta-adrenergisiä estäviä lääkkeitä.
Verensokerin hallinnan menetys - Jos potilaalla on stabiloitunut minkä tahansa diabeettisen hoidon yhteydessä, se altistuu stressille, kuten kuume, trauma, infektio tai leikkaus, glykeemisen kontrollin väliaikainen menetys voi tapahtua. Sellaisina aikoina voi olla tarpeen pidättää Glucophage tai Glucophage XR ja antaa väliaikaisesti insuliini. Glucophage tai Glucophage XR voidaan ottaa uudelleen käyttöön akuutin jakson ratkaisemisen jälkeen.
Suun kautta annettavien antidiabeettisten lääkkeiden tehokkuus alentaa verensokeria tavoitetasolle heikkenee monilla potilailla tietyn ajanjakson aikana. Tämä ilmiö, joka voi johtua perussairauden etenemisestä tai vähentyneestä reaktiosta lääkkeelle, on tunnetaan toissijaisena epäonnistumisena, erottamaan se primaarisesta vajaatoiminnasta, jossa lääke on tehoton alkuhoidon aikana. Jos sekundaarinen vajaatoiminta tapahtuu joko Glucophage- tai Glucophage XR- tai sulfonyyliurea-monoterapialla, yhdistelmähoito Glucophage tai Glucophage XR: n ja sulfonyyliurean kanssa voi johtaa vasteeseen. Jos toissijaista vajaatoimintaa tapahtuu yhdistetyssä glukofagi / sulfonyyliureahoidossa tai glukofagessa XR / sulfonyyliureahoito, voi olla tarpeen harkita terapeuttisia vaihtoehtoja, mukaan lukien hoidon aloittaminen insuliinihoito.
Tietoa potilaille
Potilaille on tiedotettava Glucophage- tai Glucophage XR -tablettien mahdollisista riskeistä ja hyödyistä sekä vaihtoehtoisista hoitomuodoista. Heille tulisi myös tiedottaa ruokavalio-ohjeiden noudattamisen ja säännöllisen liikunnan tärkeydestä Ohjelma ja säännöllinen verensokerin, glykosyloidun hemoglobiinin, munuaisten toiminnan ja hematologisen tutkimuksen parametreja.
Maitohappoasidoosin riskit, sen oireet ja olosuhteet, jotka altistavat sen kehitykselle, kuten VAROITUKSET ja VAROTOIMET kohdat, tulisi selittää potilaille. Potilaita tulisi neuvoa lopettamaan Glucophage tai Glucophage XR välittömästi ja ilmoittamaan heti terveydestään. lääkäri, jos selittämätöntä hyperventilaatiota, lihaskipu, pahoinvointi, epätavallinen uneliaisuus tai muut epäspesifiset oireet esiintyä. Kun potilaan vakautta on saavutettu millä tahansa Glucophage- tai Glucophage XR -annostustasolla, maha-suolikanavan oireet, jotka ovat yleisiä metformiinihoidon aloittamisen aikana, eivät todennäköisesti liity lääkkeisiin. Maha-suolikanavan oireiden esiintyminen myöhemmin voi johtua maitohappoasidoosista tai muusta vakavasta sairaudesta.
Potilaita tulee neuvoa liiallisesta alkoholin käytöstä, joko akuutista tai kroonisesta, samalla kun he saavat Glucophage- tai Glucophage XR -hoitoa.
Pelkästään glukofagi tai Glucophage XR ei yleensä aiheuta hypoglykemiaa, vaikkakin sitä voi esiintyä, kun Glukofagea tai Glucophage XR: tä käytetään yhdessä suun kautta otettavien sulfonyyliureoiden ja insuliinin kanssa. Yhdistelmähoitoa aloitettaessa hypoglykemian, sen oireiden ja hoidon riskit sekä Potilaille ja vastuussa olevalle perheelle on selitettävä tilanteet, joilla on taipumus sen kehittymiseen jäsenet.
Potilaille on ilmoitettava, että Glucophage XR on nieltävä kokonaisena eikä niitä saa murskata tai pureskella ja että passiiviset aineosat voidaan joskus eliminoida ulosteessa pehmeänä massana, joka voi muistuttaa alkuperäistä tabletti.
Laboratoriotestit
Kaikkien diabeteshoitojen vastetta tulisi seurata paastoveren säännöllisillä mittauksilla glukoosin ja glykosyloituneiden hemoglobiinitasojen tavoitteena laskea nämä tasot kohti normaalia alue. Alkuannoksen titrauksen aikana paastoglukoosia voidaan käyttää terapeuttisen vasteen määrittämiseen. Sen jälkeen sekä glukoosia että glykosyloitua hemoglobiinia on seurattava. Glykosyloidun hemoglobiinin mittaukset voivat olla erityisen hyödyllisiä arvioitaessa pitkäaikaista kontrollia (ks. Myös ANNOSTELU JA HALLINNOINTI).
Hematologisten parametrien (esim. Hemoglobiini / hematokriitti ja punainen veri) alustava ja säännöllinen seuranta soluindeksit) ja munuaisten toiminta (seerumin kreatiniini) olisi suoritettava vähintään vuosittain. Vaikka glukofagihoidolla on harvoin havaittu megaloblastanemiaa, B12-vitamiinin puutos tulisi sulkea pois, jos sitä epäillään.
Lääkkeiden yhteisvaikutukset (Glukofagin kanssa suoritettujen lääkkeiden yhteisvaikutusten kliininen arviointi)
Glyburidi - Yhden annoksen yhteisvaikutustutkimuksessa tyypin 2 diabetespotilailla samanaikainen anto metformiini ja glyburidi eivät aiheuttaneet muutoksia metformiinin farmakokinetiikassa tai farmakodynamiikka. Glyburidin AUC: n ja Cmax-arvon laskua havaittiin, mutta se oli hyvin vaihteleva. Tämän tutkimuksen yhden annoksen luonne ja korrelaation puuttuminen glyburidipitoisuuden veressä ja farmakodynaamisten vaikutusten välillä tekevät tämän vuorovaikutuksen kliinisen merkityksen epävarmaksi (ks. ANNOSTELU JA HALLINNOINTI: Samanaikainen glukofagi tai Glucophage XR ja suun kautta otettava sulfonyyliureahoito aikuisilla potilailla).
Furosemidi - Yhden annoksen metformiini-furosemidi -lääkkeiden yhteisvaikutustutkimus terveillä koehenkilöillä osoitti, että samanaikainen antaminen vaikutti molempien yhdisteiden farmakokineettisiin parametreihin. Furosemidi nosti metformiinin plasma- ja veren Cmax-arvoa 22% ja veren AUC-arvoa 15% ilman, että metformiinin munuaispuhdistuma muuttui merkittävästi. Metformiinin kanssa annettuna furosemidin Cmax ja AUC olivat vastaavasti 31% ja 12% pienemmät kuin silloin, kun yksinään annettuna, ja terminaalinen puoliintumisaika pieneni 32%, ilman merkittäviä muutoksia furosemidi-munuaisissa puhdistumaan. Tietoja metformiinin ja furosemidin yhteisvaikutuksesta ei ole saatavana kroonisen samanaikaisen annon yhteydessä.
Nifedipiini - Yhden annoksen metformiini-nifedipiini-lääkeaineiden yhteisvaikutustutkimus normaaleilla terveillä vapaaehtoisilla osoitti, että nifedipiinin samanaikainen anto nosti plasman metformiinin Cmax-arvoa vastaavasti 20% ja AUC-arvon 9% ja lisäsi erittyy virtsaan. Tmax ja puoliintumisaika eivät muuttuneet. Nifedipiini näyttää tehostavan metformiinin imeytymistä. Metformiinilla oli vähän vaikutuksia nifedipiiniin.
Kationiset lääkkeet - Kationiset lääkkeet (esim. Amiloridi, digoksiini, morfiini, prokainamidi, kinidiini, kiniini, ranitidiini, triamtereeni, trimetoprimi tai vankomysiini), jotka eliminoituu munuaistiehyiden kautta, teoriassa on mahdollisuus vuorovaikutukseen metformiinin kanssa kilpailemalla tavallisesta munuais tubulaarikuljetuksesta järjestelmiin. Tällaista metformiinin ja oraalisen simetidiinin välistä vuorovaikutusta on havaittu normaaleilla terveillä vapaaehtoisilla sekä metformiinisimetidiinin kerta- että moniannoksilla. lääkkeiden yhteisvaikutustutkimukset, joissa metformiinin huippupitoisuudet plasmassa ja kokoveressä nousivat 60% ja plasman ja kokoveren metformiini nousivat 40% AUC. Kerta-annostutkimuksessa eliminaation puoliintumisaika ei muuttunut. Metformiinilla ei ollut vaikutusta simetidiinin farmakokinetiikkaan. Vaikka tällaiset yhteisvaikutukset pysyvätkin teoreettisina (paitsi simetidiiniä), potilaan tarkka seuranta ja Glucophage tai Glucophage XR: n annoksen säätäminen ja / tai häiritsevää lääkettä suositellaan potilaille, jotka käyttävät kationisia lääkkeitä, jotka erittyvät munuaisputken proksimaalisen erityksen kautta järjestelmään.
Muu - joillakin lääkkeillä on taipumus aiheuttaa hyperglykemiaa ja ne voivat johtaa glykeemisen hallinnon menettämiseen. Näihin lääkkeisiin kuuluvat tiatsidit ja muut diureetit, kortikosteroidit, fenotiatsiinit, kilpirauhasen valmisteet, estrogeenit, suun kautta otettavat ehkäisyvalmisteet, fenytoiini, nikotiinihappo, sympatomimeetit, kalsiumkanavaa estävät lääkkeet ja isoniatsidi. Kun tällaisia lääkkeitä annetaan potilaalle, joka saa Glucophage tai Glucophage XR, potilasta on tarkkailtava tarkoin verensokerin hallinnan menettämisen varalta. Kun tällaiset lääkkeet otetaan pois potilaalta, joka saa Glucophage- tai Glucophage XR -hoitoa, potilasta on tarkkailtava tarkasti hypoglykemian varalta.
Terveillä vapaaehtoisilla metformiinin ja propranololin sekä metformiinin ja ibuprofeenin farmakokinetiikka ei vaikuttanut, kun niitä annettiin samanaikaisesti yhden annoksen yhteisvaikutustutkimuksissa.
Metformiini sitoutuu merkityksettömästi plasmaproteiineihin, minkä vuoksi se on vähemmän todennäköisesti vuorovaikutuksessa voimakkaasti proteiineihin sitoutuneiden lääkkeiden, kuten salisylaatit, sulfonamidit, kloramfenikoli ja probenesidi, verrattuna sulfonyyliureoihin, jotka sitoutuvat laajasti seerumiin proteiineja.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Pitkäaikaisia karsinogeenisuustutkimuksia on tehty rotilla (annostuksen kesto 104 viikkoa) ja hiirillä (annostuksen kesto 91 viikkoa) annoksina, jotka ovat enintään 900 mg / kg / päivä ja 1500 mg / kg / päivä, vastaavasti. Nämä annokset ovat molemmat noin 4 kertaa ihmisen enimmäissuositusannos, 2000 mg, kehon pinta-alavertailujen perusteella. Kummassakaan uros- tai naarashiiressä ei löytynyt näyttöä karsinogeenisuudesta metformiinin kanssa. Samoin metformiinin kanssa urosrottissa ei havaittu kasvaimen aiheuttamaa potentiaalia. Naisilla rotilla, joita hoidettiin annoksella 900 mg / kg, oli kuitenkin lisääntynyt hyvänlaatuisten strooman kohdun polyyppien esiintyvyys.
Seuraavissa in vitro -testeissä ei ollut näyttöä metformiinin mutageenisuudesta: Ames-testi (S. typhimurium), geenimutaatiotesti (hiiren lymfoomasolut) tai kromosomaalberraatioiden testi (ihmisen lymfosyytit). Tulokset in vivo hiiren mikrotumakokeessa olivat myös negatiivisia.
Metformiini ei vaikuttanut uros- tai naarasrottien hedelmällisyyteen, kun sitä annettiin jopa 600 annoksena mg / kg / päivä, joka on noin 3 kertaa ihmisen suositeltu enimmäispäiväannos kehon pinta-alan perusteella vertailuja.
raskaus
Teratogeeniset vaikutukset: raskausluokka B
Viimeaikaiset tiedot viittaavat vahvasti siihen, että raskauden aikana esiintyvät epänormaalit verensokeritasot liittyvät synnynnäisten poikkeavuuksien esiintymistiheyteen. Useimmat asiantuntijat suosittelevat insuliinin käyttöä raskauden aikana verensokerin pitämiseksi mahdollisimman lähellä normaalia. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, Glucophage- ja Glucophage XR -insuliinia ei tule käyttää raskauden aikana, ellei se ole selvästi tarpeen.
Glucophage- tai Glucophage XR -hoidolla olevista raskaana olevista naisista ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. Metformiini ei ollut teratogeeninen rotilla ja kaneilla annoksilla, jotka olivat korkeintaan 600 mg / kg / vrk. Tämä edustaa altistusta, joka on noin 2 ja 6-kertainen ihmisen suurimpaan suositeltuun päivittäiseen annokseen, joka on 2000 mg, perustuen vastaavasti kehon pinta-alavertailuihin rotilla ja kaneilla. Sikiöpitoisuuksien määrittäminen osoitti osittaisen istukan esteen metformiinille.
Imettävät äidit
Imettävien rottien tutkimukset osoittavat, että metformiini erittyy maitoon ja saavuttaa verrattavan tason plasmassa. Vastaavia tutkimuksia ei ole tehty imettäville äideille. Koska mahdollisuus hypoglykemiaan imeväisillä lapsilla voi olla, on tehtävä päätös siitä lopettaa hoitotyö tai lopettaa lääkitys ottaen huomioon lääkkeen merkitys äiti. Jos Glucophage tai Glucophage XR lopetetaan, ja jos ruokavalio ei yksin riitä verensokerin säätelemiseen, insuliinihoitoa tulee harkita.
Lasten käyttö
Glucophagen turvallisuus ja tehokkuus tyypin 2 diabeteksen hoidossa on vahvistettu vuonna 2003 10-16-vuotiaat lapsipotilaat (tutkimuksia ei ole tehty alle 10-vuotiaille lapsipotilaille) vuotta). Glukofagin käyttöä tässä ikäryhmässä tukevat riittävät ja hyvin kontrolloidut glukofagea-tutkimukset aikuisilla ja lisätiedot kontrolloidussa kliinisessä tutkimuksessa 10-16-vuotiailla lapsipotilailla, joilla on tyypin 2 diabetes, joka osoitti glykeemisen hoidon vastaavan vasteen kuin aikuisia. (Katso KLIININEN FARMAKOLOGIA: Pediatric Clinical Studies.) Tässä tutkimuksessa haittavaikutukset olivat samanlaisia kuin aikuisilla kuvatut. (Katso HAITTAVAIKUTUKSET: Pediatriset potilaat.) Enimmäisvuorokausiannos on 2000 mg. (Katso ANNOSTELU JA HALLINNOINTI: Suositeltu annosohjelma: Lastenlääketiede.)
Glucophage XR: n turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Glucophage- ja Glucophage XR -kontrolloiduissa kliinisissä tutkimuksissa ei ollut mukana riittävää määrää ikääntyneitä potilaita sen määrittämiseksi, reagoivatko he toisin kuin nuoremmat potilaat, vaikka muissa ilmoitetuissa kliinisissä kokemuksissa ei ole havaittu eroja ikääntyneiden ja nuorempien potilaiden vasteissa potilaita. Metformiinin tiedetään erittyvän olennaisesti munuaisten kautta ja koska lääkkeelle aiheutuvien vakavien haittavaikutusten riski on suurempi munuaisten vajaatoimintaa sairastaville potilaille Glucophage- ja Glucophage XR -insuliinia tulisi käyttää vain potilailla, joilla on normaali munuaisten toiminta (ks. VASTA, VAROITUKSETja KLIININEN FARMAKOLOGIA: Farmakokinetiikka). Koska ikääntymiseen liittyy munuaisten vajaatoiminnan heikkeneminen, Glucophage- tai Glucophage XR -insuliinia tulee käyttää varoen iän kasvaessa. Annoksen valinnassa on noudatettava varovaisuutta ja sen on perustuttava huolelliseen ja säännölliseen munuaisten toiminnan seurantaan. Iäkkäitä potilaita ei yleensä pitäisi titrata Glucophage- tai Glucophage XR -annokselle (ks. Myös VAROITUKSET ja ANNOSTELU JA HALLINNOINTI).
ylin
Haitalliset reaktiot
Yhdysvalloissa tehdyssä kaksoissokkotutkimuksessa, jossa tutkittiin glukofagia tyypin 2 diabeetikoilla, yhteensä 141 potilasta sai glukofagihoitoa (enintään 2550 mg päivässä) ja 145 potilasta sai lumelääkettä. Taulukossa 11 on lueteltu haittavaikutukset, joita on ilmoitettu yli 5 prosentilla glukofagipotilaista, ja jotka olivat yleisempiä glukofagipotilailla kuin plasebohoitoa saaneilla potilailla.
Taulukko 11: Yleisimmät haittavaikutukset (> 5,0 prosenttia) lumelääkekontrolloidussa kliinisessä tutkimuksessa glukofagimonoterapiassa *
| Haitallinen reaktio | Glucophage monoterapia (N = 141) |
Plasebo (N = 145) |
|---|---|---|
| % potilaista | ||
| * Reaktiot, jotka olivat yleisempiä Glukofage-hoidossa kuin lumelääkkeellä. | ||
| Ripuli | 53.2 | 11.7 |
| Pahoinvointi oksentelu | 25.5 | 8.3 |
| Ilmavaivat | 12.1 | 5.5 |
| voimattomuus | 9.2 | 5.5 |
| Ruoansulatushäiriöt | 7.1 | 4.1 |
| Vatsan epämukavuus | 6.4 | 4.8 |
| Päänsärky | 5.7 | 4.8 |
Ripuli johti tutkimuslääkityksen lopettamiseen 6%: lla Glukofageilla hoidetuista potilaista. Lisäksi seuraavia haittavaikutuksia ilmoitettiin â € 1,0% –5,0% glukofagipotilaista, ja niitä ilmoitettiin yleisemmin Glucophage-hoidossa kuin lumelääkkeellä: epänormaali uloste, hypoglykemia, lihaskipu, päänsärky, hengenahdistus, kynsisairaudet, ihottuma, lisääntynyt hikoilu, makuhäiriöt, epämukavuus rinnassa, vilunväristykset, flunssan oireyhtymä, punoitus, sydämentykytys.
Maailmanlaajuisissa kliinisissä tutkimuksissa yli 900 tyypin 2 diabetesta sairastavaa potilasta on hoidettu Glucophage XR: llä plasebotutkimuksissa ja aktiivisesti kontrolloiduissa tutkimuksissa. Lumekontrolloiduissa tutkimuksissa 781 potilaalle annettiin Glucophage XR ja 195 potilaalle lumelääkettä. Taulukossa 12 on lueteltu haittavaikutukset, joita on ilmoitettu yli 5 prosentilla Glucophage XR -potilaista ja jotka olivat yleisempiä Glucophage XR- kuin lumelääkehoitoa saaneilla potilailla.
Taulukko 12: Yleisimmät haittavaikutukset (> 5,0 prosenttia) lumelääkekontrolloiduissa glukofage XR: n tutkimuksissa *
| Haitallinen reaktio | Glucophage XR (N = 781) |
Plasebo (N = 195) |
|---|---|---|
| % potilaista | ||
| * Reaktiot, jotka olivat yleisempiä Glucophage XR- kuin lumelääkehoitoa saaneilla potilailla. | ||
| Ripuli | 9.6 | 2.6 |
| Pahoinvointi oksentelu | 6.5 | 1.5 |
Ripuli johti lääkityksen lopettamiseen 0,6%: lla Glucophage XR -hoidolla hoidetuista potilaista. Lisäksi seuraavia haittavaikutuksia ilmoitettiin â € 1,0% –5,0% Glucophage XR -potilaista, ja niitä ilmoitettiin yleisemmin Glucophage XR kuin lumelääke: vatsakipu, ummetus, vatsan turvotus, dyspepsia / närästys, ilmavaivat, huimaus, päänsärky, ylähengitysteiden infektiot, maku häiriö.
Pediatriset potilaat
Kliinisissä tutkimuksissa Glucophage -tableteilla lapsilla, joilla on tyypin 2 diabetes, haittavaikutusten profiili oli samanlainen kuin aikuisilla.
ylin
yliannos
Metformiinihydrokloridia on yliannostettu, mukaan lukien yli 50 gramman määrien nauttiminen. Hypoglykemiaa ilmoitettiin noin 10%: lla tapauksista, mutta syy-yhteyttä metformiinihydrokloridiin ei ole osoitettu. Maitohappoasidoosia on ilmoitettu noin 32%: lla metformiinin yliannostuksista (ks VAROITUKSET). Metformiini on dialysoitavissa puhdistuman ollessa jopa 170 ml / min hyvissä hemodynaamisissa olosuhteissa. Siksi hemodialyysi voi olla hyödyllinen kerääntyneen lääkkeen poistamiseksi potilailta, joilla epäillään metformiinin yliannosta.
ylin
Annostelu ja hallinnointi
Tyypin 2 diabeteksen potilailla, joilla on Glucophage tai Glucophage XR tai jokin muu farmakologinen aine, ei ole kiinteää annostusohjelmaa hyperglykemian hoitamiseksi. Glucophage- tai Glucophage XR -annostelut on yksilöitävä sekä tehokkuuden että sietokyvyn perusteella, mutta ne eivät saa ylittää suositeltuja päivittäisiä enimmäisannoksia. Suurin suositeltava vuorokausiannos Glucophage on 2550 mg aikuisilla ja 2000 mg lapsipotilailla (10-16-vuotiaat); Glucophage XR: n suurin suositeltu vuorokausiannos aikuisilla on 2000 mg.
Glucophage tulee antaa jaettuina annoksina aterioiden kanssa, kun taas Glucophage XR tulisi yleensä antaa kerran päivässä ilta-aterian yhteydessä. Glucophage tai Glucophage XR tulisi aloittaa pienellä annoksella, asteittain lisäämällä annosta, jotta molemmat maha-suolikanavan haittavaikutukset ja jotta voidaan määrittää pienin annos, jota vaaditaan riittävän glykeemisen kontrollin saavuttamiseksi potilaan.
Hoidon aloittamisen ja annoksen titrauksen aikana (ks. Jäljempänä suositeltu annosohjelma) plasman glukoosin paaston tulee olla paastoa käytetään määrittämään terapeuttinen vaste Glucophage tai Glucophage XR: lle ja määrittämään pienin tehokas annos potilaalle. Sen jälkeen glykosyloitu hemoglobiini tulisi mitata noin kolmen kuukauden välein. Terapeuttisen tavoitteen tulisi olla vähentää sekä paastohoidon plasman glukoositasoa että glykosyloituneita hemoglobiinitasoja normaaliksi tai melkein normaaliksi käyttämällä pienintä tehokasta annosta Glucophage tai Glucophage XR joko käytettäessä monoterapiana tai yhdessä sulfonyyliurean tai insuliini.
Verensokerin ja glykosyloidun hemoglobiinin tarkkailu mahdollistaa myös primaarisen vajaatoiminnan havaitsemisen, ts. Verensokerin riittämättömän alentamisen kohdalla maksimaalinen suositeltu lääkitysannos, ja toissijainen vajaatoiminta, ts. riittävän verensokeria alentavan vasteen menetyksestä alkujakson jälkeen tehokkuutta.
Glucophage- tai Glucophage XR -hoidon lyhytaikainen antaminen voi olla riittävä ohimenevän hallinnan menettämisen aikana potilailla, jotka yleensä hallitaan hyvin pelkästään ruokavalion avulla.
Glucophage XR -tabletit on nieltävä kokonaisina, eikä niitä saa koskaan murskata tai pureskella. Toisinaan Glucophage XR: n inaktiiviset aineosat poistuvat ulosteesta pehmeänä, hydratoituneena massana.
Suositeltu annosteluaikataulu
Aikuisia
Yleensä kliinisesti merkittäviä vasteita ei havaita annoksilla, jotka ovat alle 1500 mg päivässä. Maha-suolikanavan oireiden minimoimiseksi on kuitenkin suositeltavaa pienempi aloitusannos ja vähitellen suurempi annos.
Glucophage (metformiinihydrokloridi) -tablettien tavallinen aloitusannos on 500 mg kahdesti päivässä tai 850 mg kerran päivässä aterian yhteydessä. Annostusta tulisi lisätä 500 mg: n viikossa tai 850 mg: n välein 2 viikon välein, kokonaismääräksi 2000 mg / vrk jaettuna. Potilaat voidaan titrata myös 500 mg: sta kahdesti päivässä 850 mg: aan kahdesti päivässä 2 viikon kuluttua. Niille potilaille, jotka tarvitsevat ylimääräistä glykeemistä kontrollia, Glucophage voidaan antaa enimmäisannos vuorokaudessa 2550 mg päivässä. Yli 2000 mg: n annokset voidaan sietää paremmin 3 kertaa päivässä aterian yhteydessä.
Glucophage XR (metformin hydrochloride) depottablettien tavallinen aloitusannos on 500 mg kerran päivässä ilta-aterian yhteydessä. Annostusta tulisi lisätä 500 mg: n viikoittain, korkeintaan 2000 mg: aan kerran päivässä ilta-aterian yhteydessä. Jos glykeemista kontrollia ei saavuteta Glucophage XR 2000 mg: lla kerran päivässä, tulisi harkita Glucophage XR 1000 mg: n annosta kahdesti päivässä. Jos metformiinin suurempia annoksia tarvitaan, Glucophage-valmistetta tulee käyttää päivittäisissä kokonaisannoksissa, jotka ovat korkeintaan 2550 mg, jaettuna päivittäin jaettuina annoksina, kuten yllä on kuvattu. (Katso KLIININEN FARMAKOLOGIA: Kliiniset tutkimukset.)
Satunnaistetussa tutkimuksessa potilaat, joita hoidetaan tällä hetkellä Glucophage-hoidolla, siirtyivät Glucophage XR -hoitoon. Tämän tutkimuksen tulokset viittaavat siihen, että Glucophage-hoitoa saavat potilaat voidaan vaihtaa turvallisesti Glucophage XR -hoitoon kerran päivässä samassa kokonaispäiväannoksessa, korkeintaan 2000 mg kerran päivässä. Glucophage-hoidosta Glucophage XR: lle siirtymisen jälkeen glykeemistä kontrollia on seurattava tarkoin ja annostusta on muutettava vastaavasti (ks. KLIININEN FARMAKOLOGIA: Kliiniset tutkimukset).
lastentautioppi
Glucophagen tavallinen aloitusannos on 500 mg kahdesti päivässä aterian yhteydessä. Annosta tulee suurentaa 500 mg: n annoksina viikossa, enintään 2000 mg: aan päivässä, jaettuna annoksina. Glucophage XR: n turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Siirtyminen toisesta diabeteksenvastaisesta hoidosta
Siirtymäkautta ei yleensä tarvita, kun potilaita siirretään muista tavanomaisista oraalisista hypoglykeemisistä aineista kuin klooripropamidista Glucophage- tai Glucophage XR -tableteihin. Siirtäessäsi potilaita klooripropamidista tulee olla varovainen kahden ensimmäisen viikon aikana klooripropamidin pitkittynyt pidättäminen kehossa, mikä johtaa päällekkäisiin lääkevaikutuksiin ja mahdolliseen hypoglykemiaan.
Samanaikainen glukofage- tai Glucophage XR- ja suun suun kautta tapahtuva sulfonyyliureahoito aikuisilla potilailla
Jos potilaat eivät ole reagoineet neljään viikkoon Glucophage- tai Glucophage XR -monoterapian maksimiannoksesta, tulisi harkita oraalinen sulfonyyliurea samalla kun jatketaan Glucophage- tai Glucophage XR -annosta maksimiannoksella, vaikka aikaisemmalla primaarisella tai toissijaisella epäonnistumisella sulfonyyliureassa on tapahtunut. Kliinisiä ja farmakokineettisiä lääkkeiden yhteisvaikutuksia koskevia tietoja on tällä hetkellä saatavana vain metformiinin ja glyburidin (glibenklamidin) kanssa.
Samanaikaisessa Glukofage- tai Glucophage XR- ja sulfonyyliureaterapiassa voidaan saavuttaa haluttu verensokerin hallinta säätämällä kunkin lääkkeen annosta. Kliinisessä tutkimuksessa potilailla, joilla oli tyypin 2 diabetes ja aikaisempi glyburidin vajaatoiminta, potilaat, joille annettiin Glucophage 500 mg, ja 20 mg glyburidi titrattiin annoksille 1000/20 mg, 1500/20 mg, 2000/20 mg tai 2500/20 mg glukofagea ja glyburidia vastaavasti glykeemisen kontrollin tavoitteen saavuttamiseksi mitattuna FPG: llä, HbA1c: llä ja plasman glukoosivasteella (katso KLIININEN FARMAKOLOGIA: Kliiniset tutkimukset). Tämän tavoitteen saavuttamiseksi on kuitenkin yritettävä tunnistaa kunkin lääkkeen pienin tehokas annos. Samanaikaisessa Glukofage- tai Glucophage XR- ja sulfonyyliureaterapiassa sulfonyyliureahoitoon liittyvä hypoglykemian riski jatkuu ja voi lisääntyä. Asianmukaiset varotoimenpiteet on toteutettava. (Katso vastaavan sulfonyyliurean pakkausseloste.)
Jos potilaat eivät ole tyydyttävästi reagoineet 1–3 kuukauden samanaikaiseen hoitoon Glucophage- tai Glucophage XR -annoksen ja Oraalisen sulfonyyliurean enimmäisannos, harkitse terapeuttisia vaihtoehtoja, mukaan lukien vaihto insuliinille joko Glucophage tai Glucophage XR: n kanssa tai ilman.
Samanaikainen glukofage- tai Glucophage XR- ja insuliinihoito aikuisilla potilailla
Nykyistä insuliiniannosta tulee jatkaa aloitettaessa Glucophage- tai Glucophage XR -hoito. Glukofagi- tai Glucophage XR -hoito tulee aloittaa annoksella 500 mg kerran päivässä potilailla, jotka saavat insuliinihoitoa. Potilaille, jotka eivät reagoi riittävästi, Glucophagen tai Glucophage XR: n annosta tulisi nostaa 500: lla. mg noin viikon kuluttua ja 500 mg joka viikko sen jälkeen, kunnes riittävä glykeeminen kontrolli on saavutettu saavutettu. Suurin suositeltu vuorokausiannos on 2500 mg Glucophagelle ja 2000 mg Glucophage XR: lle. Insuliiniannosta suositellaan alennettavaksi 10%: sta 25%: iin, kun paastotaan plasman glukoositasolla pitoisuudet laskevat alle 120 mg / dl potilailla, jotka saavat samanaikaisesti insuliinia ja glukofagea tai Glucophage XR. Lisäsäätö tulisi räätälöidä glukoosipitoisuutta alentavan vasteen perusteella.
Erityiset potilaspopulaatiot
Glucophage tai Glucophage XR: tä ei suositella käytettäväksi raskauden aikana. Glukofagea ei suositella alle 10-vuotiaille potilaille. Glucophage XR: tä ei suositella lapsipotilaille (alle 17-vuotiaille).
Glucophage- tai Glucophage XR -hoidon aloitus- ja ylläpitoannostuksen tulee olla varovaisia pitkäikäisillä potilailla, koska munuaistoiminta voi heikentyä tässä populaatiossa. Annoksen muuttamisen tulee perustua munuaisten toiminnan huolelliseen arviointiin. Iäkkäitä, heikentyneitä ja aliravittuja potilaita ei yleensä pidä titrata Glucophage- tai Glucophage XR -annokselle.
Munuaisten toiminnan seuranta on välttämätöntä maitohappoasidoosin ehkäisemiseksi, etenkin ikääntyneillä. (Katso VAROITUKSET.)
ylin
Kuinka toimitetaan
Glucophage® (metformiinihydrokloridi) tabletit
| 500 mg | 100 pulloa | NDC 0087-6060-05 |
| 500 mg | 500 pullon pullot | NDC 0087-6060-10 |
| 850 mg | 100 pulloa | NDC 0087-6070-05 |
| 1000 mg | 100 pulloa | NDC 0087-6071-11 |
Glucophage 500 mg -tabletit ovat pyöreitä, valkoisia tai luonnonvalkoisia, kalvopäällysteisiä tabletteja, joissa on merkintä "BMS" 6060 "tabletin kehän ympärillä toisella puolella ja" 500 "kohokuvioidulla toisella puolella puolella.
Glucophage 850 mg -tabletit ovat pyöreitä, valkoisia tai luonnonvalkoisia, kalvopäällysteisiä tabletteja, joissa on merkintä "BMS" 6070 "tabletin kehän ympärillä toisella puolella ja" 850 "kohokuvioidulla toisella puolella puolella.
Glucophage 1000 mg -tabletit ovat valkoisia, soikeita, kaksoiskuperia, kalvopäällysteisiä tabletteja, joiden toisella puolella on merkintä "BMS 6071" ja toisella puolella "1000", ja molemmilla puolilla puolisko.
Glucophage® XR (metformiinihydrokloridi) pidennetyn vapautumisen tabletit
| 500 mg | 100 pulloa | NDC 0087-6063-13 |
| 750 mg | 100 pulloa | NDC 0087-6064-13 |
Glucophage XR 500 mg -tabletit ovat valkoisia tai luonnonvalkoisia, kapselin muotoisia, kaksoiskuperia tabletteja, joiden toisella puolella on merkintä "BMS 6063" ja toisella puolella "500".
Glucophage XR 750 mg -tabletit ovat kapselin muotoisia, kaksoiskuperia tabletteja, joiden toisella puolella on merkintä "BMS 6064" ja toisella puolella "750". Tabletit ovat vaaleanpunaisia ja ne saattavat olla täpliä.
varastointi
Varastoi lämpötilassa 20 ° -25 ° C (68 ° -77 ° F); retket sallittu lämpötilaan 15 ° -30 ° C (59 ° -86 ° F). [Katso USP: n kontrolloima huonelämpötila.]
Annostele valonkestävissä astioissa.
Glucophage® on Merck Santé S.S.S.:n, Merck KGaA: n osakkuusyrityksen, Darmstadt, Saksa, rekisteröity tavaramerkki. Lisenssi yritykselle Bristol-Myers Squibb Company.
Jakaja:
Bristol-Myers Squibb -yhtiö
Princeton, NJ 08543 USA
viimeisin päivitys: 01/2009
Glukohage, metformiinihydrokloridi, potilastiedot (selkeästi englanniksi)
Yksityiskohtaiset tiedot diabeteksen oireista, oireista, syistä ja hoidoista
Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötapoja, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysymyksiä käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta.
takaisin: Selaa kaikkia diabeteksen lääkkeitä



