Onglyza diabeteksen hoidossa
Tuotemerkki: Onglyza
Yleinen nimi: saksagliptiini
Annosmuoto: tabletti, kalvopäällysteinen
Sisällys:
Käyttöaiheet ja käyttö
Annostelu ja hallinnointi
Annosmuodot ja vahvuudet
Vasta
Varoitukset ja varotoimet
Haitalliset reaktiot
Huumeiden yhteisvaikutukset
Käyttö tietyissä populaatioissa
yliannostus
Kuvaus
farmakologia
Ei-kliininen toksikologia
Kliiniset tutkimukset
Kuinka toimitetaan
Onglyza-potilastiedot (selkeästi englanniksi)
Käyttöaiheet ja käyttö
Monoterapia ja yhdistelmähoito
Onglyza on tarkoitettu lisäaineeksi ruokavalioon ja liikuntaan glykeemisen hoidon parantamiseksi aikuisilla, joilla on tyypin 2 diabetes mellitus. [See Kliiniset tutkimukset].
Tärkeät käyttörajoitukset
Onglyzaa ei tule käyttää tyypin 1 diabeteksen tai diabeettisen ketoasidoosin hoitoon, koska se ei olisi tehokas näissä olosuhteissa.
Onglyzaa ei ole tutkittu yhdessä insuliinin kanssa.
ylin
Annostelu ja hallinnointi
Suositeltu annostus
Suositeltava Onglyza-annos on 2,5 mg tai 5 mg kerran päivässä ateriasta riippumatta.
Munuaisten vajaatoiminta
Onglyzan annostuksen muuttamista ei suositella potilaille, joilla on lievä munuaisten vajaatoiminta (kreatiniinipuhdistuma [CrCl]> 50 ml / min).
Onglyza-annos on 2,5 mg kerran päivässä potilaille, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta, tai loppuvaiheen munuaissairaudessa (ESRD), joka vaatii hemodialyysiä (kreatiniinipuhdistuma [CrCl] - 50 ml / min). Onglyza tulee antaa hemodialyysin jälkeen. Onglyzaa ei ole tutkittu potilailla, jotka saavat peritoneaalidialyysin.
Koska Onglyza-annoksen tulisi olla rajoitettu 2,5 mg: aan munuaisten toiminnan perusteella, munuaisten toiminnan arviointia suositellaan ennen Onglyza-hoidon aloittamista ja määräajoin sen jälkeen. Munuaisten toiminta voidaan arvioida seerumin kreatiniinista Cockcroft-Gault-kaavalla tai ruokavalion muokkaamisella munuaistautien kaavalla. [See Kliininen farmakologia, Farmakokinetiikka.]
Vahvat CYP3A4 / 5-estäjät
Onglyza-annos on 2,5 mg kerran päivässä annettaessa samanaikaisesti voimakkaiden sytokromi P450 3A4 / 5 (CYP3A4 / 5) -inhibiittoreiden kanssa (esim. ketokonatsoli, atatsanaviiri, klaritromysiini, indinaviiri, itrakonatsoli, nefatsodoni, nelfinaviiri, ritonaviiri, sakinaviiri ja telitromysiini). [See Huumeiden yhteisvaikutukset, CYP3A4 / 5-entsyymien ja Kliininen farmakologia, Farmakokinetiikka.]
ylin
Annosmuodot ja vahvuudet
- Onglyza (saksagliptiini) 5 mg -tabletit ovat vaaleanpunaisia, kaksoiskuperia, pyöreitä, kalvopäällysteisiä tabletteja, joiden toiselle puolelle on painettu "5" ja kääntöpuolelle "4215", sinisellä musteella.
- Onglyza (saksagliptiini) 2,5 mg -tabletit ovat vaaleankeltaisia tai vaaleankeltaisia, kaksoiskuperia, pyöreitä, kalvopäällysteisiä tabletteja, joiden toiselle puolelle on painettu "2,5" ja kääntöpuolelle "4214", sinisellä musteella.
ylin
Vasta
Ei mitään.
ylin
Varoitukset ja varotoimet
Käytä lääkkeiden kanssa, joiden tiedetään aiheuttavan hypoglykemiaa
Insuliinin erittäjät, kuten sulfonyyliureat, aiheuttavat hypoglykemiaa. Siksi pienempi annos insuliinin eritystä lisäävää ainetta voidaan tarvita vähentämään hypoglykemian riskiä käytettäessä sitä yhdessä Onglyzan kanssa. [See Haitalliset reaktiot, Kliinisten kokeiden kokemus.]
Makrovaskulaariset tulokset
Onglyzan tai minkään muun diabeteksen vastaisen lääkkeen kanssa ei ole tehty kliinisiä tutkimuksia, jotka olisivat osoittaneet vakuuttavia todisteita makrovaskulaarisen riskin vähentämisestä.
ylin
Haitalliset reaktiot
Kliinisten kokeiden kokemus
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, a lääkettä ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa esiintyviin määriin, eikä se välttämättä heijasta vuonna 2006 havaittuja määriä harjoitella.
Monoterapia ja lisäyhdistelmähoito
Kahdessa lumelääkekontrolloidussa 24 viikon kestävässä monoterapiakokeessa potilaita hoidettiin Onglyza 2,5 mg: lla päivässä, Onglyza: lla 5 mg päivässä ja lumelääkkeellä. Suoritettiin myös kolme 24 viikon plasebokontrolloitua lisäyhdistelmähoitotutkimusta: yksi metformiinin kanssa, yksi tiatsolidiinidionin (pioglitatsoni tai rosiglitatsoni) kanssa ja toinen glyburidin kanssa. Näissä kolmessa tutkimuksessa potilaat satunnaistettiin lisähoitoon Onglyza 2,5 mg päivässä, Onglyza 5 mg päivässä tai lumelääke. 10 mg: n saksagliptiinihoitohaara sisällytettiin yhteen monoterapiakokeeseen ja lisäyhdistelmäkokeeseen metformiinin kanssa.
Kahden monoterapiakokeen, metformiinihoidon lisäyksen, tiatsolidiinidioni (TZD) -kokeen, 24 viikon tietojen (glykeemisesta pelastuksesta riippumatta) ennalta määritellyssä yhdistetyssä analyysissä, ja lisäyksenä glyburiditutkimukseen haittavaikutusten yleinen esiintyvyys potilailla, joita hoidettiin Onglyza 2,5 mg: lla ja Onglyza 5 mg: lla, oli samanlainen kuin plasebolla (72,0% ja 72,2% vs. 70,6%, vastaavasti). Hoito keskeytettiin haittavaikutusten takia 2,2%: lla, 3,3%: lla ja 1,8%: lla potilaista, jotka saivat Onglyzaa 2,5 mg, Onglyza 5 mg ja lumelääkettä. Yleisimmät haittavaikutukset (ilmoitettu vähintään kahdella potilaalla, jota hoidettiin Onglyza 2,5 mg: lla, tai vähintään kahdella potilaalla, joita hoidettiin Onglyza-hoidolla 5 mg), joka liittyi hoidon ennenaikaiseen keskeyttämiseen, sisälsi lymfopeniaa (vastaavasti 0,1% ja 0,5% vs. 0%), ihottumaa (0,2% ja 0,3% vs. 0,3%), veren kreatiniini nousi (0,3% ja 0% vs. 0%) ja veren kreatiinifosfokinaasi nousi (0,1% ja 0,2% verrattuna 0%). Tämän yhdistetyn analyysin haittavaikutukset ilmoitettiin (riippumatta tutkijan tekemästä syy - yhteydestä) vuonna 2006 - 5%: lla Onglyza 5 mg: lla hoidetuista potilaista, ja yleisemmin kuin plasebolla hoidetuissa potilaissa, Pöytä 1.
Taulukko 1: Haittavaikutukset (riippumatta tutkijan suorittamasta syy-yhteyden arvioinnista) plasebo-kontrolloiduissa tutkimuksissa * Raportoitu - 5%: lla 5 mg: n Onglyza-hoitoa saaneista potilaista ja yleisemmin kuin potilailla, joita hoidettiin Plasebo
| Potilaiden lukumäärä (%) | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
Plasebo N = 799 |
|
| * 5 plasebokontrolloitua tutkimusta sisältää kaksi monoterapiakoetta ja yhden yhdistelmähoidon lisäkokeen kaikilla seuraavilla: metformiini, tiatsolidiinidioni tai glyburidi. Taulukko näyttää 24 viikon tiedot riippumatta glykeemisestä pelastuksesta. | ||
| Ylähengitysteiden infektio | 68 (7.7) | 61 (7.6) |
| Virtsatieinfektio | 60 (6.8) | 49 (6.1) |
| Päänsärky | 57 (6.5) | 47 (5.9) |
Potilailla, joita hoidettiin Onglyza 2,5 mg: lla, päänsärky (6,5%) oli ainoa haittavaikutus, jonka ilmoitettiin esiintyneen ¥ ¥% 5% ja yleisemmin kuin lumelääkkeellä hoidetuilla potilailla.
Tässä yhdistetyssä analyysissä haittavaikutuksia, joita ilmoitettiin â% 2%: lla potilaista, joita hoidettiin Onglyza 2,5 mg: lla tai Onglyza 5 mg: lla, ja â ‰ 1% useammin kuin lumelääkkeessä, sisältyivät: sinuiitti (2,9% ja 2,6% verrattuna 1,6%), vatsakipu (2,4% ja 1,7% vs. 0,5%), gastroenteriitti (1,9% ja 2,3% vs. 0,9%) ja oksentelu (2,2% ja 2,3% vs. 1,3%) ).
Lisäosana TZD-tutkimukseen perifeeristen turvotusten esiintyvyys oli korkeampi Onglyza 5 mg: lla verrattuna lumelääkkeeseen (vastaavasti 8,1% ja 4,3%). Perifeerisen ödeeman esiintyvyys 2,5 mg Onglyza-hoidossa oli 3,1%. Yksikään perifeerisen ödeeman ilmoitetuista haittavaikutuksista ei johtanut tutkimuslääkityksen lopettamiseen. Onglyza 2,5 mg: n ja 5 mg Onglyza: n perifeerisen turvotuksen osuus verrattuna lumelääkkeeseen oli 3,6% ja 2% vs. 3% monoterapiana, 2,1% ja 2,1% verrattuna 2,2%: seen lisähoitona metformiinille ja 2,4% ja 1,2% verrattuna 2,2%: iin lisähoitona glyburide.
Murtumien esiintyvyysaste oli 1,0 ja 0,6 / 100 potilasvuotta vastaavasti Onglyzalla (yhdistetty analyysi 2,5 mg, 5 mg ja 10 mg) ja lumelääkkeellä. Onglyzaa saaneiden potilaiden murtumien esiintyvyys ei kasvanut ajan myötä. Syy-yhteyttä ei ole osoitettu, ja ei-kliiniset tutkimukset eivät ole osoittaneet saksagliptiinin haittavaikutuksia luuhun.
Kliinisessä ohjelmassa havaittiin trombosytopenian tapahtuma, joka oli johdonmukainen idiopaattisen trombosytopeenisen purpurin diagnoosin kanssa. Tämän tapahtuman suhdetta Onglyzaan ei tunneta.
Metformiinin kanssa samanaikaisesti annettavan Onglyza-hoidon haittavaikutukset tyypin 2 diabeteksen aikaisemmin hoitamattomilla potilailla
Taulukossa 2 esitetään ilmoitetut haittavaikutukset (riippumatta tutkijan syy-yhteyden arvioinnista) 5%: lla potilaista osallistuminen ylimääräiseen 24 viikon aktiivisesti kontrolloituun tutkimukseen samanaikaisesti annetusta Onglyzasta ja metformiinista aiemmin hoitamattomissa potilaita.
Taulukko 2: Onglyzan ja metformiinin yhdistelmähoito potilailla, jotka eivät ole aiemmin saaneet hoitoa: Haittavaikutukset ilmoitettu (riippumatta tutkijan arvioinnista) syy-yhteys) 5%: lla potilaista, joita hoidettiin Onglyza 5 mg Plus Metformin -yhdistelmähoidolla (ja yleisemmin kuin potilailla, joita hoidettiin metformiinilla) Yksin)
| Potilaiden lukumäärä (%) | ||
|---|---|---|
| Onglyza 5 mg + metformiini * N = 320 |
metformiini * N = 328 |
|
| * Metformiini aloitettiin aloitusannoksella 500 mg päivässä, ja se titrattiin korkeintaan 2000 mg: aan vuorokaudessa. | ||
| Päänsärky | 24 (7.5) | 17 (5.2) |
| nasofaryngiitti | 22 (6.9) | 13 (4.0) |
hypoglykemia
Hypoglykemian haittavaikutukset perustuivat kaikkiin hypoglykemian ilmoituksiin; samanaikaista glukoosimittausta ei vaadittu. Lisäyksessä glyburiditutkimukseen ilmoitetun hypoglykemian yleinen esiintyvyys oli suurempi Onglyza 2,5 mg: lla ja Onglyza 5 mg: lla (13,3% ja 14,6%) verrattuna lumelääkkeeseen (10,1%). Vahvistetun hypoglykemian esiintyvyys tässä tutkimuksessa, joka määritellään hypoglykemian oireiksi, joihin liittyy a sormenpään glukoosiarvo â ‰ ¤ 50 mg / dL oli 2,4% ja 0,8% Onglyza 2,5 mg: lla ja Onglyza 5 mg ja 0,7% plasebo. Onglyza 2,5 mg: n ja 5 mg Onglyza: n ilmoitetun hypoglykemian esiintyvyys verrattuna lumelääkkeeseen monoterapiana oli 4,0% ja 5,6% verrattuna Metformiinin lisähoitona 4,1%, 7,8% ja 5,8% verrattuna 5%: iin ja 4,1% ja 2,7% verrattuna 3,8%: iin lisähoitona TZD. Raportoidun hypoglykemian esiintyvyys oli 3,4% potilailla, jotka eivät olleet saaneet hoitoa aiemmin, jos potilaalla oli annettu Onglyza 5 mg plus metformiini, ja 4,0% potilaista, joille annettiin pelkästään metformiinia.
Yliherkkyysreaktiot
Yliherkkyyteen liittyvät tapahtumat, kuten urtikaria ja kasvojen turvotus viiden tutkimuksen yhdistetyssä analyysissä viikolle 24 saakka ilmoitettiin 1,5%: lla, 1,5%: lla ja 0,4%: lla potilaista, jotka saivat Onglyzaa 2,5 mg, Onglyzaa 5 mg ja plaseboa, vastaavasti. Mikään näistä tapahtumista Onglyzaa saaneilla potilailla ei edellyttänyt sairaalahoitoa tai tutkijoiden ilmoittamien olevan hengenvaarallisia. Yksi saksagliptiinilla hoidettu potilas lopetti tässä yhdistetyssä analyysissä yleistyneen urtikarian ja kasvojen turvotuksen vuoksi.
Elonmerkit
Onglyzalla hoidetuilla potilailla ei ole havaittu kliinisesti merkittäviä muutoksia elintärkeissä merkkeissä.
Laboratoriotestit
Absoluuttinen lymfosyyttimäärä
Onglyzalla havaittiin annoksesta riippuvainen absoluuttisen lymfosyyttimäärän keskimääräinen lasku. Perustasosta keskimäärin absoluuttisen lymfosyyttimäärän ollessa noin 2200 solua / mikrolitra, keskimääräinen lasku noin 100 ja 120 solua / mikrolitra Onglyza 5 mg ja 10 mg lumelääkkeeseen verrattuna havaittiin 24 viikolla viiden plasebokontrolloidun kliinisen kliinisen analyysin yhdistetyssä analyysissä opinnot. Samanlaisia vaikutuksia havaittiin, kun Onglyza 5 mg annettiin alussa yhdistelmänä metformiinin kanssa verrattuna pelkästään metformiiniin. Onglyza 2,5 mg: lla ei havaittu eroa lumelääkkeeseen verrattuna. Niiden potilaiden osuus, joiden lymfosyyttimäärä oli ¤ 750 solua / mikrolitra, oli 0,5%, 1,5%, 1,4% ja 0,4% saksagliptiinilla 2,5 mg, 5 mg, 10 mg ja lumelääkkeellä. Useimmilla potilailla toistumista ei havaittu toistuvalla Onglyza-altistuksella, vaikka joillakin potilailla toistuvia laskuja esiintyi uudelleenhoitoon, mikä johti Onglyza-hoidon lopettamiseen. Lymfosyyttimäärän väheneminen ei liittynyt kliinisesti merkittäviin haittavaikutuksiin.
Tämän lymfosyyttimäärän laskun kliinistä merkitystä plaseboon verrattuna ei tunneta. Lymfosyyttimäärä on mitattava, kun se on kliinisesti indikoitu, kuten epätavallisen tai pitkittyneen tartunnan olosuhteissa. Onglyzan vaikutusta lymfosyyttimäärään potilailla, joilla on lymfosyyttien poikkeavuuksia (esim. Ihmisen immuunikatovirus), ei tunneta.
verihiutaleet
Onglyza ei osoittanut kliinisesti merkityksellistä tai jatkuvaa vaikutusta verihiutalemäärään kuudessa, kaksoissokkoutetussa, kontrolloidussa kliinisessä turvallisuus- ja tehotutkimuksessa.
ylin
Huumeiden yhteisvaikutukset
CYP3A4 / 5-entsyymien induktorit
Rifampin laski merkittävästi saksagliptiinialtistusta muuttumatta aktiivisen metaboliitin, 5-hydroksisaksagliptiinin, aikapitoisuuskäyrän (AUC) pinta-alaa. Rifampiini ei vaikuttanut plasman dipeptidyylipeptidaasi-4 (DPP4) -aktiivisuuden estämiseen 24 tunnin annosvälin aikana. Siksi Onglyza-annoksen muuttamista ei suositella. [See Kliininen farmakologia, Farmakokinetiikka.]
CYP3A4 / 5-entsyymien estäjät
Kohtalaiset CYP3A4 / 5: n estäjät
Diltiatseemi lisäsi saksagliptiinialtistusta. Samankaltaisia saksagliptiinipitoisuuksien nousuja plasmassa odotetaan tapahtuvan muun kohtalaisen CYP3A4 / 5: n läsnäollessa. estäjät (esim. amprenaviiri, aprepitantti, erytromysiini, flukonatsoli, fosamprenaviiri, greippimehu ja verapamiili); Onglyzan annoksen muuttamista ei kuitenkaan suositella. [See Kliininen farmakologia, Farmakokinetiikka.]
Vahvat CYP3A4 / 5-estäjät
Ketokonatsoli lisäsi merkitsevästi saksagliptiinialtistusta. Samanlaisten merkittävien saksagliptiinipitoisuuksien nousu plasmassa on odotettavissa muiden vahvojen CYP3A4 / 5-estäjien kanssa. (esimerkiksi atatsanaviiri, klaritromysiini, indinaviiri, itrakonatsoli, nefatsodoni, nelfinaviiri, ritonaviiri, sakinaviiri ja telitromysiini). Onglyza-annos tulee rajoittaa 2,5 mg: aan, kun sitä annetaan samanaikaisesti voimakkaan CYP3A4 / 5-estäjän kanssa. [See Annostelu ja hallinnointi, Vahvat CYP3A4 / 5-estäjät ja Kliininen farmakologia, Farmakokinetiikka.]
ylin
Käyttö tietyissä populaatioissa
raskaus
Raskausluokka B
Raskaana olevilla naisilla ei ole riittäviä ja hyvin kontrolloituja tutkimuksia. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, Onglyzaa, kuten muita diabeteksen vastaisia lääkkeitä, tulee käyttää raskauden aikana vain tarvittaessa.
Saksagliptiini ei ollut teratogeeninen yhdessäkään testatussa annoksessa, kun sitä annettiin tiineille rotille ja kaneille organogeneesin aikana. Lantion epätäydellinen luutuminen, eräänlainen kehitysviive, tapahtui rotilla annoksella 240 mg / kg tai noin 1503 ja 66-kertainen ihmisen altistus saksagliptiinille ja aktiiviselle metaboliitille, vastaavasti, ihmisten suurimmalla suositeltavalla annoksella (MRHD), joka on 5 mg. Äidille aiheutunut toksisuus ja sikiön kehon painon väheneminen havaittiin saksagliptiinin ja aktiivisen metaboliitin vastaavassa arvossa 7986 ja 328-kertaisesti ihmisen altistumisella. Pienet luuvaihtelut kaneilla tapahtuivat emälle toksisella annoksella 200 mg / kg tai noin 1432 ja 992 kertaa MRHD. Rotille annettuna yhdessä metformiinin kanssa saksagliptiini ei ollut teratogeeninen eikä alkionmuodollinen altistuksissa, jotka olivat 21-kertaiset saksagliptiinin MRHD-arvon kanssa. Metformiinin yhdistelmähoito suuremman saksagliptiiniannoksen kanssa (109 kertaa saksagliptiinin MRHD) craniorachischisis (harvinainen neuraaliputken vika, jolle on tunnusomaista kallo- ja selkärangan epätäydellinen sulkeutuminen) kahdessa sikiössä yksi pato. Metformiini-altistukset kussakin yhdistelmässä olivat nelinkertaiset ihmisen altistukseen, joka oli 2000 mg vuorokaudessa.
Saksagliptiini, jota annettiin naarasrotille raskauspäivästä 6 - imetyksen päivään 20, johti miesten ja miesten ruumiinpainon laskuun naispuolisia jälkeläisiä vain emälle toksisina annoksina (altistuminen 29 29 1629 ja 53 kertaa saksagliptiini ja sen aktiivinen metaboliitti MRDH: hon). Rotien jälkeläisillä ei havaittu toiminnallista tai käyttäytymismyrkyllisyyttä, joille annettiin saksagliptiinia missään annoksessa.
Saksagliptiini läpäisee istukan sikiöön annostelun jälkeen tiineille rotille.
Imettävät äidit
Saksagliptiini erittyy imettävien rottien maitoon suunnilleen suhteessa 1: 1 plasman lääkepitoisuuksien kanssa. Ei tiedetä erittyykö saksagliptiini äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, Onglyzaa annettaessa imettävälle naiselle on noudatettava varovaisuutta.
Lasten käyttö
Onglyzan turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Kuudessa kaksoissokkoutetussa, kontrolloidussa kliinisessä turvallisuus- ja tehotutkimuksessa Onglyzalla 634 (15,3%) 4148 satunnaistetusta potilaasta oli 65-vuotiaita ja sitä vanhempia, ja 59 (1,4%) potilaista oli 75-vuotiaita ja vanhempia. 65-vuotiaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa. Vaikka tässä kliinisessä kokemuksessa ei ole havaittu eroja ikääntyneiden ja nuorempien potilaiden reaktioissa, joidenkin vanhempien potilaiden herkkyyttä ei voida sulkea pois.
Saksagliptiini ja sen aktiivinen metaboliitti eliminoituvat osittain munuaisten kautta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, iäkkäiden potilaiden annosvalinnassa on noudatettava varovaisuutta munuaisten toiminnan perusteella. [See Annostelu ja hallinnointi, Munuaisten vajaatoiminta ja Kliininen farmakologia, Farmakokinetiikka.]
ylin
yliannostus
Kontrolloidussa kliinisessä tutkimuksessa kerran päivässä suun kautta annettava Onglyza terveille henkilöille annoksina jopa 400 mg vuorokaudessa 2 viikon ajan (80 kertaa MRHD) ei ollut annosriippuvaisia kliinisiä haittavaikutuksia eikä kliinisesti merkittävää vaikutusta QTc-väliin tai sydämeen korko.
Yliannostuksen yhteydessä on aloitettava asianmukainen tukihoito potilaan kliinisen tilan mukaan. Saksagliptiini ja sen aktiivinen metaboliitti poistetaan hemodialyysillä (23% annoksesta 4 tunnin aikana).
ylin
Kuvaus
Saksagliptiini on oraalisesti aktiivinen DPP4-entsyymin estäjä.
Saksagliptiinimonohydraatti kuvataan kemiallisesti nimellä (1S, 3S, 5S) -2 - [(2S) -2-amino-2- (3-hydroksitrisyklo [3.3.1.13,7] dek-1-yyli) asetyyli] -2-atsabisyklo [3.1.0] heksaani-3-karbonitriili, monohydraatti tai (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino-2- (3-hydroksyadamantan-1-yyli) asetyyli] -2-atsabisyklo [3.1.0] heksaani-3-karbonitriili hydraatti. Empiirinen kaava on C18H25N3O2H2O ja molekyylipaino on 333,43. Rakennekaava on:
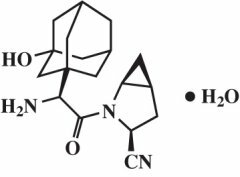
Saksagliptiinimonohydraatti on valkoinen tai vaaleankeltainen tai vaaleanruskea, ei-hygroskooppinen, kiteinen jauhe. Se liukenee heikosti veteen lämpötilassa 24 ° C ± 3 ° C, liukenee heikosti etyyliasetaattiin ja liukenee metanoliin, etanoliin, isopropyylialkoholiin, asetonitriiliin, asetoniin ja polyetyleeniglykoliin 400 (PEG 400).
Jokainen Onglyzan kalvopäällysteinen tabletti suun kautta otettavaksi sisältää joko 2,79 mg saksagliptiinivetykloridia (vedetöntä), joka vastaa 2,5 mg saksagliptiinia tai 5,58 mg saksagliptiinia hydrokloridi (vedetön), joka vastaa 5 mg saksagliptiinia ja seuraavat inaktiiviset aineosat: laktoosimonohydraatti, mikrokiteinen selluloosa, kroskarmelloosinatrium ja magnesiumstearaatti. Lisäksi kalvopäällyste sisältää seuraavat inaktiiviset aineosat: polyvinyylialkoholi, polyetyleeniglykoli, titaanidioksidi, talkki ja rautaoksidit.
ylin
Kliininen farmakologia
Toimintamekanismi
Lisääntyneet inkretiinhormonien, kuten glukagonin kaltaisen peptidi-1 (GLP-1) ja glukoosiriippuvaisten pitoisuudet insulinotrooppinen polypeptidi (GIP) vapautuu verenkiertoon ohutsuolesta vasteena aterioita. Nämä hormonit aiheuttavat insuliinin vapautumisen haiman beeta-soluista glukoosiriippuvaisella tavalla, mutta dipeptidyylipeptidaasi-4 (DPP4) -entsyymi inaktivoi ne muutamassa minuutissa. GLP-1 vähentää myös glukagonin eritystä haiman alfa-soluista vähentäen maksan glukoosin tuotantoa. Tyypin 2 diabeteksen potilailla GLP-1: n pitoisuudet pienenevät, mutta insuliinivaste GLP-1: een säilyy. Saksagliptiini on kilpailukykyinen DPP4-estäjä, joka hidastaa inkretiinhormonien inaktivoitumista lisääen siten niiden verenkiertoa pitoisuudet ja vähentävät paasto- ja ruokavalion jälkeisiä glukoosipitoisuuksia glukoosiriippuvaisella tavalla tyypin 2 diabeetikoilla mellitus.
farmakodynamiikka
Tyypin 2 diabetes mellitusta sairastavilla potilailla Onglyzan antaminen estää DPP4-entsyymiaktiivisuutta 24 tunnin ajan. Suun kautta otetun glukoosikuormituksen tai aterian jälkeen tämä DPP4-esto johti 2 - 3-kertaiseen nousuun verenkierrossa olevien aktiivisten pitoisuuksien tasolla GLP-1 ja GIP, vähentyneet glukagonipitoisuudet ja lisääntyneet glukoosiriippuvaiset insuliinieritykset haiman beeta-soluista. Insuliinin nousu ja glukagonin väheneminen liittyivät alhaisempiin paasto-glukoosipitoisuuksiin ja vähentyneeseen glukoosin kulkeutumiseen suun kautta annetun glukoosikuormituksen tai aterian jälkeen.
Sydän elektrofysiologia
Satunnaistetussa, kaksoissokkoutetussa, plasebokontrolloidussa, 4-suuntaisessa jaksotutkimuksessa aktiivisessa vertailututkimuksessa, jossa käytettiin moksifloksasiinia 40 terveellä koehenkilöllä Onglyzaan ei liittynyt QTc-ajan tai sykkeen kliinisesti merkittävää pidentymistä päivittäisillä annoksilla, jotka olivat korkeintaan 40 mg (8 kertaa MRDH: hon).
farmakokinetiikkaa
Saksagliptiinin ja sen aktiivisen metaboliitin, 5-hydroksisaksagliptiinin, farmakokinetiikka oli samanlainen terveillä koehenkilöillä ja potilailla, joilla oli tyypin 2 diabetes mellitus. Cmax Saksagliptiinin ja sen aktiivisen metaboliitin AUC-arvot nousivat suhteellisesti annosalueella 2,5 - 400 mg. Saatuaan 5 mg: n kerta-annoksen saksagliptiinia terveille henkilöille, saksagliptiinin ja sen aktiivisen metaboliitin keskimääräiset AUC-arvot olivat vastaavasti 78 ng-h / ml ja 214 ng-h / ml. Vastaava plasma Cmax arvot olivat vastaavasti 24 ng / ml ja 47 ng / ml. Keskimääräinen variaatio (% CV) AUC: lle ja C: llemax sekä saksagliptiinilla että sen aktiivisella metaboliitilla oli alle 25%.
Saksagliptiinin tai sen aktiivisen metaboliitin kertymistä ei havaittu toistuvasti annettaessa kerran päivässä millään annostasolla. Saksagliptiinin ja sen aktiivisen metaboliitin puhdistumassa ei havaittu annos- ja aikariippuvuutta 14 päivän ajan kerran päivässä annettaessa saksagliptiinia annoksilla, jotka vaihtelivat välillä 2,5 - 400 mg.
imeytyminen
Keskimääräinen aika maksimipitoisuuteen (Tmax) 5 mg: n kerran päivässä antamisen jälkeen oli 2 tuntia saksagliptiinille ja 4 tuntia sen aktiiviselle metaboliitille. Anto rasvaisen aterian yhteydessä johti T-arvon nousuunmax saksagliptiinia noin 20 minuuttia paasto-olosuhteisiin verrattuna. Saksagliptiinin AUC kasvoi 27%, kun sitä annettiin aterian yhteydessä paasto-olosuhteisiin verrattuna. Onglyza voidaan antaa ruuan kanssa tai ilman.
Jakelu
Saksagliptiinin ja sen aktiivisen metaboliitin sitoutuminen ihmisen seerumiin in vitro -proteiineilla on vähäistä. Siksi veren proteiinitasojen muutosten eri sairaustiloissa (esim. Munuaisten tai maksan vajaatoiminta) ei odoteta muuttavan saksagliptiinin sijoitusta.
aineenvaihdunta
Saksagliptiinin metaboliaa välittää pääasiassa sytokromi P450 3A4 / 5 (CYP3A4 / 5). Saksagliptiinin tärkein metaboliitti on myös DPP4-estäjä, joka on puoli yhtä voimakas kuin saksagliptiini. Siksi vahvat CYP3A4 / 5-estäjät ja indusoijat muuttavat saksagliptiinin ja sen aktiivisen metaboliitin farmakokinetiikkaa. [See Lääkkeiden yhteisvaikutukset.]
eritys
Saksagliptiini eliminoituu sekä munuaisten että maksan kautta. Yhden 50 mg: n annoksen jälkeen 14C-saksagliptiini, 24%, 36% ja 75% annoksesta erittyi virtsaan saksagliptiinina, sen aktiivisena metaboliittina ja kokonaisradioaktiivisuutena. Saksagliptiinin keskimääräinen munuaispuhdistuma (~ 230 ml / min) oli suurempi kuin keskimääräinen arvioitu glomerulusten suodattumisnopeus (~ 120 ml / min), mikä viittaa jonkin verran aktiiviseen erittymiseen munuaisten kautta. Kaikkiaan 22% annetusta radioaktiivisuudesta otettiin talteen ulosteeseen, joka edustaa sitä osaa saksagliptiiniannoksesta, joka erittyy sappeen ja / tai imeytymättömään lääkkeeseen maha-suolikanavasta. Yhden kerta-annoksen Onglyza-annoksen ollessa 5 mg terveille koehenkilöille, plasman keskimääräinen puoliintumisaika (t1/2) saksagliptiinille ja sen aktiiviselle metaboliitille oli vastaavasti 2,5 ja 3,1 tuntia.
Erityiset populaatiot
Munuaisten vajaatoiminta
Suoritettiin yhden annoksen avoin tutkimus, jonka tarkoituksena oli arvioida saksagliptiinin (10 mg: n annos) farmakokinetiikkaa koehenkilöt, joilla on eri astetta kroonista munuaisten vajaatoimintaa (N = 8 ryhmää kohti) verrattuna kohteisiin, joilla munuaisten toiminta on normaalia toimia. Tutkimukseen osallistui munuaisten vajaatoimintaa sairastavia potilaita, jotka luokiteltiin kreatiniinipuhdistuman perusteella lieväksi (> 50 - â ¤ 80) ml / min), keskivaikea (30–50 μl / min) ja vaikea (<30 ml / min) sekä potilaat, joilla on loppuvaiheen munuaissairaus hemodialyysillä. Kreatiniinipuhdistuma arvioitiin seerumin kreatiniinista Cockcroft-Gault-kaavan perusteella:
CrCl = [140 - ikä (vuotta)] - paino (kg) {- 0,85 naispotilaille}
[72 ser seerumin kreatiniini (mg / dL)]
Munuaisten vajaatoiminnan aste ei vaikuttanut C: henmax saksagliptiinia tai sen aktiivista metaboliittia. Potilailla, joilla oli lievä munuaisten vajaatoiminta, saksagliptiinin ja sen aktiivisen metaboliitin AUC-arvot olivat vastaavasti 20% ja 70% suuremmat kuin potilailla, joilla oli normaali munuaisten toiminta. Koska tämän suuruuden nousua ei pidetä kliinisesti merkityksellisenä, annoksen muuttamista ei suositella potilaille, joilla on lievä munuaisten vajaatoiminta. Potilailla, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta, saksagliptiinin ja sen aktiivisen AUC-arvot metaboliitti oli jopa 2,1- ja 4,5-kertaisesti korkeampi kuin AUC-arvot potilailla, joilla oli normaali munuaiset toimia. Saksagliptiinin ja sen aktiivisen metaboliitin plasmaaltistuksen saavuttamiseksi samanlainen kuin potilailla, joilla on normaali munuaisten toiminta, suositeltu annos on 2,5 mg kerran päivässä potilailla, joilla on kohtalainen ja vaikea munuaisten vajaatoiminta, samoin kuin potilailla, joilla on loppuvaiheen munuaissairaus hemodialyysillä. Saksagliptiini poistetaan hemodialyysillä.
Maksan vajaatoiminta
Maksan vajaatoiminnasta kärsivillä (Child-Pugh-luokka A, B ja C) keskiarvo Cmax Saksagliptiinin AUC oli jopa 8% ja 77% korkeampi verrattuna terveisiin vastaaviin kontrolleihin saksagliptiinin yksittäisen 10 mg: n annoksen antamisen jälkeen. Vastaava Cmax Aktiivisen metaboliitin AUC oli jopa 59% ja 33% alhaisempi kuin terveillä, vastaavilla kontrolleilla. Näiden erojen ei katsota olevan kliinisesti merkityksellisiä. Annoksen muuttamista ei suositella potilaille, joilla on maksan vajaatoiminta.
Painoindeksi
Annoksen muuttamista ei suositella painon perusteella (BMI), jota ei tunnistettu merkitseväksi muuttujat saksagliptiinin tai sen aktiivisen metaboliitin näennäisestä puhdistumisesta populaation farmakokinetiikassa analyysi.
sukupuoli
Annoksen muuttamista ei suositella sukupuolen perusteella. Saksagliptiinin farmakokinetiikassa ei havaittu eroja miesten ja naisten välillä. Naisilla oli noin 25% korkeammat aktiivisen metaboliitin altistumisarvot kuin miehillä, mutta tällä erolla ei todennäköisesti ole kliinistä merkitystä. Sukupuolta ei tunnistettu merkittävänä muuttujana saksagliptiinin ja sen aktiivisen metaboliitin näennäisestä puhdistumisesta populaation farmakokinetiikkaanalyysissä.
geriatrinen
Annoksen muuttamista ei suositella pelkästään iän perusteella. Iäkkäillä koehenkilöillä (65–80-vuotiailla) oli geometrinen keskimääräinen C 23% ja 59% korkeampimax saksagliptiinin AUC-arvot ja geometriset keskimääräiset AUC-arvot vastaavasti kuin nuorilla (18–40-vuotiailla). Ero aktiivisten metaboliittien farmakokinetiikassa iäkkäiden ja nuorten henkilöiden välillä heijastaa yleensä saksagliptiinin farmakokinetiikassa havaittuja eroja. Saksagliptiinin ja aktiivisen metaboliitin farmakokinetiikan välinen ero nuorilla ja vanhuksilla koehenkilöt johtuvat todennäköisesti useista tekijöistä, mukaan lukien heikentynyt munuaisten toiminta ja metabolinen kapasiteetti ikän lisääntyminen. Ikää ei tunnistettu merkittävänä muuttujana saksagliptiinin ja sen aktiivisen metaboliitin näennäisestä puhdistumisesta populaation farmakokinetiikkaanalyysissä
pediatrinen
Saksagliptiinin farmakokinetiikkaa karakterisoivia tutkimuksia lapsilla ei ole tehty.
Rotu ja etnisyys
Annoksen muuttamista ei suositella rodun perusteella. Populaatiofarmakokineettisessä analyysissä verrattiin saksagliptiinin ja sen aktiivisen farmakokinetiikkaa metaboliitti 309 valkoihoisessa henkilössä, joissa oli 105 muuta kuin valkoihoista henkilöä (koostuu kuudesta rodusta ryhmät). Näiden kahden populaation välillä ei havaittu merkittävää eroa saksagliptiinin ja sen aktiivisen metaboliitin farmakokinetiikassa.
Huumeiden ja lääkkeiden yhteisvaikutukset
Lääkkeiden yhteisvaikutusten arviointi in vitro
Saksagliptiinin metaboliaa välittää pääasiassa CYP3A4 / 5.
In vitro -tutkimuksissa saksagliptiini ja sen aktiivinen metaboliitti eivät estäneet CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 tai 3A4 tai indusoineet CYP1A2, 2B6, 2C9 tai 3A4. Siksi saksagliptiinin ei odoteta muuttavan näiden entsyymien metaboloimien samanaikaisesti annettavien lääkkeiden metabolista puhdistumaa. Saksagliptiini on P-glykoproteiini (P-gp) -substraatti, mutta se ei ole merkittävä P-gp: n estäjä tai indusoija.
Saksagliptiinin ja sen aktiivisen metaboliitin sitoutuminen ihmisen seerumiin in vitro -proteiineilla on vähäistä. Siten proteiinien sitoutumisella ei olisi merkityksellistä vaikutusta saksagliptiinin tai muiden lääkkeiden farmakokinetiikkaan.
Lääkkeiden yhteisvaikutusten arviointi in vivo
Saksagliptiinin vaikutukset muihin lääkkeisiin
Terveillä koehenkilöillä, kuten alla kuvataan, tehdyissä tutkimuksissa saksagliptiini ei muuttanut merkitsevästi metformiinin, glyburidin, pioglitatsonin, digoksiinin, simvastatiinin, diltiatseemin tai ketokonatsolin farmakokinetiikka.
Metformiini: Saksagliptiinin (100 mg) ja metformiinin (1000 mg), joka on hOCT-2-substraatti, kerta-annoksen samanaikainen käyttö ei muuttanut metformiinin farmakokinetiikkaa terveillä koehenkilöillä. Siksi Onglyza ei ole hOCT-2-välitteisen kuljetuksen estäjä.
Glyburidi: Saksagliptiinin (10 mg) ja glyburidin (5 mg), CYP2C9-substraatin, kerta-annoksen samanaikainen käyttö lisäsi plasman Cmax glyburidia 16%; glyburidin AUC oli kuitenkin muuttumaton. Siksi Onglyza ei estä merkityksellisesti CYP2C9-välitteistä metaboliaa.
Pioglitatsoni: Useiden kerran päivässä annettavien saksagliptiinin (10 mg) ja pioglitatsonin (45 mg), joka on CYP2C8-substraatti, samanaikainen käyttö nosti plasman Cmax pioglitatsonia 14%; pioglitatsonin AUC oli kuitenkin muuttumaton.
Digoksiini: P-gp-substraatin saksagliptiinin (10 mg) ja digoksiinin (0,25 mg) useiden kerran päivässä annosten samanaikainen käyttö ei muuttanut digoksiinin farmakokinetiikkaa. Siksi Onglyza ei ole P-gp-välitteisen kuljetuksen estäjä tai indusoija.
Simvastatiini: Useiden kerran päivässä annettavien saksagliptiinin (10 mg) ja simvastatiinin (40 mg), CYP3A4 / 5-substraatin, samanaikainen käyttö ei muuttanut simvastatiinin farmakokinetiikkaa. Siksi Onglyza ei ole CYP3A4 / 5-välitteisen metabolian estäjä tai indusoija.
Diltiatseemi: Useiden kerran päivässä annettavien saksagliptiinin (10 mg) ja diltiatseemin (360 mg pitkävaikutteinen formulaatio vakaassa tilassa), kohtalaisen CYP3A4 / 5: n estäjä, kohonnut plasma Cmax diltiatseemia 16%; diltiatseemin AUC oli kuitenkin muuttumaton.
Ketokonatsoli: Kertakonatsolin kerta-annoksen (100 mg) ja ketokonatsoliannoksen (200 mg 12 tunnin välein) samanaikainen käyttö vakaa tila), vahva CYP3A4 / 5: n ja P-gp: n estäjä, laski ketokonatsolin Cmax- ja AUC-arvoa plasmassa 16% ja 13%, vastaavasti.
Muiden lääkkeiden vaikutukset saksagliptiiniin
Metformiini: Saxagliptiinin (100 mg) ja metformiinin (1000 mg), joka on hOCT-2-substraatti, kerta-annoksen anto laski Cmax saksagliptiinia 21%; AUC oli kuitenkin muuttumaton.
Glyburidi: Saksagliptiinin (10 mg) ja glyburidin (5 mg), CYP2C9-substraatin, kerta-annoksen samanaikainen käyttö lisäsi Cmax saksagliptiinia 8%; saksagliptiinin AUC oli kuitenkin muuttumaton.
Pioglitatsoni: Saksagliptiinin (10 mg) ja pioglitatsonin useiden kerran päivässä annosten samanaikainen käyttö (45 mg), CYP2C8 (pää) ja CYP3A4 (pieni) substraatti, eivät muuttaneet farmakokinetiikkaa saksagliptiinitutkimuksissa.
Digoksiini: Useiden kerran päivässä annettavien saksagliptiinin (10 mg) ja digoksiinin (0,25 mg), P-gp-substraatin, samanaikainen käyttö ei muuttanut saksagliptiinin farmakokinetiikkaa.
Simvastatiini: Useiden kerran päivässä annettavien saksagliptiinin (10 mg) ja simvastatiinin (40 mg), CYP3A4 / 5-substraatin, samanaikainen käyttö nosti Cmax saksagliptiinia 21%; saksagliptiinin AUC oli kuitenkin muuttumaton.
Diltiatseemi: Saksagliptiinin (10 mg) ja diltiatseemin (360 mg pitkävaikutteinen formulaatio vakaassa tilassa), keskivaikea CYP3A4 / 5-estäjä, samanaikainen anto nosti Cmax saksagliptiinia 63% ja AUC 2,1-kertaisesti. Tämä liittyi vastaavaan C: n laskuunmax ja aktiivisen metaboliitin AUC 44% ja 36%.
Ketokonatsoli: Saksagliptiinin (100 mg) ja ketokonatsolin (200 mg joka 12 tunti vakaassa tilassa), joka on voimakas CYP3A4 / 5: n ja P-gp: n estäjä, samanaikainen anto nosti Cmax saksagliptiinille 62% ja AUC 2,5-kertaiseksi. Tämä liittyi vastaavaan C: n laskuunmax ja aktiivisen metaboliitin AUC 95% ja 91%.
Eräässä toisessa tutkimuksessa saksagliptiinin (20 mg) ja ketokonatsolin (200 mg joka 12. tunti vakaassa tilassa) kerta-annoksen samanaikainen käyttö lisäsi Cmax Saksagliptiinin AUC ja AUC 2,4-kertaisesti ja 3,7-kertaisesti. Tämä liittyi vastaavaan C: n laskuunmax ja aktiivisen metaboliitin AUC 96% ja 90%.
Rifampiini: Saksagliptiinin (5 mg) ja rifampiinin (600 mg QD vakaan tilan) kerta-annoksen samanaikainen käyttö laski Cmax Saksagliptiinin AUC oli 53% ja 76%, vastaavasti C: n nousun kanssamax (39%), mutta ei merkittävää muutosta aktiivisen metaboliitin plasma-AUC: ssa.
Omepratsoli: Useiden kerran päivässä annettavien saksagliptiinin (10 mg) ja omepratsolin (40 mg), CYP2C19, annostelu (pääosa) ja CYP3A4-substraatti, CYP2C19: n estäjä ja MRP-3: n indusoija, eivät muuttaneet saksagliptiinitutkimuksissa.
Alumiinihydroksidi + magnesiumhydroksidi + simetikoni: saksagliptiinin (10 mg) kerta-annoksen ja neste, joka sisälsi alumiinihydroksidia (2400 mg), magnesiumhydroksidia (2400 mg) ja simetikonia (240 mg) alensi Cmax saksagliptiinia 26%; saksagliptiinin AUC oli kuitenkin muuttumaton.
Famotidiini: Yksittäisen saksagliptiiniannoksen (10 mg) antaminen 3 tunnin kuluttua yhdestä annoksesta famotidiinia (40 mg), joka on hOCT-1: n, hOCT-2: n ja hOCT-3: n estäjä, lisäsi Cmax saksagliptiinia 14%; saksagliptiinin AUC oli kuitenkin muuttumaton.
ylin
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Saksagliptiini ei indusoinut kasvaimia hiirillä (50, 250 ja 600 mg / kg) tai rotilla (25, 75, 150 ja 300 mg / kg) korkeimmissa arvioiduissa annoksissa. Suurimmat hiirillä arvioidut annokset vastasivat noin 870 (miehet) ja 1165 (naaraat) kertaa ihmisen altistumista MRHD: llä 5 mg / päivä. Rotilla altistuminen oli noin 355 (urokset) ja 2217 (naaraat) kertaa MRHD.
Saksagliptiini ei ollut mutageeninen tai klastogeeninen aineenvaihdunnan kanssa tai ilman sitä in vitro Ames -bakteerimäärityksessä, in vitro sytogenetiikkamäärityksessä ihmisellä lymfosyytit, in vivo oraalisen mikrotumamääritys rotilla, in vivo oraalisen DNA: n korjauskoe rotilla ja oraalisen in vivo / in vitro sytogenetiikkatutkimus rotan ääreisveressä lymfosyytit. Aktiivinen metaboliitti ei ollut mutageeninen Ames-bakteerimäärityksessä in vitro.
Rotan hedelmällisyystutkimuksessa miehiä hoidettiin suun kautta annettavilla annosannoksilla 2 viikkoa ennen parittelua, pariutumisen aikana ja suunniteltuun päivään saakka lopetus (yhteensä noin 4 viikkoa) ja naaraita hoidettiin suun kautta annettavilla annosannoksilla 2 viikon ajan ennen parittelua raskauden aikana päivä 7. Haitallisia vaikutuksia hedelmällisyyteen ei havaittu altistuksilla, jotka olivat noin 603 (miehet) ja 776 (naiset) kertaa MRHD. Suuremmat annokset, jotka aiheuttivat äidin toksisuutta, lisäsivät myös sikiön resorptioita (noin 2069 ja 6138 kertaa MRHD). Lisävaikutuksia estroosiseen pyöräilyyn, hedelmällisyyteen, ovulaatioon ja implantoitumiseen havaittiin suunnilleen 6138 kertaa MRHD.
Eläinten toksikologia
Saksagliptiini aiheutti haitallisia ihomuutoksia cynomolgus-apinoiden raajoissa (rypäleet ja / tai hännän, numeroiden, kivespussin ja / tai nenän haavaumat). Ihovauriot olivat palautuvia ainakin 20-kertaisessa MRHD-arvosta, mutta joissakin tapauksissa ne olivat peruuttamattomia ja nekrotisoivia suuremmilla altistuksilla. Haitallisia ihomuutoksia ei havaittu altistuksilla, jotka olivat samanlaisia (1 - 3 kertaa) 5 mg: n MRHD: n kanssa. Saksagliptiinin kliinisissä tutkimuksissa ihmisillä ei ole havaittu kliinisiä korrelaatioita apinoiden ihovaurioihin.
ylin
Kliiniset tutkimukset
Onglyzaa on tutkittu monoterapiana ja yhdistelmänä metformiinin, glyburidin ja tiatsolidiinidionin (pioglitatsoni ja rosiglitatsoni) kanssa. Onglyzaa ei ole tutkittu yhdessä insuliinin kanssa.
Kaikkiaan 4148 tyypin 2 diabetes mellitusta sairastavaa potilasta satunnaistettiin kuuteen kaksoissokkoutetussa kontrolloidussa kliinisessä tutkimuksessa, joka tehtiin Onglyzan turvallisuuden ja glykeemisen tehon arvioimiseksi. Näissä tutkimuksissa yhteensä 3021 potilasta hoidettiin Onglyzalla. Näissä tutkimuksissa keskimääräinen ikä oli 54 vuotta ja 71% potilaista oli valkoihoisia, 16% aasialaisia, 4% mustia ja 9% muita rodun ryhmiä. Lisäksi 423 potilasta, mukaan lukien 315, jotka saivat Onglyzaa, osallistui lumelääkekontrolloituun, annosta muuttavaan tutkimukseen, jonka kesto oli 6–12 viikkoa.
Näissä kuudessa kaksoissokkotutkimuksessa Onglyzaa arvioitiin annoksina 2,5 mg ja 5 mg kerran päivässä. Kolmessa näistä tutkimuksista arvioitiin myös 10 mg: n saksagliptiiniannos päivässä. 10 mg: n päivittäinen saksagliptiiniannos ei antanut suurempaa tehokkuutta kuin 5 mg: n vuorokausiannos. Onglyza-hoito kaikilla annoksilla tuotti kliinisesti merkitseviä ja tilastollisesti merkitseviä parannuksia hemoglobiini A1c: n (A1C), paastonneen plasman glukoosiarvo (FPG) ja 2 tunnin ruokavalion jälkeinen glukoosi (PPG) tavanomaisen oraalisen glukoositoleranssikokeen (OGTT) jälkeen verrattuna kontrolli. A1C-arvon laskua havaittiin alaryhmissä, mukaan lukien sukupuoli, ikä, rodut ja lähtötason painoindeksi.
Onglyzaan ei liittynyt merkittäviä muutoksia lähtöpainoon nähden kehon painossa tai paastonneissa seerumin lipideissä verrattuna lumelääkkeeseen.
monoterapia
Yhteensä 766 tyypin 2 diabetestä sairastavaa potilasta, joiden ruokavalion ja liikunnan valvonta oli riittämätöntä (A1C - 7% –10%) osallistui kahteen 24 viikon kaksoissokkotutkimukseen, lumekontrolloituun tutkimukseen, joissa arvioitiin Onglyzan tehoa ja turvallisuutta ainoana lääkkeenä.
Ensimmäisessä tutkimuksessa 2 viikon yhden sokean ruokavalion, liikunnan ja lumelääkehoitoajanjakson jälkeen 401 potilasta satunnaistettiin antamaan 2,5 mg, 5 mg tai 10 mg Onglyzaa tai lumelääkettä. Potilaita, jotka eivät saavuttaneet spesifisiä glykeemisiä tavoitteita tutkimuksen aikana, hoidettiin pelastamishoidolla metformiinilla, jota lisättiin lumelääkkeeseen tai Onglyzaan. Tehokkuutta arvioitiin viimeisessä mittauksessa ennen pelastushoitoa pelastamista tarvitseville potilaille. Onglyzan annoksen titraaminen ei ollut sallittua.
Hoito Onglyza 2,5 mg: lla ja 5 mg: lla päivittäin antoi merkittäviä parannuksia A1C: ssä, FPG: ssä ja PPG: ssä verrattuna lumelääkkeeseen (taulukko 3). Niiden potilaiden prosenttiosuus, jotka lopettivat hoidon glykeemisen valvonnan puutteen vuoksi tai jotka pelastettiin ennalta määrätyn tapaamisen vuoksi glykeemiset kriteerit olivat 16% Onglyza 2,5 mg: n hoitoryhmässä, 20% Onglyza 5 mg: n hoitoryhmässä ja 26% lumelääkeryhmä.
Taulukko 3: Glykeemiset parametrit viikolla 24 placebo-kontrolloidussa tutkimuksessa Onglyza-monoterapiasta tyypin 2 diabeetikoilla *
| Tehokkuusparametri | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
Plasebo N = 95 |
|---|---|---|---|
| * Tavoitteena hoidettava väestö, joka käyttää viimeistä tutkimusta tai viimeistä havaintoa ennen metformiinipelastushoitoa pelastamista tarvitseville potilaille. | |||
| †Pienimmän neliösumman keskiarvo mukautettu perusarvoon. | |||
| C p-arvo <0,0001 verrattuna lumelääkkeeseen | |||
| § p-arvo <0,05 verrattuna lumelääkkeeseen | |||
| ¶ Merkitystä ei testattu 2 tunnin PPG: llä 2,5 mg: n Onglyza-annoksella. | |||
| Hemoglobiini A1C (%) | N = 100 | N = 103 | N = 92 |
| Perustaso (keskiarvo) | 7.9 | 8.0 | 7.9 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −0.4 | −0.5 | +0.2 |
| Ero lumelääkkeeseen (oikaistu keskiarvo)†) | −0.6C | −0.6C | |
| 95% luottamusväli | (−0.9, −0.3) | (−0.9, −0.4) | |
| Prosentti potilaista, joilla saavutetaan A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Paasto-plasmaglukoosi (mg / dL) | N = 101 | N = 105 | N = 92 |
| Perustaso (keskiarvo) | 178 | 171 | 172 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −15 | −9 | +6 |
| Ero lumelääkkeeseen (oikaistu keskiarvo)†) | −21 § | −15 § | |
| 95% luottamusväli | (−31, −10) | (−25, −4) | |
| 2 tunnin postprandiaalinen glukoosi (mg / dL) | N = 78 | N = 84 | N = 71 |
| Perustaso (keskiarvo) | 279 | 278 | 283 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −45 | −43 | −6 |
| Ero lumelääkkeeseen (oikaistu keskiarvo)†) | −39 ¶ | −37 § | |
| 95% luottamusväli | (−61, −16) | (−59, −15) |
Toinen 24 viikon monoterapiakoe suoritettiin Onglyzan annosteluohjelmien arvioimiseksi. Hoitamattomat potilaat, joilla oli riittämättömästi hallittu diabetes (A1C - 7–10%), saivat 2 viikon yhden sokean ruokavalion, liikunnan ja lumelääkehoitoajan. Kaikkiaan 365 potilasta satunnaistettiin 2,5 mg: aan joka aamu, 5 mg: aan joka aamu, 2,5 mg: aan mahdollisen titrauksen avulla 5 mg: aan joka aamu tai 5 mg: aan joka ilta Onglyzaa tai lumelääkettä. Potilaita, jotka eivät saavuttaneet spesifisiä glykeemisiä tavoitteita tutkimuksen aikana, hoidettiin metformiinin pelastushoidolla, joka lisättiin lumelääkkeeseen tai Onglyzaan; satunnaistettujen potilaiden lukumäärä hoitoryhmää kohden oli 71 - 74.
Hoito joko Onglyza 5 mg: lla joka aamu tai 5 mg: lla joka ilta tuotti merkittäviä parannuksia A1C: ssä verrattuna lumelääkkeeseen (keskimääräiset lumelääkekorjatut laskut vastaavasti 0,4% ja 0,3%). Hoito 2,5 mg: lla Onglyzaa joka aamu tuotti myös merkittävän paranemisen A1C: ssä verrattuna lumelääkkeeseen (keskimääräinen lumelääkekorjattu lasku 0,4%).
Yhdistelmähoito
Lisäyhdistelmähoito metformiinilla
Yhteensä 743 tyypin 2 diabetestä sairastavaa potilasta osallistui tähän 24 viikon satunnaistettuun, kaksoissokkoutettuun, plasebokontrolloituun tutkimukseen Onglyzan tehokkuus ja turvallisuus yhdessä metformiinin kanssa potilailla, joilla glykeeminen kontrolli on riittämätöntä (A1C â ‰% 7% ja â ¤ 10%) metformiinilla yksin. Ilmoittautumiseen pääsemiseksi potilaiden piti saada stabiilia metformiiniannosta (1500-2550 mg vuorokaudessa) vähintään 8 viikon ajan.
Potilaat, jotka täyttivät kelpoisuusvaatimukset, otettiin mukaan yhden sokean, 2 viikon ruokavalion ja liikunnan lumelääkehoitoon. ajanjakso, jonka aikana potilaat saivat metformiinia tutkimusta edeltäneellä annoksellaan, korkeintaan 2500 mg vuorokaudessa, koko ajan opiskella. Johdantojakson jälkeen hyväksyttävät potilaat satunnaistettiin saamaan 2,5 mg, 5 mg tai 10 mg Onglyzaa tai lumelääkettä nykyisen avoimen metformiini-annoksensa lisäksi. Potilaita, jotka eivät saavuttaneet tiettyjä glykeemisiä tavoitteita tutkimuksen aikana, hoidettiin pioglitatsoni-pelastushoidolla, jota lisättiin olemassa oleviin tutkimuslääkkeisiin. Onglyzan ja metformiinin annosten titraaminen ei ollut sallittua.
Onglyzan 2,5 mg ja 5 mg lisäys meformiiniin antoi merkittäviä parannuksia A1C: ssä, FPG: ssä ja PPG: ssä verrattuna lumelääkelisäykseen metformiiniin (taulukko 4). Keskimääräiset muutokset lähtötasosta A1C: n suhteen ajan kuluessa ja päätepisteessä esitetään kuvassa 1. Niiden potilaiden osuus, jotka lopettivat hoidon glykeemisen valvonnan puutteen vuoksi tai jotka pelastettiin noudattamaan ennalta määriteltyjä glykeemisiä kriteerejä, oli 15% Onglyza 2,5 mg -lisäosassa metformiiniryhmään, 13% Onglyza 5 mg -lisäosassa metformiiniryhmään ja 27% lumelääkelisäosassa metformiinille ryhmä.
Taulukko 4: glykeemiset parametrit viikolla 24 plasebokontrolloidussa Onglyzan tutkimuksessa metformiinin lisäyhdistelmähoidona *
| Tehokkuusparametri | Onglyza 2,5 mg + metformiini N = 192 |
Onglyza 5 mg + metformiini N = 191 |
Plasebo + metformiini N = 179 |
|---|---|---|---|
| * Hoito-aikomuspotilaat, jotka käyttävät viimeistä tutkimusta tai viimeistä havaintoa ennen pioglitatsoni-pelastushoitoa pelastamista tarvitseville potilaille. | |||
| †Pienimmän neliösumman keskiarvo mukautettu perusarvoon. | |||
| C p-arvo <0,0001 verrattuna lumelääkkeeseen + metformiiniin | |||
| § p-arvo <0,05 verrattuna lumelääkkeeseen + metformiiniin | |||
| Hemoglobiini A1C (%) | N = 186 | N = 186 | N = 175 |
| Perustaso (keskiarvo) | 8.1 | 8.1 | 8.1 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −0.6 | −0.7 | +0.1 |
| Ero lumelääkkeeseen (oikaistu keskiarvo)†) | −0.7C | −0.8C | |
| 95% luottamusväli | (−0.9, −0.5) | (−1.0, −0.6) | |
| Prosentti potilaista, joilla saavutetaan A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Paasto-plasmaglukoosi (mg / dL) | N = 188 | N = 187 | N = 176 |
| Perustaso (keskiarvo) | 174 | 179 | 175 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −14 | −22 | +1 |
| Ero lumelääkkeeseen (oikaistu keskiarvo)†) | −16 § | −23 § | |
| 95% luottamusväli | (−23, −9) | (−30, −16) | |
| 2 tunnin postprandiaalinen glukoosi (mg / dL) | N = 155 | N = 155 | N = 135 |
| Perustaso (keskiarvo) | 294 | 296 | 295 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −62 | −58 | −18 |
| Ero lumelääkkeeseen (oikaistu keskiarvo)†) | −44 § | −40 § | |
| 95% luottamusväli | (−60, −27) | (−56, −24) |
Kuva 1: Keskimääräinen muutos lähtötasosta A1C: ssä plasebokontrolloidussa Onglyzan tutkimuksessa lisäyhdistelmähoitona metformiinilla *
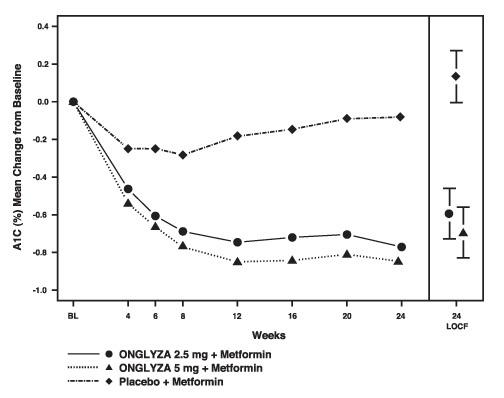
* Sisältää potilaat, joiden lähtötaso ja viikon 24 arvo ovat.
Viikko 24 (LOCF) sisältää hoidettavan väestön, joka käyttää viimeistä tutkimusta ennen pioglitatsoni-pelastushoitoa pelastusta tarvitsevilla potilailla. Keskimääräinen muutos lähtötasosta mukautetaan perusarvoon.
Lisäyhdistelmähoito tiatsolidiinidionilla
Yhteensä 565 tyypin 2 diabetestä sairastavaa potilasta osallistui tähän 24 viikon satunnaistettuun, kaksoissokkoutettuun, lumelääkekontrolloituun tutkimukseen Onglyza-valmisteen tehokkuus ja turvallisuus yhdessä tiatsolidiinidionin (TZD) kanssa potilailla, joilla glykeeminen kontrolli on riittämätön (A1C - 7% –10,5%) Pelkästään TZD. Ilmoittautumiseen pääsemiseksi potilaiden piti saada stabiilia annosta pioglitatsonia (30-45 mg kerran päivässä). tai rosiglitatsonia (4 mg kerran päivässä tai 8 mg joko kerran päivässä tai kahtena jaettuna 4 mg: n annoksena) vähintään 12 viikkoa.
Potilaat, jotka täyttivät kelpoisuusvaatimukset, otettiin mukaan yhden sokean, 2 viikon ruokavalioon ja liikuntaan lumelääkehoitoajanjakso, jonka aikana potilaat saivat TZD: tä tutkimusajanjaksolla edeltäneellä annoksellaan opiskella. Johdantojakson jälkeen hyväksyttävät potilaat satunnaistettiin saamaan 2,5 mg tai 5 mg Onglyzaa tai lumelääkettä nykyisen TZD-annoksensa lisäksi. Potilaita, jotka eivät saavuttaneet tiettyjä glykeemisiä tavoitteita tutkimuksen aikana, hoidettiin metformiinin pelastamisella, jota lisättiin olemassa oleviin tutkimuslääkkeisiin. Onglyzan tai TZD: n annosten titraaminen ei ollut sallittua tutkimuksen aikana. Muutos TZD-hoidossa rosiglitatsonista pioglitatsoniksi määritellyillä, vastaavilla terapeuttisilla annoksilla sallittiin tutkijan harkinnan mukaan, jos sen uskotaan olevan lääketieteellisesti tarkoituksenmukaista.
Onglyza 2,5 mg: n ja 5 mg: n lisäys TZD: hen antoi merkittäviä parannuksia A1C: ssä, FPG: ssä ja PPG: ssä verrattuna lumelääkelisäykseen TZD: hen (taulukko 5). Niiden potilaiden osuus, jotka lopettivat hoidon glykeemisen valvonnan puutteen vuoksi tai jotka pelastettiin noudattamaan ennalta määriteltyjä glykeemisiä kriteerejä oli 10% Onglyza 2,5 mg -lisäosassa TZD-ryhmässä, 6% Onglyza 5 mg -lisäosassa TZD-ryhmässä ja 10% lumelääkelisäosassa TZD-ryhmään ryhmä.
Taulukko 5: Glykeemiset parametrit viikolla 24 plasebokontrolloidussa Onglyzan tutkimuksessa tiatsolidiinidionin yhdistelmähoitona *
| Tehokkuusparametri | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
Plasebo + TZD N = 184 |
|---|---|---|---|
| * Tavoitteena hoidettava väestö, joka käyttää viimeistä tutkimusta tai viimeistä havaintoa ennen metformiinipelastushoitoa pelastamista tarvitseville potilaille. | |||
| †Pienimmän neliösumman keskiarvo mukautettu perusarvoon. | |||
| C p-arvo <0,0001 verrattuna plaseboon + TZD | |||
| § p-arvo <0,05 verrattuna lumelääkkeeseen + TZD: hen | |||
| Hemoglobiini A1C (%) | N = 192 | N = 183 | N = 180 |
| Perustaso (keskiarvo) | 8.3 | 8.4 | 8.2 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −0.7 | −0.9 | −0.3 |
| Ero lumelääkkeeseen (oikaistu keskiarvo)†) | −0.4 § | −0.6C | |
| 95% luottamusväli | (−0.6, −0.2) | (−0.8, −0.4) | |
| Prosentti potilaista, joilla saavutetaan A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Paasto-plasmaglukoosi (mg / dL) | N = 193 | N = 185 | N = 181 |
| Perustaso (keskiarvo) | 163 | 160 | 162 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −14 | −17 | −3 |
| Ero lumelääkkeeseen (oikaistu keskiarvo)†) | −12 § | −15 § | |
| 95% luottamusväli | (−20, −3) | (−23, −6) | |
| 2 tunnin postprandiaalinen glukoosi (mg / dL) | N = 156 | N = 134 | N = 127 |
| Perustaso (keskiarvo) | 296 | 303 | 291 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −55 | −65 | −15 |
| Ero lumelääkkeeseen (oikaistu keskiarvo)†) | −40 § | −50 § | |
| 95% luottamusväli | (−56, −24) | (−66, −34) |
Lisäyhdistelmähoito Glyburidilla
Yhteensä 768 tyypin 2 diabetestä sairastavaa potilasta osallistui tähän 24 viikon satunnaistettuun, kaksoissokkoutettuun, plasebokontrolloituun tutkimukseen tehon ja turvallisuuden arvioimiseksi. Onglyza-annoksesta yhdessä sulfonyyliurean (SU) kanssa potilailla, joilla glykeeminen hallinta on riittämätöntä ilmoittautumishetkellä (A1C - 7,5% –10% 10%) submaksimaalisen SU-annoksen kanssa yksin. Ilmoittautumiseen pääsemiseksi potilaiden piti saada submaksimaalinen SU-annos vähintään 2 kuukautta. Tässä tutkimuksessa Onglyzaa yhdessä kiinteän, keskimääräisen SU-annoksen kanssa verrattiin titraukseen suurempaan SU-annokseen.
Potilaat, jotka täyttivät kelpoisuusvaatimukset, otettiin mukaan yhden sokean, 4 viikon ruokavalion ja liikunnan aloitusjaksoon, ja heille annettiin 7,5 mg glyburidia kerran päivässä. Johdantokauden jälkeen hyväksyttävät potilaat, joilla A1C: n osuus oli œ 7–10%, satunnaistettiin joko 2,5: ksi mg tai 5 mg Onglyza-lisäainetta 7,5 mg: n glyburidille tai lumelääkkeelle plus 10 mg: n päivittäinen kokonaisannos glyburide. Lumelääkettä saaneet potilaat olivat oikeutettuja saamaan glyburidin titrauksen kokonaispäiväannokseen 15 mg. Glyburidin titrauksen lisääminen ei ollut sallittua potilaille, jotka saivat Onglyzaa 2,5 mg tai 5 mg. Glyburidi voidaan titrata missä tahansa hoitoryhmässä kerran 24 viikon tutkimusjakson aikana hypoglykemian takia, kuten tutkija pitää tarpeellisena. Noin 92% plasebo- ja glyburidiryhmän potilaista titrattiin lopulliseksi kokonaisannokseksi 15 mg tutkimusjakson ensimmäisen 4 viikon aikana. Potilaita, jotka eivät saavuttaneet tiettyjä glykeemisiä tavoitteita tutkimuksen aikana, hoidettiin metformiinin pelastamisella, jota lisättiin olemassa olevaan tutkimuslääkkeeseen. Onglyzan annoksen titraaminen ei ollut sallittua tutkimuksen aikana.
Yhdessä glyburidin kanssa Onglyza 2,5 mg ja 5 mg tuottivat merkittäviä parannuksia A1C: ssä, FPG: ssä ja PPG: ssä verrattuna lumelääkkeeseen plus ylititrattuun glyburidiryhmään (taulukko 6). Niiden potilaiden osuus, jotka lopettivat hoidon glykeemisen valvonnan puutteen vuoksi tai jotka pelastettiin noudattamaan ennalta määriteltyjä glykeemisiä kriteerejä, oli 18% Onglyza 2,5 mg: n lisäys glyburidiryhmään, 17% Onglyza 5 mg: n lisäykseen glyburidiryhmässä ja 30% lumelääkkeessä plus ylititrattu glyburidi ryhmä.
Taulukko 6: glykeemiset parametrit viikolla 24 plasebokontrolloidussa Onglyzan tutkimuksessa lisäyhdistelmähoidona glyburidilla *
| Tehokkuusparametri | Onglyza 2,5 mg + glyburide 7,5 mg N = 248 |
Onglyza 5 mg + glyburide 7,5 mg N = 253 |
Plasebo + Ylä-titrattu glyburidi N = 267 |
|---|---|---|---|
| * Tavoitteena hoidettava väestö, joka käyttää viimeistä tutkimusta tai viimeistä havaintoa ennen metformiinipelastushoitoa pelastamista tarvitseville potilaille. | |||
| †Pienimmän neliösumman keskiarvo mukautettu perusarvoon. | |||
| C p-arvo <0,0001 verrattuna plaseboon + titrattuun glyburidiin | |||
| § p-arvo <0,05 verrattuna plaseboon + titrattuun glyburidiin | |||
| Hemoglobiini A1C (%) | N = 246 | N = 250 | N = 264 |
| Perustaso (keskiarvo) | 8.4 | 8.5 | 8.4 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −0.5 | −0.6 | +0.1 |
| Ero yllä titratusta glyburidista (oikaistu keskiarvo†) | −0.6C | −0.7C | |
| 95% luottamusväli | (−0.8, −0.5) | (−0.9, −0.6) | |
| Prosentti potilaista, joilla saavutetaan A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Paasto-plasmaglukoosi (mg / dL) | N = 247 | N = 252 | N = 265 |
| Perustaso (keskiarvo) | 170 | 175 | 174 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −7 | −10 | +1 |
| Ero yllä titratusta glyburidista (oikaistu keskiarvo†) | −8 § | −10 § | |
| 95% luottamusväli | (−14, −1) | (−17, −4) | |
| 2 tunnin postprandiaalinen glukoosi (mg / dL) | N = 195 | N = 202 | N = 206 |
| Perustaso (keskiarvo) | 309 | 315 | 323 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −31 | −34 | +8 |
| Ero yllä titratusta glyburidista (oikaistu keskiarvo†) | −38 § | −42 § | |
| 95% luottamusväli | (−50, −27) | (−53, −31) |
Samanaikainen käyttö metformiinin kanssa potilailla, jotka eivät ole aiemmin saaneet hoitoa
Tähän 24 viikon satunnaistettuun, kaksoissokkoutettuun, plasebokontrolloituun tutkimukseen osallistui yhteensä 1306 potilasta, joilla ei ollut hoidettu tyypin 2 diabetes mellitusta. arvioida metformiinin kanssa samanaikaisesti annetun Onglyzan tehokkuutta ja turvallisuutta potilailla, joilla glykeeminen kontrolli on riittämätön (A1C - 8% –12%) ruokavaliossa ja liikunnassa yksin. Potilaiden oli oltava hoitamattomia hoitamaan osallistumistaan tähän tutkimukseen.
Potilaat, jotka täyttivät kelpoisuusvaatimukset, otettiin mukaan yhden sokean, yhden viikon ruokavalion ja liikunnan plasebo-aloitusjaksoon. Potilaat satunnaistettiin yhdeksi neljästä hoitoryhmästä: Onglyza 5 mg + metformiini 500 mg, saksagliptiini 10 mg + metformiini 500 mg, saksagliptiini 10 mg + lumelääke tai metformiini 500 mg + lumelääke. Onglyza annettiin kerran päivässä. Kolmessa hoitoryhmässä, jotka käyttivät metformiinia, metformiinin annos titrattiin viikoittain 500 mg: aa päivässä, niin kuin siedetty, korkeintaan 2000 mg: aan päivässä FPG: n perusteella. Potilaita, jotka eivät saavuttaneet spesifisiä glykeemisiä tavoitteita tutkimusten aikana, hoidettiin pioglitatsoni-pelastuksella lisähoitona.
Onglyza 5 mg: n ja metformiinin samanaikainen anto tarjosi merkittäviä parannuksia A1C: ssä, FPG: ssä ja PPG: ssä verrattuna plaseboon ja metformiiniin (taulukko 7).
Taulukko 7: glykeemiset parametrit viikolla 24 plasebokontrolloidussa tutkimuksessa, joka koski Onglyzan samanaikaista käyttöä metformiinin kanssa potilailla, jotka eivät ole aiemmin saaneet hoitoa
| Tehokkuusparametri | Onglyza 5 mg + metformiini N = 320 |
Plasebo + metformiini N = 328 |
|---|---|---|
| * Hoito-aikomuspotilaat, jotka käyttävät viimeistä tutkimusta tai viimeistä havaintoa ennen pioglitatsoni-pelastushoitoa pelastamista tarvitseville potilaille. | ||
| †Pienimmän neliösumman keskiarvo mukautettu perusarvoon. | ||
| C p-arvo <0,0001 verrattuna lumelääkkeeseen + metformiiniin | ||
| § p-arvo <0,05 verrattuna lumelääkkeeseen + metformiiniin | ||
| Hemoglobiini A1C (%) | N = 306 | N = 313 |
| Perustaso (keskiarvo) | 9.4 | 9.4 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −2.5 | −2.0 |
| Ero lumelääkkeeseen + metformiiniin (oikaistu keskiarvo)†) | −0.5C | |
| 95% luottamusväli | (−0.7, −0.4) | |
| Prosentti potilaista, joilla saavutetaan A1C <7% | 60% §(185/307) | 41% (129/314) |
| Paasto-plasmaglukoosi (mg / dL) | N = 315 | N = 320 |
| Perustaso (keskiarvo) | 199 | 199 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −60 | −47 |
| Ero lumelääkkeeseen + metformiiniin (oikaistu keskiarvo)†) | −13 § | |
| 95% luottamusväli | (−19, −6) | |
| 2 tunnin postprandiaalinen glukoosi (mg / dL) | N = 146 | N = 141 |
| Perustaso (keskiarvo) | 340 | 355 |
| Muutos lähtötasosta (oikaistu keskiarvo)†) | −138 | −97 |
| Ero lumelääkkeeseen + metformiiniin (oikaistu keskiarvo)†) | −41 § | |
| 95% luottamusväli | (−57, −25) |
ylin
Kuinka toimitetaan
Onglyza ™ (saksagliptiini) -tableteilla on merkinnät molemmilla puolilla, ja niitä on saatavana taulukossa 8 luetelluissa vahvuuksissa ja pakkauksissa.
| Tabletti Vahvuus |
Kalvopäällysteinen tabletti Väri / muoto |
Tabletti merkinnät |
paketin koko | NDC-koodi |
|---|---|---|---|---|
| 5 mg | pinkki kaksoiskupera, pyöreä |
"5" toisella puolella ja "4215" takana, sinisellä musteella | Pullot 30 90 pullon pullot 500 pullon pullot Läpipainopakkaus 100 kpl |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | vaaleankeltaisesta vaaleankeltaiseen kaksoiskupera, pyöreä |
"2,5" toisella puolella ja "4214" takana, sinisellä musteella | Pullot 30 90 pullon pullot |
0003-4214-11 0003-4214-21 |
Varastointi ja käsittely
Varastoi lämpötilassa 20 ° -25 ° C (68 ° -77 ° F); retket sallitaan lämpötilaan 15 ° -30 ° C (59 ° -86 ° F) [katso USP: n kontrolloima huoneenlämpötila].
ylin
Viimeisin päivitys: 7.9.2009
E. R. Squibb & Sons, L.L.C.
Onglyza-potilastiedot
Yksityiskohtaiset tiedot diabeteksen oireista, oireista, syistä ja hoidoista
Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötapoja, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysymyksiä käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta.
takaisin: Selaa kaikkia diabeteksen lääkkeitä


