Actos tyypin 2 diabetekseen
Tuotemerkki: Actos
Yleinen nimi: Pioglitazone Hydrochloride
Sisällys:
Kuvaus
farmakologia
Käyttöaiheet ja käyttö
Vasta
varoitukset
varotoimet
Haitalliset reaktiot
yliannos
Annostelu ja hallinnointi
Kuinka toimitetaan
Actos, pioglitazone hcl, potilastiedot (selkeästi englanniksi)
VAROITUS: LUOTTAVA Sydänvika
- Tiatsolidiinidionit, mukaan lukien Actos, aiheuttavat tai pahentavat kongestiivista sydämen vajaatoimintaa joillakin potilailla (ks. VAROITUKSET). Actos-hoidon aloittamisen jälkeen ja annoksen suurentamisen jälkeen tarkkailla potilaita huolellisesti sydämen vajaatoiminnan oireiden (mukaan lukien liiallinen, nopea painonnousu, hengenahdistus ja / tai turvotus) varalta. Jos nämä oireet ilmenevät, sydämen vajaatoiminta tulee hoitaa nykyisten hoitostandardien mukaisesti. Lisäksi Actos-hoidon lopettamista tai pienentämistä on harkittava.
- Actos-valmistetta ei suositella potilaille, joilla on oireellinen sydämen vajaatoiminta. Actos-hoidon aloittaminen potilailla, joilla on NYHA-luokan III tai IV sydämen vajaatoiminta, on vasta-aiheista (ks VASTA ja VAROITUKSET).
Kuvaus
Actos (pioglitatsonihydrokloridi) on suun kautta otettava diabeteslääke, joka vaikuttaa ensisijaisesti vähentämällä insuliiniresistenssiä. Actos-valmistetta käytetään tyypin 2 diabeteksen (tunnetaan myös nimellä insuliinista riippumaton diabetes mellitus (NIDDM) tai aikuisten puhkeaminen diabetes) hoidossa. Farmakologiset tutkimukset osoittavat, että Actos parantaa herkkyyttä lihas- ja rasvakudoksen insuliinille ja estää maksan glukoneogeneesiä. Actos parantaa verensokeritasapainoa vähentäen samalla verenkierron insuliinitasoja.
Pioglitatsoni [(±) -5 - [[4- [2- (5-etyyli-2-pyridinyyli) etoksi] fenyyli] metyyli] -2,4-] tiatsolidiinidionimonohydrokloridi kuuluu eri kemiallinen luokka ja sillä on erilainen farmakologinen vaikutus kuin sulfonyyliureoilla, metformiinilla tai Î ± -glukosidaasilla inhibiittorit. Molekyyli sisältää yhden epäsymmetrisen hiilen, ja yhdiste syntetisoidaan ja käytetään raseemisena seoksena. Pioglitatsonin kaksi enantiomeeri muuttuvat toisiinsa in vivo. Kahden enantiomeerin välillä ei havaittu eroja farmakologisessa aktiivisuudessa. Rakennekaava on esitetty:
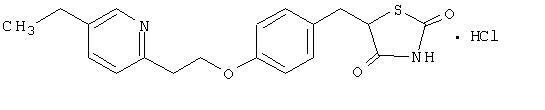
Pioglitatsonihydrokloridi on hajuton valkoinen kiteinen jauhe, jonka molekyylikaava on C19H20N2O3S-HCl ja molekyylipaino 392,90 daltonia. Se liukenee N, N-dimetyyliformamidiin, liukenee vähän vedettömään etanoliin, hyvin liukenee asetoniin ja asetonitriiliin, käytännöllisesti liukenematta veteen ja liukenematta eetteriin.
Actos on saatavana suun kautta annettavana tablettina, joka sisältää 15 mg, 30 mg tai 45 mg pioglitatsonia (emäksenä) formuloituna seuraavat apuaineet: laktoosimonohydraatti NF, hydroksipropyyliselluloosa NF, karboksimetyyliselluloosakalsium NF ja magnesiumstearaatti NF.
ylin
Kliininen farmakologia
Toimintamekanismi
Actos on tiatsolidiinidionidiabeedin vastainen aine, jonka vaikutustapa riippuu insuliinin läsnäolosta. Actos vähentää insuliiniresistenssiä ääreisillä alueilla ja maksassa, mikä johtaa lisääntyneeseen insuliiniriippuvaisen glukoosin loppusijoitukseen ja vähentää maksan glukoosin tuottoa. Toisin kuin sulfonyyliureat, pioglitatsoni ei ole insuliinin erittäjä. Pioglitatsoni on voimakas agonisti peroksisomiproliferaattorilla aktivoidulle reseptori-gammalle (PPAR3). PPAR-reseptoreita löytyy kudoksista, jotka ovat tärkeitä insuliinin vaikutukselle, kuten rasvakudoksesta, luu-lihaksesta ja maksasta. PPARÎ3-ydinreseptoreiden aktivointi moduloi useiden insuliiniin reagoivien geenien transkriptiota, jotka osallistuvat glukoosin ja lipidien metabolian hallintaan.
Diabetesin eläinmalleissa pioglitatsoni vähentää insuliiniresistenttien tilojen, kuten tyypin 2 diabetekseen tyypillistä hyperglykemiaa, hyperinsulinemiaa ja hypertriglyseridemiaa. Pioglitatsonin aiheuttamat metaboliset muutokset johtavat lisääntyneeseen insuliiniriippuvaisten kudosten reaktiivisuuteen, ja niitä havaitaan lukuisissa eläinmalleissa insuliiniresistenssin suhteen.
Koska pioglitatsoni tehostaa kiertävän insuliinin vaikutuksia (vähentämällä insuliiniresistenssiä), se ei alenna verensokeria eläinmalleissa, joista puuttuu endogeeninen insuliini.
Farmakokinetiikka ja lääkeaineenvaihdunta
Pioglitatsonin kokonaispitoisuus (pioglitatsoni + aktiiviset metaboliitit) seerumipitoisuudet pysyvät kohonneina 24 tunnin kuluttua kerran päivässä annosta. Sekä pioglitatsonin että kokonaispioglitatsonin vakaan tilan seerumipitoisuudet saavutetaan 7 päivän kuluessa. Vakaan tilan ollessa kaksi pioglitatsonin farmakologisesti aktiivisista metaboliiteista, metaboliitit III (M-III) ja IV (M-IV), saavuttavat seerumipitoisuudet, jotka ovat yhtä suuret tai suurempia kuin pioglitatsoni. Sekä terveillä vapaaehtoisilla että tyypin 2 diabeteksen potilailla pioglitatsoni sisältää noin 30-50% pioglitatsonin kokonaispitoisuudet huippupitoisuuksissa seerumissa ja 20% - 25% kokonaispinta-alasta seerumin konsentraatio-aikakäyrän alla (AUC).
Suurin seerumikonsentraatio (Cmax), AUC ja seerumin vähimmäispitoisuudet (Cmin) sekä pioglitatsonilla että kokonaispioglitatsonilla lisääntyvät suhteellisesti annoksilla 15 mg ja 30 mg päivässä. Pioglitatsonin ja kokonaispioglitatsonin nousu on hiukan vähemmän kuin suhteellisesti annoksella 60 mg päivässä.
Imeytyminen: Pioglitatsoni voidaan mitata oraalisesti paastonneina seerumissa ensin 30 minuutissa, huippupitoisuudet havaitaan 2 tunnissa. Ruoka hidastaa aikaa seerumin huippupitoisuuden saavuttamiseen 3-4 tuntiin, mutta ei muuta imeytymisen laajuutta.
Jakautuminen: Pioglitatsonin keskimääräinen näennäinen jakautumistilavuus (Vd / F) kerta-annoksen antamisen jälkeen on 0,63 ± 0,41 (keskiarvo ± SD) L / ruumiinpaino.
Pioglitatsoni sitoutuu laajasti proteiineihin (> 99%) ihmisen seerumissa, pääasiassa seerumin albumiiniin. Pioglitatsoni sitoutuu myös muihin seerumin proteiineihin, mutta vähemmän affiniteetilla. Metaboliitit M-III ja M-IV ovat myös sitoutuneet laajasti (> 98%) seerumin albumiiniin.
Metabolia: Pioglitatsoni metaboloituu laajasti hydroksyloinnin ja hapettumisen kautta; metaboliitit muuttuvat myös osittain glukuronidi- tai sulfaattikonjugaateiksi. Metaboliitit M-II ja M-IV (pioglitatsonin hydroksijohdannaiset) ja M-III (pioglitatsonin ketojohdannaiset) ovat farmakologisesti aktiivisia tyypin 2 diabeteksen eläinmalleissa. Pioglitatsonin lisäksi M-III ja M-IV ovat tärkeimmät lääkkeisiin liittyvät lajit, joita löytyy ihmisen seerumista moninkertaisen annostelun jälkeen. Vakaan tilan pioglitatsoni sekä terveillä vapaaehtoisilla että tyypin 2 diabeteksen potilailla käsittää noin 30% - 50% seerumin kokonaispitoisuuksista ja 20 - 25% kokonais AUC.
In vitro -tiedot osoittavat, että useita CYP-isoformeja osallistuu pioglitatsonin metaboliaan. Mukana olevat sytokromi P450 -isoformit ovat CYP2C8 ja vähemmässä määrin CYP3A4, ja lisäaineita useista muista isomuodoista, mukaan lukien pääasiassa ekstrahepaattinen CYP1A1. Pioglitatsonilla yhdessä P450-estäjien ja substraattien kanssa on tehty in vivo -tutkimuksia (ks Lääkkeiden yhteisvaikutukset). Actosilla hoidetuilla potilailla mitatut virtsa-6-hydroksikortisoli / kortisolisuhteet osoittivat, että pioglitatsoni ei ole vahva CYP3A4-entsyymin indusoija.
Erittyminen ja eliminaatio: Oraalisen annon jälkeen noin 15% - 30% pioglitatsoniannoksesta erittyy virtsaan. Pioglitatsonin eliminaatio munuaisten kautta on vähäistä, ja lääke erittyy pääasiassa metaboliiteina ja niiden konjugaateina. Oletetaan, että suurin osa suun kautta annetusta annoksesta erittyy sappiin joko muuttumattomana tai metaboliitteina ja eliminoituu ulosteeseen.
Pioglitatsonin keskimääräinen seerumin puoliintumisaika on 3 - 7 tuntia ja kokonais-pioglitatsonin välillä 16 - 24 tuntia. Pioglitatsonin näennäinen puhdistuma, CL / F, on laskettu olevan 5 - 7 l / h.
Erityisväestöt
Munuaisten vajaatoiminta: Pioglitatsonin, M-III: n ja M-IV: n seerumin eliminaation puoliintumisaika pysyy muuttumattomana potilailla, joilla on kohtalainen (kreatiniinipuhdistuma 30 - 60 ml / min) vakavaan (kreatiniinipuhdistuma <30 ml / min) munuaisten vajaatoimintaan verrattuna normaaliin aiheista. Annoksen muuttamista munuaisten vajaatoiminnasta kärsiville potilaille ei suositella (ks ANNOSTELU JA HALLINNOINTI).
Maksan vajaatoiminta: Verrattuna normaaleihin kontrolleihin potilailla, joilla on maksan vajaatoiminta (Child-Pugh-aste B / C), on pioglitatsonin ja pioglitatsonin kokonaispitoisuuksien keskimääräiset huippupitoisuudet vähentyvät noin 45%, mutta keskimääräisen AUC: n muutokset eivät arvot.
Actos-hoitoa ei tule aloittaa, jos potilaalla on kliinisiä todisteita aktiivisesta maksasairaudesta tai seerumin transaminaasitasot (ALAT) ylittävät 2,5 kertaa normaalin ylärajan (ks. VAROTOIMET, Maksavaikutukset).
Iäkkäät: Terveillä iäkkäillä henkilöillä pioglitatsonin ja kokonaispioglitatsonin huippupitoisuudet seerumissa eivät ole merkittävästi erilaisia, mutta AUC-arvot ovat hiukan korkeammat ja terminaalisen puoliintumisajan arvot hieman pidempiä kuin nuoremmat aiheet. Nämä muutokset eivät olleet niin suuria, että niitä pidettäisiin kliinisesti merkityksellisinä.
Lastenlääkkeet: Farmakokineettisiä tietoja lapsipopulaatiosta ei ole saatavana.
Sukupuoli: Keskimääräinen Cmax ja AUC-arvot nousivat 20%: sta 60%: iin naisilla. Monoterapiana ja yhdistelmänä sulfonyyliurean, metformiinin tai insuliinin kanssa Actos paransi glykeemistä hallintaa sekä miehillä että naisilla. Kontrolloiduissa kliinisissä tutkimuksissa hemoglobiini A1c (HbA1c) lasku lähtötasosta oli yleensä suurempi naisilla kuin miehillä (keskimääräinen keskimääräinen ero HbA: ssa)1c 0.5%). Koska hoito tulisi räätälöidä jokaiselle potilaalle glykeemisen tason saavuttamiseksi, annoksen muuttamista ei suositella pelkästään sukupuolen perusteella.
Etnisyys: Farmakokineettisiä tietoja eri etnisten ryhmien välillä ei ole saatavana.
Huumeiden ja lääkkeiden yhteisvaikutukset
Seuraavia lääkkeitä tutkittiin terveillä vapaaehtoisilla, jotka saivat samanaikaisesti Actos-valmistetta 45 mg kerran päivässä. Alla on lueteltu tulokset:
Suun kautta annettavat ehkäisyvalmisteet: Actos (45 mg kerran päivässä) ja suun kautta otettavat ehkäisyvalmisteet (1 mg noretindronia plus) 0,035 mg etinyyliestradiolia kerran päivässä) 21 vuorokauden ajan, mikä johti 11%: n ja 11 - 14%: n laskuun etinyyliestradiolin AUC: ssa (0–24 h). ja Cmax vastaavasti. Noretindronin AUC: ssa (0 - 24 h) ja C: ssä ei tapahtunut merkittäviä muutoksiamax. Etinyyliestradiolin farmakokinetiikan suuren vaihtelun vuoksi tämän löydöksen kliinistä merkitystä ei tunneta.
Feksofenadiini-HCl: Actos-valmisteen samanaikainen antaminen 7 päivän ajan suun kautta annettavan 60 mg feksofenadiinin kanssa kahdesti päivässä ei vaikuttanut merkittävästi pioglitatsonin farmakokinetiikkaan. Actosilla ei ollut merkittävää vaikutusta feksofenadiinin farmakokinetiikkaan.
Glipitsidi: Actosin ja 5 mg glipitsidin samanaikainen anto suun kautta kerran päivässä 7 päivän ajan, ei muuttanut glipitsidin vakaan tilan farmakokinetiikkaa.
Digoksiini: Actos-valmisteen samanaikainen antaminen 0,25 mg: n digoksiinin kanssa suun kautta kerran päivässä 7 päivän ajan ei muuttanut digoksiinin vakaan tilan farmakokinetiikkaa.
Varfariini: Actos-valmisteen samanaikainen käyttö 7 päivän ajan varfariinin kanssa ei vaikuttanut varfariinin vakaan tilan farmakokinetiikkaan. Actosilla ei ole kliinisesti merkittävää vaikutusta protrombiiniaikaan, kun niitä annetaan potilaille, jotka saavat kroonista varfariinihoitoa.
Metformiini: Yhden kerta-annoksen metformiinin (1000 mg) ja Actosin samanaikainen antaminen Actos-valmisteen 7 päivän jälkeen ei muuttanut metformiinin kerta-annoksen farmakokinetiikkaa.
Midatsolaami: Actos-valmisteen antaminen 15 vuorokauden ajan, jota seurasi yksi 7,5 mg: n annos midatsolaamisiirappia, johti midatsolaamin C vähenemiseen 26%max ja AUC.
Ranitidiini HCl: Actos-valmisteen samanaikainen antaminen 7 päivän ajan suun kautta kahdesti päivässä annettavan ranitidiinin kanssa 4 tai 7 päivän ajan ei vaikuttanut merkittävästi pioglitatsonin farmakokinetiikkaan. Actos ei osoittanut merkittävää vaikutusta ranitidiinin farmakokinetiikkaan.
Nifedipiini ER: Actos-valmisteen samanaikainen antaminen 7 päivän ajan 30 mg nifedipiini ER: n annon kanssa suun kautta kerran päivässä 4 päivän ajan mies- ja naispuolisten vapaaehtoisten tulokset olivat vähiten neliömäisiä (90% CI) arvoja muuttumattomalle nifedipiinille 0,83 (0,73 - 0,95) Cmax ja 0,88 (0,80 - 0,96) AUC: lle. Nifedipiinin farmakokinetiikan suuren vaihtelun vuoksi tämän löydöksen kliinistä merkitystä ei tunneta.
Ketokonatsoli: Actos-valmisteen samanaikainen antaminen 7 päivän ajan 200 mg: n ketokonatsolin kanssa kahdesti päivittäin tuloksena muuttumattoman pioglitatsonin keskimääräiset neliökeskiarvot (90% CI) olivat 1,14 (1,06 - 1,23). C: llemax, 1,34 (1,26 - 1,41) AUC: lle ja 1,87 (1,71 - 2,04) C: llemin.
Atorvastatiinikalsium: Actos-valmisteen samanaikainen käyttö 7 päivän ajan atorvastatiinikalsiumin (LIPITOR®) kanssa 80 mg kerran päivässä tuotti muuttumattomalle pioglitatsonille pienimmän neliösumman (90% CI) arvot 0,69 (0,57 - 0,85) C: llemax, 0,76 (0,65 - 0,88) AUC: lle ja 0,96 (0,87 - 1,05) C: llemin. Muuttumattoman atorvastatiinin vähiten neliösumman keskiarvo (90% CI) oli C 0,77 (0,66 - 0,90).max, 0,86 (0,78 - 0,94) AUC: lle ja 0,92 (0,82 - 1,02) C: llemin.
Teofylliini: Actos-valmisteen samanaikainen antaminen 7 päivän ajan teofylliinin kanssa, joka annettiin 400 mg kahdesti päivässä, ei aiheuttanut muutoksia kummankaan lääkkeen farmakokinetiikassa.
Sytokromi P450: Katso VAROTOIMET
Gemfibrosiili: CYP2C8: n estäjän gemfibrosiilin (oraalisesti 600 mg kahdesti päivässä) ja pioglitatsonin (oraalisesti 30 mg) samanaikainen anto 10: lle ennalta hoidetulle terveelle vapaaehtoiselle 2 vuorokautta ennen gemfibrosiilia (oraalisesti 600 mg kahdesti päivässä) johti pioglitatsonialtistukseen (AUC0-24), joka oli 226% pioglitatsoni-altistuksesta gemfibrosiilin puuttuessa (katso VAROTOIMET).
Rifampiini: Rifampiinin (oraalisesti 600 mg kerran päivässä), CYP2C8: n indusoijan, samanaikainen antaminen kymmenelle terveelle vapaaehtoiset, joita oli esikäsitelty viisi päivää ennen rifampiinilla (oraalisesti 600 mg kerran päivässä), johti pioglitatsonin AUC: n laskuun 54% (ks. VAROTOIMET).
Farmakodynamiikka ja kliiniset vaikutukset
Kliiniset tutkimukset osoittavat, että Actos parantaa insuliiniherkkyyttä insuliiniresistenteillä potilailla. Actos parantaa solujen reagointia insuliiniin, lisää insuliiniriippuvaista glukoosin hävikkiä, parantaa maksan herkkyyttä insuliinille ja parantaa toimintahäiriöistä sokerin homeostaasia. Tyypin 2 diabeteksen potilailla Actosin tuottama vähentynyt insuliiniresistenssi johtaa pienempiin plasman glukoosipitoisuuksiin, matalampaan plasmainsuliinipitoisuuteen ja matalampaan HbA-arvoon.1c arvot. Avoimen jatkotutkimuksen tulosten perusteella Actosin glukoosipitoisuutta alentavat vaikutukset näyttävät jatkuvan vähintään yhden vuoden. Kontrolloiduissa kliinisissä tutkimuksissa Actosilla yhdessä sulfonyyliurean, metformiinin tai insuliinin kanssa oli additiivinen vaikutus glykeemiseen kontrolliin.
Potilaat, joilla oli lipidien poikkeavuuksia, otettiin mukaan Actos-valmisteen kliinisiin tutkimuksiin. Kaiken kaikkiaan Actos-hoitoa saaneilla potilailla oli triglyseridien keskimääräinen lasku, HDL-kolesterolin keskimääräinen nousu eikä LDL: n ja kokonaiskolesterolin jatkuvia keskimääräisiä muutoksia.
26 viikkoisessa, lumelääkekontrolloidussa, annosmääritystutkimuksessa triglyseridien keskimääräiset pitoisuudet laskivat Actos-annosryhmillä 15 mg, 30 mg ja 45 mg verrattuna lumelääkeryhmän keskimääräiseen nousuun. Keskimääräiset HDL-pitoisuudet nousivat suuressa määrin Actos-hoitoa saaneilla potilailla kuin plaseboa saaneilla potilailla. Actos-hoitoa saaneilla potilailla ei ollut jatkuvia eroja LDL: n ja kokonaiskolesterolin suhteessa lumelääkkeeseen (taulukko 1).
Taulukko 1 Lipidit 26 viikon lumelääkekontrolloidussa monoterapia-annostutkimuksessa
| Plasebo | Actos 15 mg Kerran Päivittäin |
Actos 30 mg Kerran Päivittäin |
Actos 45 mg Kerran Päivittäin |
|
| Triglyseridit (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Perustaso (keskiarvo) | 262.8 | 283.8 | 261.1 | 259.7 |
| Prosentuaalinen muutos lähtötasosta (keskiarvo) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL-kolesteroli (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Perustaso (keskiarvo) | 41.7 | 40.4 | 40.8 | 40.7 |
| Prosentuaalinen muutos lähtötasosta (keskiarvo) | 8.1% | 14.1% | 12.2% | 19.1% |
| LDL-kolesteroli (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Perustaso (keskiarvo) | 138.8 | 131.9 | 135.6 | 126.8 |
| Prosentuaalinen muutos lähtötasosta (keskiarvo) | 4.8% | 7.2% | 5.2% | 6.0% |
| Kokonaiskolesteroli (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Perustaso (keskiarvo) | 224.6 | 220.0 | 222.7 | 213.7 |
| Prosentuaalinen muutos lähtötasosta (keskiarvo) | 4.4% | 4.6% | 3.3% | 6.4% |
Kahdessa muussa monoterapiatutkimuksessa (24 viikkoa ja 16 viikkoa) ja yhdistelmähoitotutkimuksissa sulfonyyliurean kanssa (24 viikkoa ja 16 viikkoa) ja metformiinin (24 viikkoa ja 16 viikkoa) tulokset olivat yleensä yhdenmukaisia tietojen kanssa edellä. Plasebokontrolloiduissa tutkimuksissa lumelääkekorjatut keskimääräiset muutokset lähtötasosta laskivat 5%: sta 26%: iin triglyseridien kohdalla ja lisääntyivät 6%: sta 13%: iin HDL: n suhteen Actosilla hoidetuilla potilailla. Samanlainen tulokset havaittiin Actosin 24 viikon yhdistelmähoitotutkimuksissa sulfonyyliurean tai metformiinin kanssa.
Yhdistelmähoitotutkimuksessa insuliinin kanssa (16 viikkoa) myös plasebo-korjattu keskimääräinen prosentuaalinen muutos lähtötasosta triglyseridiarvoissa Actosilla hoidetuilla potilailla pieneni. Lumelääkekorjatulla LDL-kolesterolin muutoksella lähtötasosta 7% havaittiin 15 mg: n annosryhmässä lähtötasosta. Samanlaisia tuloksia kuin edellä HDL: n ja kokonaiskolesterolin suhteen havaittiin. Samanlainen tulokset havaittiin 24 viikon yhdistelmähoitotutkimuksessa, jossa Actos käytti insuliinia.
Kliiniset tutkimukset
monoterapia
Yhdysvalloissa tehtiin kolme satunnaistettua, kaksoissokkotonta, lumelääkekontrolloitua tutkimusta, joiden kesto oli 16 - 26 viikkoa, jotta arvioitiin Actos-valmisteen käyttöä monoterapiana tyypin 2 diabeteksen potilailla. Näissä tutkimuksissa tutkittiin Actosia enintään 45 mg: n annoksina tai lumelääke kerran päivässä 865 potilaalla.
26 viikkoa kestävässä, annosmääritystutkimuksessa 408 tyypin 2 diabetestä sairastavaa potilasta satunnaistettiin saamaan 7,5 mg, 15 mg, 30 mg tai 45 mg Actosia tai lumelääkettä kerran päivässä. Hoito millä tahansa aikaisemmalla antidiabeettisella aineella lopetettiin 8 viikkoa ennen kaksoissokkoutumista. Käsittely 15 mg: lla, 30 mg: lla ja 45 mg: lla Actosia tuotti tilastollisesti merkittäviä parannuksia HbA1c: ssä ja paastonneen plasman glukoosissa (FPG) loppupisteessä verrattuna plaseboon (kuva 1, taulukko 2).
Kuvio 1 näyttää aikataulun FPG: n ja HbA1c: n muutoksille koko tutkimuspopulaatiossa tässä 26 viikon tutkimuksessa.

Taulukossa 2 esitetään HbA1c ja FPG-arvot koko tutkimuspopulaatiolle.
Taulukko 2 glykeemiset parametrit 26 viikon plasebokontrolloidussa annoskohdatutkimuksessa
| Plasebo | Actos 15 mg Kerran Päivittäin |
Actos 30 mg Kerran Päivittäin |
Actos 45 mg Kerran Päivittäin |
|
| KOKONAISVÄESTÖ | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Perustaso (keskiarvo) | 10.4 | 10.2 | 10.2 | 10.3 |
| Muutos lähtötasosta (oikaistu keskiarvo)+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Ero lumelääkkeeseen (oikaistu keskiarvo+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Perustaso (keskiarvo) | 268 | 267 | 269 | 276 |
| Muutos lähtötasosta (oikaistu keskiarvo)+) | 9 | -30 | -32 | -56 |
| Ero lumelääkkeeseen (oikaistu keskiarvo+) | -39* | -41* | -65* | |
|
+ Oikaistu lähtötilanteen, yhdistelmäkeskuksen ja yhdistelmäkeskuksen suhteen hoidon vuorovaikutuksella * p - 0,050 vs. plasebo |
Tutkimuspopulaatioon sisältyi potilaita, joita ei aikaisemmin hoidettu diabeteksen vastaisilla lääkkeillä (ei aiemmin annettu); 31%) ja potilaat, jotka saivat diabeteslääkkeitä tutkimuksen aloittamishetkellä (aiemmin hoidettu; 69%). Aikaisemmin hoitamattomien potilasjoukkojen tiedot on esitetty taulukossa 3. Kaikki potilaat aloittivat 8 viikon huuhtelu- / sisäänajojakson ennen kaksoissokkotettua hoitoa. Tähän sisäänajokauteen liittyi vähän muutoksia HbA: ssa1c ja FPG-arvot seulonnasta perusviivaan aiemmin potilaille; aikaisemmin hoidetulla ryhmällä huuhtuminen aikaisemmasta antidiabeettisesta lääkkeestä johti kuitenkin glykeemisen kontrollin heikkenemiseen ja HbA-arvon nousuun1c ja FPG. Vaikka useimmilla aiemmin hoidettujen ryhmien potilailla HbA-arvot laskivat lähtötasosta1c ja FPG: n kanssa Actos, monissa tapauksissa arvot eivät palanneet seulontatasoille tutkimuksen loppuun mennessä. Tutkimussuunnitelma ei sallinut niiden potilaiden arviointia, jotka vaihtoivat suoraan Actosiin toisesta diabeteksenvastaisesta aineesta.
Taulukko 3 glykeemiset parametrit 26 viikon plasebokontrolloidussa annosmääritystutkimuksessa
| Plasebo | Actos 15 mg Kerran Päivittäin |
Actos 30 mg Kerran Päivittäin |
Actos 45 mg Kerran Päivittäin |
|
| Ole terapiassa HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Seulonta (keskiarvo) | 9.3 | 10.0 | 9.5 | 9.8 |
| Perustaso (keskiarvo) | 9.0 | 9.9 | 9.3 | 10.0 |
| Muutos lähtötasosta (oikaistu keskiarvo *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Ero lumelääkkeeseen (oikaistu keskiarvo *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | N = 25 | N = 26 | N = 26 | N = 21 |
| Seulonta (keskiarvo) | 223 | 245 | 239 | 239 |
| Perustaso (keskiarvo) | 229 | 251 | 225 | 235 |
| Muutos lähtötasosta (oikaistu keskiarvo *) | 16 | -37 | -41 | -64 |
| Ero lumelääkkeeseen (oikaistu keskiarvo *) | -52 | -56 | -80 | |
| Aikaisemmin käsitelty HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Seulonta (keskiarvo) | 9.3 | 9.0 | 9.1 | 9.0 |
| Perustaso (keskiarvo) | 10.9 | 10.4 | 10.4 | 10.6 |
| Muutos lähtötasosta (oikaistu keskiarvo *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Ero lumelääkkeeseen (oikaistu keskiarvo *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | N = 54 | N = 53 | N = 58 | N = 56 |
| Seulonta (keskiarvo) | 222 | 209 | 230 | 215 |
| Perustaso (keskiarvo) | 285 | 275 | 286 | 292 |
| Muutos lähtötasosta (oikaistu keskiarvo *) | 4 | -32 | -27 | -55 |
| Ero lumelääkkeeseen (oikaistu keskiarvo *) | -36 | -31 | -59 | |
| * Oikaistu perusviivaan ja keskitettyyn keskustaan |
24 viikon, lumelääkekontrolloidussa tutkimuksessa 260 tyypin 2 diabetestä sairastavaa potilasta satunnaistettiin kahteen pakotetustiitraus Actos-hoitoryhmään tai muotititraus-lumelääkeryhmään. Hoito millä tahansa aikaisemmalla antidiabeettisella aineella lopetettiin 6 viikkoa ennen kaksoissokkoutumista. Yhdessä Actos-hoitoryhmässä potilaat saivat aloitusannoksen 7,5 mg kerran päivässä. Neljän viikon kuluttua annosta nostettiin 15 mg: aan kerran päivässä ja vielä neljän viikon kuluttua annos nostettiin 30 mg: aan kerran päivässä tutkimuksen loppuosaan (16 viikkoa). Toisessa Actos-hoitoryhmässä potilaat saivat aloitusannoksen 15 mg kerran päivässä ja titrattiin arvoon 30 mg kerran päivässä ja 45 mg kerran päivässä samalla tavalla. Actos-käsittely, kuten kuvattiin, tuotti tilastollisesti merkitseviä parannuksia HbA: ssa1c ja FPG loppupisteessä verrattuna lumelääkkeeseen (taulukko 4).
Taulukko 4 glykeemiset parametrit 24 viikon plasebo-kontrolloidussa pakollisessa titraustutkimuksessa
| Plasebo | Actos 30 mg+ Kerran päivässä |
Actos 45 mg+ Kerran päivässä |
|
| Kokonaisväestö HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Perustaso (keskiarvo) | 10.8 | 10.3 | 10.8 |
| Muutos lähtötasosta (oikaistu keskiarvo)++) | 0.9 | -0.6 | -0.6 |
| Ero lumelääkkeeseen (oikaistu keskiarvo++) | -1.5* | -1.5* | |
| FPG (mg / dL) | N = 78 | N = 82 | N = 85 |
| Perustaso (keskiarvo) | 279 | 268 | 281 |
| Muutos lähtötasosta (oikaistu keskiarvo)++) | 18 | -44 | -50 |
| Ero lumelääkkeeseen (oikaistu keskiarvo++) | -62* | -68* | |
|
+ Viimeinen annos pakotetulla titrauksella ++ Oikaistu lähtötilanteen, yhdistelmäkeskuksen ja yhdistelmäkeskuksen suhteen hoidon vuorovaikutuksella * p - 0,050 vs. plasebo |
Potilailla, joita ei ollut aikaisemmin hoidettu diabeteksen vastaisilla lääkkeillä (24%), HbA: n seulonnan keskiarvot olivat 10,1%1c ja 238 mg / dl FPG: lle. Perustasolla keskiarvo HbA1c oli 10,2% ja keskimääräinen FPG oli 243 mg / dl. Lumelääkkeeseen verrattuna Actos-hoito, joka titrattiin lopulliseksi annokseksi 30 mg ja 45 mg, johti keskimääräisen HbA-arvon alenemiseen lähtötasosta.1c 2,3% ja 2,6% ja FPG keskimäärin 63 mg / dL ja 95 mg / dL, vastaavasti. Potilaille, joita oli aikaisemmin hoidettu diabeteksen vastaisilla lääkkeillä (76%), tämä lääkitys lopetettiin seulonnassa. Keskimääräiset arvot seulonnalla olivat 9,4% HbA: lle1c ja 216 mg / dl FPG: lle. Perustasolla keskiarvo HbA1c oli 10,7% ja keskimääräinen FPG oli 290 mg / dl. Lumelääkkeeseen verrattuna Actos-hoito, joka titrattiin lopulliseksi annokseksi 30 mg ja 45 mg, johti keskimääräisen HbA-arvon alenemiseen lähtötasosta.1c 1,3% ja 1,4% ja keskimääräinen FPG 55 mg / dL ja 60 mg / dL, vastaavasti. Monille aiemmin hoidetuille potilaille HbA1c ja FPG ei ollut palannut seulontatasoille tutkimuksen loppuun mennessä.
16 viikon tutkimuksessa 197 tyypin 2 diabetesta sairastavaa potilasta satunnaistettiin hoitoon 30 mg Actosilla tai lumelääkkeellä kerran päivässä. Hoito millä tahansa aikaisemmalla antidiabeettisella aineella lopetettiin 6 viikkoa ennen kaksoissokkoutumista. Hoito 30 mg: lla Actosia tuotti tilastollisesti merkittäviä parannuksia HbA: ssa1c ja FPG loppupisteessä verrattuna lumelääkkeeseen (taulukko 5).
Taulukko 5 glykeemiset parametrit 16 viikon plasebo-kontrolloidussa tutkimuksessa
| Plasebo | Actos 30 mg Kerran päivässä |
|
| Kokonaisväestö HbA1c (%) |
N = 93 | N = 100 |
| Perustaso (keskiarvo) | 10.3 | 10.5 |
| Muutos lähtötasosta (oikaistu keskiarvo)+) | 0.8 | -0.6 |
| Ero lumelääkkeeseen (oikaistu keskiarvo+) | -1.4* | |
| FPG (mg / dL) | N = 91 | N = 99 |
| Perustaso (keskiarvo) | 270 | 273 |
| Muutos lähtötasosta (oikaistu keskiarvo)+) | 8 | -50 |
| Ero lumelääkkeeseen (oikaistu keskiarvo+) | -58* | |
|
+ Oikaistu lähtötilanteen, yhdistelmäkeskuksen ja yhdistelmäkeskuksen suhteen hoidon vuorovaikutuksella * p - 0,050 vs. plasebo |
Potilailla, joita ei ollut aikaisemmin hoidettu diabeteksen vastaisilla lääkkeillä (40%), seulonnan keskiarvot olivat 10,3% HbA1c: llä ja 240 mg / dl FPG: llä. Perustasolla keskiarvo HbA1c oli 10,4% ja keskimääräinen FPG oli 254 mg / dl. Lumelääkkeeseen verrattuna 30 mg Actos -hoito johti keskimääräisen HbA-arvon laskuun lähtötasosta1c 1,0% ja FPG: n keskiarvo 62 mg / dl. Potilaille, joita oli aikaisemmin hoidettu diabeteslääkkeillä (60%), tämä lääkitys lopetettiin seulonnan yhteydessä. Keskimääräiset arvot seulonnalla olivat 9,4% HbA: lle1c ja 216 mg / dl FPG: lle. Perustasolla keskiarvo HbA1c oli 10,6% ja keskimääräinen FPG oli 287 mg / dl. Lumelääkkeeseen verrattuna 30 mg Actos -hoito johti keskimääräisen HbA-arvon laskuun lähtötasosta1c 1,3% ja keskimääräinen FPG 46 mg / dl. Monille aiemmin hoidetuille potilaille HbA1c ja FPG ei ollut palannut seulontatasoille tutkimuksen loppuun mennessä.
Yhdistelmähoito
Kolme 16 viikon satunnaistettuja, kaksoissokkoutettuja, lumelääkekontrolloituja kliinisiä tutkimuksia ja kolme 24 viikon satunnaistettuja, kaksoissokkoutettuja, annoskontrolloituja tehtiin kliinisiä tutkimuksia Actos-valmisteen vaikutusten arvioimiseksi glykeemiseen kontrolliin tyypin 2 diabeteksen potilailla, jotka olivat riittämättömiä kontrolloitu (HbA1c â ‰ ¥ 8%) huolimatta nykyisestä hoidosta sulfonyyliurealla, metformiinilla tai insuliinilla. Aikaisempi diabeteshoito on saattanut olla monoterapiaa tai yhdistelmähoitoa.
Actos Plus -sulfonyyliureatutkimukset
Actosilla suoritettiin kaksi kliinistä tutkimusta yhdessä sulfonyyliurean kanssa. Molemmat tutkimukset sisälsivät tyypin 2 diabeteksen potilaita sulfonyyliurealla joko yksinään tai yhdistelmänä toisen diabeteksen vastaisen aineen kanssa. Kaikki muut diabeteslääkkeet lopetettiin ennen tutkimushoidon aloittamista. Ensimmäisessä tutkimuksessa 560 potilasta satunnaistettiin saamaan 15 mg tai 30 mg Actosia tai lumelääkettä kerran päivässä 16 viikon ajan heidän nykyisen sulfonyyliurea-hoidon lisäksi. Verrattuna lumelääkkeeseen viikolla 16, Actos-valmisteen lisääminen sulfonyyliureaan vähensi merkittävästi keskimääräistä HbA: ta1c 0,9% ja 1,3% ja FPG: n keskiarvo 39 mg / dl ja 58 mg / dL vastaavasti 15 mg: n ja 30 mg: n annoksilla.
Toisessa tutkimuksessa 702 potilasta satunnaistettiin saamaan 30 mg tai 45 mg Actosia kerran päivässä 24 viikon ajan heidän nykyisen sulfonyyliureo-ohjelman lisäksi. HbA: n keskimääräiset vähennykset lähtötasosta viikolla 241c olivat 1,55% ja 1,67% vastaavasti 30 mg: n ja 45 mg: n annoksilla. FPG: n keskimääräiset laskut lähtötasosta olivat 51,5 mg / dl ja 56,1 mg / dL.
Actosin ja sulfonyyliurean yhdistelmän terapeuttinen vaikutus havaittiin potilailla riippumatta siitä, saivatko potilaat pieniä, keskitasoisia tai suuria annoksia sulfonyyliureaa.
Actos Plus Metformiinin tutkimukset
Actosilla ja metformiinin kanssa tehtiin kaksi kliinistä tutkimusta. Molemmat tutkimukset koskivat tyypin 2 diabetesta sairastavia potilaita, jotka saivat metformiinia joko yksinään tai yhdessä toisen diabeteksen vastaisen aineen kanssa. Kaikki muut diabeteslääkkeet lopetettiin ennen tutkimushoidon aloittamista. Ensimmäisessä tutkimuksessa 328 potilasta satunnaistettiin saamaan joko 30 mg Actosia tai lumelääkettä kerran päivässä 16 viikon ajan nykyisen metformiinihoidonsa lisäksi. Verrattuna lumelääkkeeseen viikolla 16, Actos-lisäys metformiiniin vähensi merkittävästi keskimääräistä HbA: ta1c 0,8% ja laski keskimääräistä FPG: tä 38 mg / dl.
Toisessa tutkimuksessa 827 potilasta satunnaistettiin saamaan joko 30 mg tai 45 mg Actosia kerran päivässä 24 viikon ajan nykyisen metformiinihoidonsa lisäksi. HbA: n keskimääräiset vähennykset lähtötasosta viikolla 241c olivat 0,80% ja 1,01% vastaavasti 30 mg: n ja 45 mg: n annoksilla. FPG: n keskimääräiset laskut lähtötasosta olivat 38,2 mg / dl ja 50,7 mg / dL.
Actosin ja metformiinin yhdistelmän terapeuttinen vaikutus havaittiin potilailla riippumatta siitä, saivatko potilaat metformiinin pienempiä vai suurempia annoksia.
Actos Plus -insuliinitutkimukset
Actosilla tehtiin kaksi kliinistä tutkimusta yhdessä insuliinin kanssa. Molemmat tutkimukset sisälsivät tyypin 2 diabeteksen potilaita, jotka saivat insuliinia joko yksinään tai yhdistelmänä toisen diabeteksen vastaisen aineen kanssa. Kaikki muut diabeteslääkkeet lopetettiin ennen tutkimushoidon aloittamista. Ensimmäisessä tutkimuksessa satunnaistettiin 566 potilasta, jotka saivat keskimäärin 60,5 yksikköä päivässä insuliinia saavat joko 15 mg tai 30 mg Actosia tai lumelääkettä kerran päivässä 16 viikon ajan insuliininsa lisäksi kuuri. Verrattuna lumelääkkeeseen viikolla 16, Actos-valmisteen lisääminen insuliiniin vähensi merkittävästi sekä HbA: ta1c 0,7% ja 1,0% ja FPG 35 mg / dl ja 49 mg / dL, vastaavasti 15 mg ja 30 mg.
Toisessa tutkimuksessa 690 potilasta, jotka saivat keskimäärin 60,0 yksikköä päivässä insuliinia, sai joko 30 mg tai 45 mg Actosia kerran päivässä 24 viikon ajan nykyisen insuliinijärjestelmänsä lisäksi. HbA: n keskimääräiset vähennykset lähtötasosta viikolla 241c olivat 1,17% ja 1,46% vastaavasti 30 mg: n ja 45 mg: n annoksilla. FPG: n keskimääräiset laskut lähtötasosta olivat 31,9 mg / dl ja 45,8 mg / dL. Parannettua glykemian hallintaa seurasi insuliiniannosten keskimääräinen lasku lähtötasosta 6,0% ja 9,4% päivässä 30 mg: n ja 45 mg: n annoksilla.
Actosin ja insuliinin yhdistelmän terapeuttinen vaikutus havaittiin potilailla riippumatta siitä, saivatko potilaat pienempiä vai suurempia annoksia insuliinia.
ylin
Käyttöaiheet ja käyttö
Actos on tarkoitettu lisäaineeksi ruokavalioon ja liikuntaan glykeemisen hoidon parantamiseksi aikuisilla, joilla on tyypin 2 diabetes mellitus.
ylin
Vasta
Actos-hoidon aloittaminen potilailla, joilla on perustettu New York Heart Association (NYHA) luokan III tai IV sydämen vajaatoiminta, on vasta-aiheista (ks. LAATIKKO VAROITUS).
Actos on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä tälle tuotteelle tai jollekin sen aineosalle.
ylin
varoitukset
Sydämen vajaatoiminta ja muut sydänvaikutukset
Actos, kuten muut tiatsolidiinidionit, voi aiheuttaa nesteretention, kun sitä käytetään yksinään tai yhdessä muiden diabeteksen vastaisten aineiden kanssa, mukaan lukien insuliini. Nesteretentio voi johtaa sydämen vajaatoimintaan tai pahentaa sitä. Potilaita tulee tarkkailla sydämen vajaatoiminnan oireiden varalta. Jos nämä oireet ilmenevät, sydämen vajaatoiminta tulee hoitaa nykyisten hoitostandardien mukaisesti. Lisäksi Actos-valmisteen käytön lopettamista tai pienentämistä on harkittava (ks LAATIKKO VAROITUS). Potilaita, joilla oli NYHA-luokan III ja IV sydämen tila, ei tutkittu kliinisissä tutkimuksissa ennen hyväksyntää, eikä Actosta suositella näille potilaille (ks. LAATIKKO VAROITUS ja VASTA).
Yhdessä 16 viikon Yhdysvaltain kaksoissokkotutkimuksessa, lumelääkekontrolloidussa kliinisessä tutkimuksessa, johon osallistui 566 tyypin 2 potilasta diabetes, Actos 15 mg: n ja 30 mg: n annoksina yhdessä insuliinin kanssa verrattiin insuliinihoitoon yksin. Tähän tutkimukseen osallistui potilaita, joilla oli pitkäaikainen diabetes ja joilla oli suuri esiintyvien sairauksien tila seuraavasti: valtimoverenpaine (57,2%), perifeerinen neuropatia (22,6%), sepelvaltimo sydänsairaus (19,6%), retinopatia (13,1%), sydänlihaksen infarkti (8,8%), verisuonisairaus (6,4%), angina pectoris (4,4%), aivohalvaus ja / tai ohimenevä iskeeminen isku (4,1%) ja kongestiivinen sydämen vajaatoiminta (2,3%).
Tässä tutkimuksessa kaksi 191 potilaasta, jotka saivat 15 mg Actosia plus insuliinia (1,1%), ja kaksi 188 potilaasta, jotka saivat 30 mg Actos plus insuliini (1,1%) kehittivät kongestiivisen sydämen vajaatoiminnan verrattuna kukaan pelkästään insuliinihoitoa saaneista 187 potilaasta. Kaikilla näillä neljällä potilaalla oli aiemmin sydän- ja verisuonitauteja, mukaan lukien sepelvaltimotauti, aiemmat CABG-toimenpiteet ja sydäninfarkti. 24 viikon annoskontrolloidussa tutkimuksessa, jossa Actosta annettiin samanaikaisesti insuliinin kanssa, 0,3% potilaista (1/345) 30 mg: lla ja 0,9% (3/345) 45 mg: n potilaista ilmoitti CHF: stä vakavana haittavaikutuksena. .
Näiden tutkimusten tulosten analysointi ei tunnistanut spesifisiä tekijöitä, jotka ennustavat kongestiivisen sydämen vajaatoiminnan riskin lisääntymistä yhdistelmähoidossa insuliinin kanssa.
Tyypin 2 diabeteksen ja kongestiivisen sydämen vajaatoiminnan (systolinen toimintahäiriö)
24 viikon markkinoille saattamisen jälkeinen turvallisuustutkimus suoritettiin Actosin (n = 262) vertaamiseksi glyburidiin (n = 256) hallitsemattomilla diabeetikoilla (keskimääräinen HbA1c 8,8% lähtötilanteessa), kun NYHA-luokan II ja III sydämen vajaatoiminta ja ulostyöntämisosuus ovat alle 40% (keskimääräinen EF 30% lähtötasolla). Tutkimuksen kuluessa kongestiivisen sydämen vajaatoiminnan sairaalahoitoa ilmoitettiin 9,9%: lla Actos-potilaita verrattuna 4,7%: iin glyburidia saaneista potilaista. Hoitoero havaittiin 6: sta viikkoa. Tämä Actosiin liittyvä haittatapahtuma oli huomattavampi potilailla, jotka käyttivät insuliinia lähtötilanteessa, ja yli 64-vuotiailla potilailla. Sydän- ja verisuonikuolleisuudessa ei havaittu eroja hoitoryhmien välillä.
Actos-hoito tulee aloittaa pienimmällä hyväksytyllä annoksella, jos sitä määrätään potilaille, joilla on tyypin 2 diabetes ja systolinen sydämen vajaatoiminta (NYHA-luokka II). Jos myöhempi annoksen korottaminen on tarpeen, annosta tulisi nostaa vähitellen vasta usean annoksen jälkeen kuukausia kestävää hoitoa seuraamalla huolellisesti painonnousua, turvotusta tai CHF-oireita ja -oireita pahenemista.
Tulevaisuuden kliininen tutkimus pioglitatsonista makrovaskulaarisissa tapahtumissa (proaktiivinen)
PROaktiivisessa tutkimuksessa 5238 tyypin 2 diabetesta sairastavaa potilasta, joilla oli aiemmin esiintynyt makrovaskulaarista tautia, hoidettiin Actosilla (n = 2605), tiitteroitiin voimankokoeltaan 45 mg: aan kerran päivässä tai lumelääkkeellä (n = 2633) (ks. HAITTAVAIKUTUKSET). Vakavan sydämen vajaatoiminnan potilaiden prosentuaalinen osuus oli korkeampi Actosilla hoidetuilla potilailla (5,7%, n = 149) kuin plaseboa saaneilla potilailla (4,1%, n = 108). Kuoleman esiintyvyys vakavan sydämen vajaatoiminnan ilmoittamisen jälkeen oli 1,5% (n = 40) Actosilla hoidetuilla potilailla ja 1,4% (n = 37) lumelääkkeellä hoidetuilla potilailla. Potilailla, joita hoidettiin insuliinipitoisella hoito-ohjelmalla lähtötilanteessa, vakavan sydämen vajaatoiminnan esiintyvyys oli 6,3% (n = 54/864) Actosilla ja 5,2% (n = 47/896) lumelääkkeellä. Niillä potilailla, joita hoidettiin sulfonyyliureaa sisältävällä ohjelmalla lähtötilanteessa, vakavan sydämen vajaatoiminnan esiintyvyys oli 5,8% (n = 94/1624) Actosilla ja 4,4% (n = 71/1626) lumelääkkeellä.
ylin
varotoimet
yleinen
Actos antaa antihyperglykeemisen vaikutuksensa vain insuliinin läsnä ollessa. Siksi Actosta ei tule käyttää potilailla, joilla on tyypin 1 diabetes tai diabeettisen ketoasidoosin hoitoon.
Hypoglykemia: Potilaat, jotka saavat Actosia yhdessä insuliinin tai suun kautta annettavien hypoglykemia-aineiden kanssa, voivat olla hypoglykemian riskiä, ja samanaikaisen aineen annosta on ehkä pienennettävä.
Sydän ja verisuoni: Yhdysvalloissa tehdyissä plasebokontrolloiduissa kliinisissä tutkimuksissa, joissa suljettiin pois New York Heart Associationin (NYHA) luokan III ja IV sydämen tila, potilailla tilavuuden laajenemiseen liittyviä vakavia sydämeen liittyviä haittavaikutuksia ei lisääntynyt potilailla, joita hoidettiin Actosilla monoterapiana tai yhdistelmänä sulfonyyliureoiden tai metformiinin kanssa vs. lumelääkehoitoa saaneet potilaat. Insuliiniyhdistelmätutkimuksissa pieni joukko potilaita, joilla on aiemmin ollut aiemmin potilaita sydänsairauksista kehittyi kongestiivinen sydämen vajaatoiminta, kun niitä hoidettiin Actosilla yhdessä insuliinin kanssa (katso VAROITUKSET). Potilaita, joilla oli NYHA-luokan III ja IV sydämen tila, ei tutkittu näissä Actos-kliinisissä tutkimuksissa. Actos-valmistetta ei ole tarkoitettu potilaille, joilla on NYHA-luokan III tai IV sydämen tila.
Actos-valmisteen markkinoille tulon jälkeisessä kokemuksessa kongestiivista sydämen vajaatoimintaa on ilmoitettu potilailla, joilla on aiemmin tunnettu sydänsairaus tai ilman sitä.
Turvotus: Actosia tulee käyttää varoen turvotuspotilailla. Kaikissa Yhdysvaltain kliinisissä tutkimuksissa ödeemaa ilmoitettiin useammin Actosilla hoidetuilla potilailla kuin lumelääkkeellä hoidetuilla potilailla, ja se näyttää olevan riippuvainen annoksesta (ks. HAITTAVAIKUTUKSET). Markkinoille saattamisen jälkeisessä kokemuksessa on saatu raportteja edeeman alkamisesta tai pahenemisesta. Koska tiatsolidiinidionit, mukaan lukien Actos, voivat aiheuttaa nesteretention, joka voi pahentaa tai johtaa kongestiiviseen sydämen vajaatoimintaan, Actosia tulee käyttää varoen potilailla, joilla on sydämen vajaatoiminnan riski. Potilaita on tarkkailtava sydämen vajaatoiminnan oireiden ja oireiden varalta (ks LAATIKKO VAROITUS, VAROITUKSETja VAROTOIMET).
Painon nousu: Annokseen liittyvä painonnousu havaittiin pelkästään Actos-valmisteilla ja yhdessä muiden hypoglykeemisten aineiden kanssa (taulukko 6). Painonnousumekanismi on epäselvä, mutta siihen liittyy todennäköisesti nesteretention ja rasvan kertymisen yhdistelmä.
Taulukko 6 Painon muutokset (kg) perustasoon nähden kaksoissokkoutetuissa kliinisissä tutkimuksissa Actosilla
| Ohjausryhmä (Plasebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| Mediaani (25th/75th persentiili) |
Mediaani (25th/75th persentiili) |
Mediaani (25th/75th persentiili) |
Mediaani (25th/75th persentiili) |
||
| monoterapia | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Yhdistelmähoito | sulfonyyliurea | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| metformiini | -1.4 (-3.2/0.3) n = 160 |
N / A | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| insuliini | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Huomaa: Kokeen kesto 16-16 viikkoa |
Ovulaatio: Actos-hoito, kuten muut tiatsolidiinidionit, voi johtaa ovulaatioon joihinkin premenopausaalisiin anovulatorisiin naisiin. Seurauksena on, että näillä potilailla voi olla lisääntynyt raskausriski Actos-hoidon aikana. Siksi riittävä ehkäisymenetelmä premenopausaalisilla naisilla tulisi suositella. Tätä mahdollista vaikutusta ei ole tutkittu kliinisissä tutkimuksissa, joten tämän esiintymistiheyttä ei tunneta.
Hematologiset: Actos voi aiheuttaa hemoglobiinin ja hematokriitin laskua. Kaikissa kliinisissä tutkimuksissa keskimääräiset hemoglobiiniarvot laskivat 2–4% Actosilla hoidetuilla potilailla. Nämä muutokset tapahtuivat pääasiassa hoidon ensimmäisten 4–12 viikon aikana ja pysyivät suhteellisen vakiona sen jälkeen. Nämä muutokset voivat liittyä lisääntyneeseen plasmamäärään, ja niihin on harvoin liitetty merkittäviä kliinisiä hematologisia vaikutuksia (ks HAITTAVAIKUTUKSET, Laboratorion poikkeavuudet).
Maksan vaikutukset: Hyväksyntää edeltävissä kliinisissä tutkimuksissa kaikkialla maailmassa yli 4500 henkilöä hoidettiin Actosilla. Yhdysvaltain kliinisissä tutkimuksissa yli 4700 tyypin 2 diabetesta sairastavaa potilasta sai Actos-valmistetta. Kliinisissä tutkimuksissa ei ollut näyttöä lääkkeiden aiheuttamasta maksatoksisuudesta tai ALAT-tason noususta.
Hyväksyntää edeltäneiden lumelääkekontrolloitujen kliinisten tutkimusten aikana Yhdysvalloissa yhteensä 4 potilaalla 1526 (0,26%) Actos-hoidolla ja 2: lla 793 (0,25%) plasebohoitoa saaneesta potilaasta ALAT-arvot olivat 3-kertaiset normaali. ALT-arvon nousu Actosilla hoidetuilla potilailla oli palautuvaa eikä liittynyt selvästi Actos-hoitoon.
Actos-valmisteen markkinoille tulon jälkeisessä kokemuksessa on saatu raportteja hepatiitista ja maksaentsyymiarvojen noususta vähintään kolme kertaa normaalin ylärajaan nähden. Hyvin harvoin näihin ilmoituksiin on liittynyt maksan vajaatoimintaa sekä kuolemaan johtavilla tuloksilla että ilman niitä, vaikka syy-yhteyttä ei ole osoitettu.
Ennen kuin saatavana on tuloksia uusista suurista, pitkäaikaisista kontrolloiduista kliinisistä tutkimuksista ja muista markkinoille saattamisen jälkeisistä turvallisuustiedoista suositellaan, että Actosilla hoidetuille potilaille suoritetaan säännöllinen maksan seuranta entsyymejä.
Seerumin ALAT (alaniini-aminotransferaasi) pitoisuudet tulisi arvioida ennen hoidon aloittamista Actos kaikilla potilailla ja määräajoin sen jälkeen terveydenhuollon kliinisen arvioinnin perusteella ammattilainen. Maksan toimintakokeet tulisi hankkia myös potilaille, jos ilmenee maksan toimintahäiriöihin viittaavia oireita, kuten pahoinvointia, oksentelua, vatsakipua, väsymystä, ruokahaluttomuutta tai tummaa virtsaa. Päätöstä potilaan jatkamisesta Actos-hoidolla tulisi ohjata kliinisellä päätöksellä laboratorioarviointeihin asti. Jos havaitaan keltaisuutta, lääkehoito tulee lopettaa.
Actos-hoitoa ei tule aloittaa, jos potilaalla on kliinisiä todisteita aktiivisesta maksasairaudesta tai jos ALAT-arvot ylittävät 2,5-kertaisesti normaalin ylärajan. Potilaat, joilla on lievästi kohonneet maksaentsyymit (ALAT-arvot ovat 1 - 2,5 kertaa normaalin yläraja) klo Perustaso tai mikä tahansa aika Actos-hoidon aikana tulee arvioida maksaentsyymien syyn selvittämiseksi korkeus. Actos-hoidon aloittaminen tai jatkaminen potilailla, joilla on lievästi kohonneet maksaentsyymit, tulee jatkaa ja noudata asianmukaista kliinistä seurantaa, joka voi sisältää useammin maksaentsyymejä seuranta. Jos seerumin transaminaasitasot nousevat (ALAT> 2,5 kertaa normaalin yläraja), maksa toimintatestejä tulisi arvioida useammin, kunnes tasot palautuvat normaaliksi tai esikäsittelyyn arvot. Jos ALAT-tasot ylittävät kolminkertaisesti normin ylärajan, testi tulisi toistaa mahdollisimman pian. Jos ALAT-tasot pysyvät yli 3 kertaa normaalin ylärajan tai jos potilaalla on keltaisuus, Actos-hoito tulee lopettaa.
Makkulaarinen turvotus: Makulaarista turvotusta on ilmoitettu markkinoille tulon jälkeisessä kokemuksessa diabeetikoista, jotka ovat käyttäneet pioglitatsonia tai muuta tiatsolidiinidionia. Joillakin potilailla näön hämärtyminen tai heikentynyt näkökyky on heikentynyt, mutta joillakin potilailla näyttää olevan diagnosoitu rutiininomainen oftalmologinen tutkimus. Joillakin potilailla oli ääreisödeema, kun makulaödeema diagnosoitiin. Joillakin potilailla makulaödeema parani, kun tiatsolidiinidionin käyttö oli lopetettu. Ei tiedetä, onko pioglitatsonin ja makulaödeeman välillä syy-yhteys. Diabetespotilailla tulee olla säännöllinen silmälääketutkimus silmälääkäriltä American Diabetes Associationin hoitostandardien mukaisesti. Lisäksi diabeetikko, joka ilmoittaa minkä tahansa näköoireen, tulee viipymättä lähettää silmälääkärille riippumatta potilaan taustalla olevista lääkkeistä tai muista fyysisistä havainnoista (ks. HAITTAVAIKUTUKSET).
Murtumat: Satunnaistetussa tutkimuksessa (PROactive) tyypin 2 diabeteksen potilailla (keskimääräinen kesto diabetes 9,5 vuotta), luunmurtumien esiintyvyyden lisääntymistä havaittiin naisilla potilailla, jotka käyttivät pioglitatsoni. Keskimääräisen 34,5 kuukauden seurannan aikana naisten luunmurtumien esiintyvyys oli 5,1% (44/870) pioglitatsonilla ja 2,5% (23/905) lumelääkkeellä. Tämä ero havaittiin ensimmäisen hoitovuoden jälkeen ja pysyi tutkimuksen ajan. Suurin osa naispotilailla havaituista murtumista oli ei-selkärankamurtumia, mukaan lukien alaraaja ja distaaliset yläraajat. Pioglitatsonilla hoidetuilla miehillä ei havaittu murtumien lisääntymistä 1,7% (30/1735) verrattuna lumelääkkeeseen 2,1% (37/1728). Murtumisriski tulee ottaa huomioon hoidettaessa potilaita, etenkin naispotilaita, joita hoidetaan pioglitatsonia ja huomiota tulisi kiinnittää luun terveyden arviointiin ja ylläpitämiseen nykyisten standardien mukaisesti hoidosta.
Makrovaskulaariset tulokset: Kliinisissä tutkimuksissa ei ole saatu vakuuttavaa näyttöä makrovaskulaarisen riskin vähentämisestä Actos-valmisteen tai muun diabeteksen vastaisen lääkkeen kanssa.
Laboratoriotestit
FPG ja HbA1c mittaukset tulisi suorittaa määräajoin glykeemisen kontrollin ja Actos-hoidon terapeuttisen vasteen seuraamiseksi.
Maksaentsyymien seurantaa suositellaan ennen Actos-hoidon aloittamista kaikilla potilailla ja säännöllisesti sen jälkeen terveydenhuollon ammattihenkilön kliinisen arvioinnin mukaan (ks. VAROTOIMET, Yleiset, maksan vaikutukset ja HAITTAVAIKUTUKSET, Seerumin transaminaasitasot).
Tietoa potilaille
On tärkeää ohjeistaa potilaita noudattamaan ruokavalio-ohjeita ja tarkistamaan säännöllisesti verensokeri ja glykosyloitu hemoglobiini. Stressin jaksoina, kuten kuume, trauma, infektio tai leikkaus, lääkitystarpeet voivat muuttua, ja potilaita tulisi muistuttaa hakemaan lääkäriä viipymättä.
Potilaat, joilla on epätavallisen nopea painon nousu tai turvotus tai joilla on hengenahdistus tai muut sydämen vajaatoiminnan oireet Actos-hoidon aikana tulee ilmoittaa heti näistä oireista lääkäri.
Potilaille tulisi kertoa, että maksan toiminnan verikokeet suoritetaan ennen hoidon aloittamista ja säännöllisesti sen jälkeen terveydenhuollon ammattihenkilön kliinisen päätöksen perusteella. Potilaita tulisi kehottaa hakemaan välitöntä lääketieteellistä apua selittämättömän pahoinvoinnin, oksentelun, vatsakipujen, väsymyksen, ruokahaluttomuuden tai tumman virtsan varalta.
Potilaita tulisi kehottaa ottamaan Actos kerran päivässä. Actos voidaan ottaa aterian kanssa tai ilman. Jos annos unohdetaan yhtenä päivänä, annosta ei tule kaksinkertaistaa seuraavana päivänä.
Kun käytetään yhdistelmähoitoa insuliinin tai suun kautta annettavien hypoglykeemisten aineiden kanssa, hypoglykemian, sen oireiden ja hoito ja sen kehittymiseen alttiit olosuhteet tulisi selittää potilaille ja heidän perheelleen jäsenet.
Actos-hoito, kuten muut tiatsolidiinidionit, voi johtaa ovulaatioon joillakin premenopausaalisilla anovulatoivilla naisilla. Seurauksena on, että näillä potilailla voi olla lisääntynyt raskausriski Actos-hoidon aikana. Siksi riittävä ehkäisymenetelmä premenopausaalisilla naisilla tulisi suositella. Tätä mahdollista vaikutusta ei ole tutkittu kliinisissä tutkimuksissa, joten tämän esiintymistiheyttä ei tunneta.
Lääkkeiden yhteisvaikutukset
In vivo lääkkeiden ja lääkkeiden yhteisvaikutustutkimukset ovat viitanneet siihen, että pioglitatsoni voi olla heikko CYP 450 -isoformi 3A4-substraatin indusoija (ks. KLIININEN FARMAKOLOGIA, Aineenvaihdunta ja Huumeiden ja lääkkeiden yhteisvaikutukset).
CYP2C8: n entsyymi-inhibiittori (kuten gemfibrosiili) voi lisätä merkittävästi AUC-arvoa pioglitatsoni ja CYP2C8: n entsyymin indusoija (kuten rifampiini) voivat vähentää merkitsevästi pioglitatsoni. Siksi, jos CYP2C8: n estäjä tai indusoija aloitetaan tai lopetetaan pioglitatsonihoidon aikana, diabeteksen hoidossa voidaan tarvita muutoksia kliinisen vasteen perusteella (ks. KLIININEN FARMAKOLOGIA, Huumeiden ja lääkkeiden yhteisvaikutukset).
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kahden vuoden karsinogeenisuustutkimus tehtiin uros- ja naarasrotilla suun kautta annettaviin annoksiin saakka enintään 63 mg / kg (noin 14-kertainen suositeltu enimmäisannos ihmiselle, joka oli 45 mg, perustuen mg / m2). Lääkkeiden aiheuttamia kasvaimia ei havaittu missään elimessä paitsi virtsarakon. Hyvänlaatuisia ja / tai pahanlaatuisia siirtymävaiheen solujen kasvaimia havaittiin urosrotilla annoksella 4 mg / kg / vrk ja enemmän (suunnilleen yhtä suuri kuin suurin suositeltu ihmisen suun kautta annettava annos, joka perustuu mg / m2). Kahden vuoden karsinogeenisuustutkimus tehtiin uros- ja naarashiirille suun kautta annettavina annoksina enintään 100 mg / kg / päivä (suunnilleen 11-kertainen suositellun ihmisen suun kautta otettavan enimmäisannoksen suuruuteen, joka perustuu mg / m2). Lääkkeiden aiheuttamia kasvaimia ei havaittu missään elimessä.
Virtsasytologian arvioinnissa, johon osallistui yli 1800 potilasta, jotka saivat Actosta kliinisissä tutkimuksissa enintään vuoden ajan, ei havaittu uusia virtsarakon kasvaintapauksia. Kahdessa 3-vuotisessa tutkimuksessa, joissa pioglitatsonia verrattiin plaseboon tai glyburidiin, oli 16/3656 (0,44%). raportit virtsarakon syövästä potilailla, jotka käyttävät pioglitatsonia, verrattuna 5/3679 (0,14%) potilaille, jotka eivät pioglitatsoni. Sen jälkeen, kun potilaat, joille altistuminen tutkitulle lääkkeelle oli alle vuosi rakon syövän diagnosoinnin yhteydessä, suljettiin pois, pioglitatsonilla oli kuusi (0,16%) ja lumelääkkeellä kaksi (0,05%).
Pioglitatsoni-HCl ei ollut mutageeninen geneettisissä toksikologisissa tutkimuksissa, mukaan lukien Ames-bakteerimääritys, nisäkässolujen eteengeeni mutaatiomääritys (CHO / HPRT ja AS52 / XPRT), in vitro sytogenetiikkamääritys, joka käyttää CHL-soluja, ajoittamaton DNA-synteesimääritys ja in vivo mikrotuuma määritys.
Uros- ja naarasrotilla ei havaittu haitallisia vaikutuksia hedelmällisyyteen suun kautta annettavien pioglitatsoni-HCl-annosten ollessa 40 mg / kg päivittäin ennen parittelua ja raskauden aikana ja sen aikana (suunnilleen 9-kertainen suurin ihmisille suositeltu suurin suun kautta otettava annos, joka perustuu mg / m2).
Eläinten toksikologia
Sydämen laajentumista on havaittu hiirillä (100 mg / kg), rotilla (4 mg / kg ja enemmän) ja koirilla (3 mg / kg), joita hoidettiin suun kautta pioglitatson HCl (noin 11, 1 ja 2 kertaa suurin ihmisille suositeltu oraalinen annos hiirille, rotille ja koirille, vastaavasti) perustuen mg / m2). Yhden vuoden rottitutkimuksessa huumeisiin liittyvä varhainen kuolema ilmeisen sydämen toimintahäiriön vuoksi tapahtui oraalinen annos 160 mg / kg / vrk (noin 35 kertaa suurin suositeltu ihmisen suun kautta otettava annos, joka perustuu annokseen mg / m2). Sydämen laajentumista havaittiin 13 viikkoa kestäneessä tutkimuksessa apinoilla suun kautta annettavin annoksina 8,9 mg / kg tai enemmän (suunnilleen 4-kertainen ihmisen suurimpaan suositeltuun suun kautta annettavaan annokseen, joka perustuu mg / m2), mutta ei 52 viikon tutkimuksessa suun kautta annettaviin annoksiin, jotka ovat korkeintaan 32 mg / kg (noin 13 kertaa suurin suositeltu ihmisen suun kautta otettava annos, joka perustuu mg / m2).
raskaus
Raskausluokka C. Pioglitatsoni ei ollut teratogeeninen rotilla suun kautta annettavissa annoksissa 80 mg / kg saakka tai kaniineilla, jotka annettiin korkeintaan 160 mg mg / kg organogeneesin aikana (noin 17 ja 40 kertaa suurin suositeltu ihmisen suun kautta otettava annos perustuen annoksella mg / m2, vastaavasti). Viivästyneet synnytykset ja alkiotoksisuus (kuten osoittavat lisääntyneet implantaation jälkeiset menetykset, viivästynyt kehitys ja sikiön painon väheneminen) havaittiin rotilla suun kautta annettavin annoksina 40 mg / kg / päivä tai enemmän (noin 10 kertaa suurin ihmisen suositeltu suun kautta annettava annos, joka perustuu annokseen mg / m2). Rotien jälkeläisillä ei havaittu toiminnallista tai käyttäytymismyrkyllisyyttä. Kaneilla alkiotoksisuutta havaittiin suun kautta annettaessa 160 mg / kg (noin 40 kertaa ihmisen suositeltu enimmäisannos, joka perustuu mg / m2). Rotan jälkeläisillä havaittiin viivästynyttä synnytyksen jälkeistä kehitystä, jonka katsottiin vähentyneeseen ruumiinpainoon, suun kautta annettavilla 10 mg / kg annoksilla ja yli sen myöhäisillä raskauden ja imetyksen aikana (suunnilleen kaksi kertaa suurin ihmisille suositeltu suun kautta otettava enimmäisannos, joka perustuu mg / m2).
Raskaana olevilla naisilla ei ole riittäviä ja hyvin kontrolloituja tutkimuksia. Actosia tulisi käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan vaaran.
Koska nykyiset tiedot viittaavat voimakkaasti siihen, että epätavalliset verensokeritasot raskauden aikana liittyvät myös synnynnäisten poikkeavuuksien esiintymiseen, Koska vastasyntyneiden sairastuvuus ja kuolleisuus lisääntyvät, useimmat asiantuntijat suosittelevat insuliinin käyttöä raskauden aikana verensokeriarvojen ylläpitämiseksi normaalin lähellä mahdollista.
Imettävät äidit
Pioglitatsoni erittyy imettävien rottien maitoon. Ei tiedetä erittyykö Actos äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, Actosta ei tule antaa imettävälle naiselle.
Lasten käyttö
Actos-valmisteen turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Vanhukset
Noin 500 potilasta plasebokontrolloiduissa Actos-kliinisissä tutkimuksissa oli 65-vuotiaita ja sitä vanhempia. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu merkittäviä eroja tehokkuudessa ja turvallisuudessa.
ylin
Haitalliset reaktiot
Yli 8500 tyypin 2 diabetesta sairastavaa potilasta on hoidettu Actos-valmisteella satunnaistetuissa, kaksoissokkoutetuissa, kontrolloiduissa kliinisissä tutkimuksissa. Tähän sisältyy 2605 korkean riskin potilasta, joilla on tyypin 2 diabetes, ja joita on hoidettu Actos-valmisteella PROactive-kliinisestä tutkimuksesta. Yli 6000 potilasta on hoidettu vähintään 6 kuukauden ajan ja yli 4500 potilasta yhden vuoden ajan tai kauemmin. Yli 3000 potilasta on saanut Actosta vähintään kahden vuoden ajan.
Taulukossa 7 on esitetty haittatapahtumien kokonaismäärä ja tyypit plasebokontrolloiduissa kliinisissä tutkimuksissa, joissa Actos-monoterapiaa annettiin 7,5 mg, 15 mg, 30 mg tai 45 mg kerran vuorokaudessa.
Taulukko 7 Plasebokontrolloidut Actos-monoterapian kliiniset tutkimukset: Haittavaikutukset ilmoitettiin taajuudella - 5% Actosilla hoidetuista potilaista
| (% potilaista) | ||
| Plasebo N = 259 |
Actos N = 606 |
|
| Ylähengitysteiden infektio | 8.5 | 13.2 |
| Päänsärky | 6.9 | 9.1 |
| poskiontelotulehdus | 4.6 | 6.3 |
| lihaskipu | 2.7 | 5.4 |
| Hammassairaus | 2.3 | 5.3 |
| Diabetes Mellitus pahenee | 8.1 | 5.1 |
| Nielutulehdus | 0.8 | 5.1 |
Useimpien kliinisten haittavaikutusten ilmaantuvuus oli samanlainen ryhmissä, joita hoidettiin Actos-monoterapialla, ja ryhmillä, joita hoidettiin yhdessä sulfonyyliureoiden, metformiinin ja insuliinin kanssa. Turvotusten esiintyminen potilailla, joita hoidettiin Actosilla ja insuliinilla, kasvoi verrattuna pelkästään insuliiniin.
16 viikon lumelääkekontrolloidussa Actos plus -insuliinitutkimuksessa (n = 379) 10 potilasta hoidettiin Actos plus -hoidolla insuliinilla kehittyi hengenahdistus ja myös jossain vaiheessa hoidon aikana joko painonmuutos tai turvotus. Seitsemän näistä 10 potilaasta sai diureetteja näiden oireiden hoitamiseksi. Tätä ei raportoitu insuliini plus lumelääkeryhmässä.
Muiden haittatapahtumien kuin hyperglykemian takia lopetettujen lumekontrolloitujen kliinisten tutkimusten vetäytyminen oli samanlainen lumelääkettä (2,8%) tai Actosia (3,3%) saaneiden potilaiden kanssa.
Kontrolloiduissa yhdistelmähoitotutkimuksissa, joissa käytettiin joko sulfonyyliureaa tai insuliinia, raportoitiin lievä tai kohtalainen hypoglykemia, joka näyttää olevan riippuvainen annoksesta (ks. VAROTOIMET, Yleinen, hypoglykemia ja Annostelu ja hallinnointi, Yhdistelmähoito).
Yhdysvaltain kaksoissokkotutkimuksissa anemiaa ilmoitettiin 2%: lla potilaista, joita hoidettiin Actosilla plus sulfonyyliurea, metformiini tai insuliini (ks. VAROTOIMET, Yleinen, hematologinen).
Monoterapiatutkimuksissa ödeemaa ilmoitettiin 4,8%: lla (annoksilla 7,5 mg - 45 mg) Actosilla hoidetuista potilaista ja 1,2%: lla plaseboa saaneista potilaista. Yhdistelmähoitotutkimuksissa ödeemaa ilmoitettiin 7,2%: lla Actos- ja sulfonyyliureoilla hoidetuista potilaista, kun taas 2,1%: lla pelkästään sulfonyyliureoita saaneista potilaista. Yhdistelmähoitotutkimuksissa metformiinin kanssa edeemaa ilmoitettiin 6,0%: lla yhdistelmähoitoa saaneista potilaista verrattuna 2,5%: iin pelkästään metformiinia saaneista potilaista. Yhdistelmähoitotutkimuksissa insuliinin kanssa turvotusta raportoitiin 15,3%: lla yhdistelmähoitoa saaneista potilaista ja 7,0%: lla pelkästään insuliinia saaneista potilaista. Suurinta osaa näistä tapahtumista pidettiin lievinä tai kohtalaisina (ks VAROTOIMET, Kenraali, turvotus).
Yhdessä 16 viikon kliinisessä insuliinin ja Actos-yhdistelmähoidon tutkimuksessa useammalle potilaalle kehittyi kongestiivinen sydämen vajaatoiminta yhdistelmähoidon yhteydessä (1,1%), kun ei yksinään insuliinilla (ks. Ks.) VAROITUKSET, Sydämen vajaatoiminta ja muut sydänvaikutukset).
Tulevaisuuden kliininen tutkimus pioglitatsonista makrovaskulaarisissa tapahtumissa (proaktiivinen)
PROaktiivisessa tutkimuksessa oli 5238 tyypin 2 diabetesta sairastavaa potilasta, joilla oli aikaisempi makrovaskulaarinen sairaus käsitelty Actosilla (n = 2605), titrattu voimalla 45 mg: aan vuorokaudessa tai lumelääkkeellä (n = 2633) standardin lisäksi hoidosta. Lähes kaikki koehenkilöt (95%) saivat sydänlääkkeitä (beetasalpaajat, ACE-estäjät, ARB: t, kalsiumkanavasalpaajat, nitraatit, diureetit, aspiriini, statiinit, fibraatit). Potilaiden keskimääräinen ikä oli 61,8 vuotta, diabeteksen kesto 9,5 vuotta ja keskimääräinen HbA1c 8,1%. Keskimääräinen seurannan kesto oli 34,5 kuukautta. Tämän tutkimuksen ensisijaisena tavoitteena oli tutkia Actosin vaikutusta kuolleisuuteen ja makrovaskulaarinen sairastuvuus potilailla, joilla on tyypin 2 diabetes mellitus ja joilla oli suuri riski makrovaskulaariset tapahtumat. Ensisijainen tehomuuttuja oli aika minkä tahansa tapahtuman ensimmäiseen esiintymiseen sydän- ja verisuonikomposiitti-päätepisteessä (katso taulukko 8 alla). Vaikka Actos- ja lumelääkeryhmissä ei ollut tilastollisesti merkitsevää eroa 3-vuotisessa esiintymistiheydessä Ensimmäinen tapahtuma tässä yhdistelmässä, kuolleisuus tai makrovaskulaaristen tapahtumien kokonaismäärä ei lisääntynyt Actos.
Taulukko 8 Kunkin komponentin ensimmäisten ja kokonaistapahtumien lukumäärä sydän- ja verisuonikomposiittipäätepisteessä
| Plasebo N = 2633 |
Actos N = 2605 |
|||
| Sydän- ja verisuonitapahtumat | Ensimmäiset tapahtumat (N) |
Tapahtumia yhteensä (N) |
Ensimmäiset tapahtumat (N) |
Tapahtumia yhteensä (N) |
| Mikä tahansa tapahtuma | 572 | 900 | 514 | 803 |
| Kaikki syykuolleisuus | 122 | 186 | 110 | 177 |
| Ei kuolemaan johtava MI | 118 | 157 | 105 | 131 |
| tahti | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Sydänhoito | 101 | 240 | 101 | 195 |
| Suurin jalan amputaatio | 15 | 28 | 9 | 28 |
| Jalkojen revaskularisaatio | 57 | 92 | 71 | 115 |
Markkinoille saattamisen jälkeen on myös saatu raportteja uusiin puhkeamista tai pahenemisesta diabeettisesta makulaödeemisesta, jonka näkökyky on heikentynyt (ks. VAROTOIMET, Yleinen, makulaarinen turvotus).
Laboratorion poikkeavuudet
Hematologiset: Actos voi aiheuttaa hemoglobiinin ja hematokriitin laskua. Hemoglobiinin ja hematokriitin lasku Actos-valmisteen kanssa näyttää vaikuttavan annokseen. Kaikissa kliinisissä tutkimuksissa keskimääräiset hemoglobiiniarvot laskivat 2–4% Actosilla hoidetuilla potilailla. Nämä muutokset tapahtuivat yleensä ensimmäisen 4 - 12 terapiaviikon aikana ja pysyivät suhteellisen vakaina sen jälkeen. Nämä muutokset voivat liittyä Actos-terapiaan liittyvään lisääntyneeseen plasmamäärään, ja niihin on harvoin liitetty merkittäviä hematologisia kliinisiä vaikutuksia.
Seerumin transaminaasitasot: Kaikissa Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa 14: lla 4780 (0,30%) potilaalla, joita hoidettiin Actos-valmisteella, ALAT-arvot olivat â ‰ 3-kertaiset normaalin ylärajaan hoidon aikana. Kaikilla potilailla, joilla seurannan arvo oli, ALAT-arvon nousu oli palautuvaa. Actosilla hoidettujen potilaiden joukossa bilirubiinin, ASAT: n, ALAT: n, alkalisen fosfataasin ja GGT: n keskiarvot laskivat viimeisessä käyndessä verrattuna lähtötilanteeseen. Alle 0,9% Actos-hoitoa saaneista potilaista lopetettiin kliinisissä tutkimuksissa Yhdysvalloissa maksan toimintakokeiden epänormaalisuuden vuoksi.
Hyväksyntää edeltävissä kliinisissä tutkimuksissa ei ollut tapauksia idiosykraattisista lääkereaktioista, jotka johtaisivat maksan vajaatoimintaan (ks VAROTOIMET, Yleiset, maksan vaikutukset).
CPK-tasot: Kliinisissä tutkimuksissa vaadittujen laboratoriotestien aikana havaittiin satunnaisia, ohimeneviä kreatiinifosfokinaasitasojen (CPK) nousuja. Eristetty korkeus yli 10-kertaiseen normin ylärajaan havaittiin 9 potilaalla (arvot 2150 - 11400 IU / L). Kuusi näistä potilaista jatkoi Actos-hoidon saamista, kaksi potilasta oli suorittanut tutkimuksen lääkitys kohonneen arvon aikaan ja yksi potilas keskeytti tutkimuslääkityksen korkeus. Nämä kohotukset hävisivät ilman näkyviä kliinisiä seurauksia. Näiden tapahtumien suhdetta Actos-terapiaan ei tunneta.
ylin
yliannos
Kontrolloiduissa kliinisissä tutkimuksissa raportoitiin yksi Actosin yliannostus. Miespotilas otti 120 mg päivässä neljän päivän ajan, sitten 180 mg päivässä seitsemän päivän ajan. Potilas kiisti kliiniset oireet tänä aikana.
Yliannostuksen yhteydessä on aloitettava asianmukainen tukihoito potilaan kliinisten oireiden ja oireiden mukaan.
ylin
Annostelu ja hallinnointi
Actos tulee ottaa kerran päivässä ateriaista riippumatta.
Diabeteslääkityksen hoito tulee räätälöidä. Ihannetapauksessa hoitovaste tulisi arvioida HbA: lla1c mikä on parempi indikaattori pitkäaikaisessa glykeemisessä kontrollissa kuin pelkästään FPG. HbA1c heijastaa glykemiaa viimeisen kahden tai kolmen kuukauden aikana. Kliinisessä käytössä suositellaan, että potilaita hoidetaan Actos-valmisteella riittävän pitkän ajanjakson ajan HbA: n muutoksen arvioimiseksi1c (kolme kuukautta), ellei glykeeminen hallinta huonone. Actos-hoidon aloittamisen jälkeen tai annoksen suurentamisen jälkeen potilaita tulee tarkkailla huolellisesti nesteretentioon liittyvien haittavaikutusten varalta (ks LAATIKKO VAROITUS ja VAROITUKSET).
monoterapia
Actos-monoterapia voidaan aloittaa annoksilla 15 mg tai 30 mg kerran vuorokaudessa potilaille, joita ei riittävästi hallita ruokavalion ja liikunnan kanssa. Potilaille, jotka reagoivat riittämättömästi Actos-aloitusannokseen, annosta voidaan suurentaa kerrallaan 45 mg: aan kerran päivässä. Yhdistelmähoitoa tulee harkita potilaille, jotka eivät reagoi riittävän monoterapiaan.
Yhdistelmähoito
Sulfonyyliureat: Actos voidaan yhdistää sulfonyyliurean kanssa annoksella 15 mg tai 30 mg kerran päivässä. Nykyistä sulfonyyliurea-annosta voidaan jatkaa Actos-hoidon aloittamisen yhteydessä. Jos potilaat ilmoittavat hypoglykemian, sulfonyyliurean annosta tulee pienentää.
Metformiini: Actos-valmisteen yhdistelmä metformiinin kanssa voidaan aloittaa annoksella 15 mg tai 30 mg kerran päivässä. Nykyistä metformiiniannosta voidaan jatkaa Actos-hoidon aloittamisen yhteydessä. On epätodennäköistä, että metformiinin annos tarvitsee säätää hypoglykemian vuoksi Actos-yhdistelmähoidon aikana.
Insuliini: Actos-valmisteen käyttö yhdessä insuliinin kanssa voidaan aloittaa annoksella 15 mg tai 30 mg kerran päivässä. Nykyistä insuliiniannosta voidaan jatkaa Actos-hoidon aloittamisen yhteydessä. Actos-insuliinia ja insuliinia saaneilla potilailla insuliiniannosta voidaan pienentää 10–25%, jos potilas ilmoittaa hypoglykemiasta tai jos plasman glukoosipitoisuus laskee alle 100 mg / dl. Lisäsäädöt tulisi räätälöidä glukoosipitoisuutta alentavan vasteen perusteella.
Suurin suositeltava annos
Actos-annos ei saisi ylittää 45 mg kerran päivässä monoterapiana tai yhdessä sulfonyyliurean, metformiinin tai insuliinin kanssa.
Annoksen muuttamista munuaisten vajaatoiminnasta kärsiville potilaille ei suositella (ks KLIININEN FARMAKOLOGIA, Farmakokinetiikka ja lääkeaineenvaihdunta).
Actos-hoitoa ei tule aloittaa, jos potilaalla on kliinisiä todisteita aktiivisesta maksasairaudesta tai kohonneet seerumin transaminaasitasot (ALAT yli 2,5 kertaa normaalin yläraja) hoidon alussa (katso VAROTOIMET, Yleiset, maksan vaikutukset ja KLIININEN FARMAKOLOGIA, Erityiset populaatiot, maksan vajaatoiminta). Maksaentsyymien seurantaa suositellaan kaikille potilaille ennen Actos-hoidon aloittamista ja määräajoin sen jälkeen (ks VAROTOIMET, Yleiset, maksan vaikutukset).
Actos-valmisteen käytöstä alle 18-vuotiailla potilailla ei ole tietoa; siksi Actos-valmisteen käyttöä lapsipotilaille ei suositella.
Actos-valmisteen käytöstä yhdessä toisen tiatsolidiinidionin kanssa ei ole tietoa.
ylin
Kuinka toimitetaan
Actos on saatavana 15 mg, 30 mg ja 45 mg tabletteina seuraavasti:
15 mg: n tabletti: valkoinen tai luonnonvalkoinen, pyöreä, kupera, jakoleimaton tabletti, jonka toisella puolella on "Actos" ja toisella "15", saatavana seuraavilla kielillä:
NDC 64764-151-04 30 pulloa
NDC 64764-151-05 90 pulloa
NDC 64764-151-06 500 pulloa
30 mg: n tabletti: valkoinen tai luonnonvalkoinen, pyöreä, litteä, jakoleimaton tabletti, jonka toisella puolella on "Actos" ja toisella "30", saatavana seuraavilla kielillä:
NDC 64764-301-14 30 pullon pullot
NDC 64764-301-15 90 pulloa
NDC 64764-301-16 500 pulloa
45 mg: n tabletti: valkoinen tai luonnonvalkoinen, pyöreä, litteä, jakoleimaton tabletti, jonka toisella puolella on "Actos" ja toisella "45", saatavana seuraavilla kielillä:
NDC 64764-451-24 pullot 30 kpl
NDC 64764-451-25 90 pulloa
NDC 64764-451-26 pullot 500
VARASTOINTI
Varastoi 25 ° C: ssa (77 ° F); matkat sallitaan lämpötilaan 15-30 ° C (59-86 ° F) [katso USP: n kontrolloima huoneenlämpötila]. Pidä astia tiiviisti suljettuna ja suojaa kosteudelta.
ylin
Viitteet
- Deng, LJ, et ai. Gemfibrosiilin vaikutus pioglitatsonin farmakokinetiikkaan. Eur J Clin Pharmacol 2005; 61: 831 - 836, taulukko 1.
2. Jaakkola, T, et ai. Rifampisiinin vaikutus pioglitatsonin farmakokinetiikkaan. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Vain Rx
Valmistanut:
Takedan lääkeyhtiö
Osaka, Japani
Markkinoi:
Takeda Pharmaceuticals America, Inc.
Yksi Takeda Parkway
Deerfield, IL 60015
Actos® on Takeda Pharmaceutical Company Limitedin rekisteröity tavaramerkki ja jota Takeda Pharmaceuticals America, Inc. käyttää lisenssillä.
Kaikki muut tavaramerkkinimet ovat omistajiensa omaisuutta.
Viimeisin päivitys: 8.9
Actos, pioglitazone hcl, potilastiedot (selkeästi englanniksi)
Yksityiskohtaiset tiedot diabeteksen oireista, oireista, syistä ja hoidoista
Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötapoja, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysymyksiä käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta.
takaisin: Selaa kaikkia diabeteksen lääkkeitä

