Byetta diabeteksen hoitoon
Tuotemerkki: Byetta
Yleinen nimi: Exenatide
Annosmuoto: injektio
Sisällys:
Kuvaus
Kliininen farmakologia
Kliiniset tutkimukset
Käyttöaiheet ja käyttö
Vasta
varotoimet
Haitalliset reaktiot
yliannostus
Annostelu ja hallinnointi
varastointi
Kuinka toimitetaan
Byetta (Exenatide) -potilastiedot (selkeästi englanniksi)
Kuvaus
Byetta® (eksenatidi) on synteettinen peptidi, jolla on inkretiinimimeettisiä vaikutuksia ja joka tunnistettiin alun perin lisko Heloderma kahtia -lajissa. Byetta lisää haiman beeta-solun glukoosiriippuvaista insuliinin eritystä, estää epäasianmukaisesti kohonneen glukagonin erityksen ja hidastaa mahalaukun tyhjentymistä. Eksenatidi eroaa kemiallisesta rakenteesta ja farmakologisesta vaikutuksesta insuliinista, sulfonyyliureoista (mukaan lukien D-fenyylialaniinijohdannaiset ja meglitinidit), biguanidit, tiatsolidiinidionit ja alfa-glukosidaasi inhibiittorit.
Exenatide on 39 aminoamiinihappopeptidiamidi. Exenatidella on empiirinen kaava C184H282N50O60S ja molekyylipaino 4186,6 daltonia. Eksenatidin aminohapposekvenssi esitetään alla.
H - Hän - Gly - Glu - Gly - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gln - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ile - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Ser - NH2
Byetta toimitetaan ihonalaista (SC) injektiota varten steriilinä, säilötynä isotonisena liuoksena lasisäiliössä, joka on koottu kynän injektoriin (kynään). Jokainen millilitra (ml) sisältää 250 mikrogrammaa (mcg) synteettistä eksenatidia, 2,2 mg metakresolia antimikrobisena säilöntäaineena, mannitolia toonisuutta säätelevänä aineena ja jääetikkahappo ja natriumasetaattitrihydraatti injektionesteessä olevassa vedessä puskuriliuoksena, jonka pH on 4,5. Kaksi esitäytettyä kynää on saatavana 5 mcg: n yksikköannoksina 10 mikrogrammaa. Jokainen esitäytetty kynä antaa 60 annosta antamaan 30 päivää kahdesti päivässä (BID).
ylin
Kliininen farmakologia
Toimintamekanismi
Inkretiinit, kuten glukagonin kaltainen peptidi-1 (GLP-1), tehostavat glukoosiriippuvaista insuliinin eritystä ja osoittavat muita antihyperglykeemisiä vaikutuksia sen jälkeen kun ne vapautuvat verenkiertoon suolistosta. Exenatidi on inkretiinia jäljittelevä aine, joka jäljittelee glukoosiriippuvaisen insuliinin erityksen tehostamista ja useita muita inkretiinien antihyperglykeemisiä vaikutuksia.
Exenatidin aminohapposekvenssi on osittain päällekkäinen ihmisen GLP-1: n kanssa. Exenatidin on osoitettu sitoutuvan ja aktivoivan ihmisen tunnettua GLP-1-reseptoria in vitro. Tämä johtaa sekä glukoosiriippuvaisen insuliinin synteesin että in vivo -insuliinin lisääntymiseen haiman beeta-soluista mekanismeilla, joihin sisältyy syklinen AMP ja / tai muu solunsisäinen signalointi reittejä. Exenatide edistää insuliinin vapautumista beeta-soluista, jos korkeat glukoosipitoisuudet ovat läsnä. Annettuna in vivo, eksenatidi jäljittelee tiettyjä GLP-1: n antihyperglykeemisiä vaikutuksia.
Byetta parantaa glykeemistä hallintaa vähentämällä paasto- ja aterian jälkeisiä glukoosipitoisuuksia tyypin 2 diabeteksen potilailla alla kuvattujen toimien avulla.
Glukoosiriippuvainen insuliinieritys: Byetalla on akuutteja vaikutuksia haiman beeta-solujen reagointiin glukoosiin ja johtaa insuliinin vapautumiseen vain korkeiden glukoosipitoisuuksien ollessa läsnä. Tämä insuliinieritys vähenee, kun verensokeripitoisuudet vähenevät ja lähestyy euglysemiaa.
Ensimmäisen vaiheen insuliinivaste: Terveillä yksilöillä voimakas insuliinin eritys tapahtuu laskimonsisäisen (IV) glukoosiannoksen jälkeen ensimmäisten 10 minuutin aikana. Tämä eritys, joka tunnetaan nimellä "ensimmäisen vaiheen insuliinivaste", puuttuu tyypillisesti tyypin 2 diabeteksen potilailla. Ensimmäisen vaiheen insuliinivasteen menetys on varhainen beeta-soluvirhe tyypin 2 diabeteksessa. Byetta-annoksen antaminen terapeuttisissa plasmakonsentraatioissa palautti ensimmäisen vaiheen insuliinivasteen glukoosin IV-bolukseen potilailla, joilla oli tyypin 2 diabetes (kuva 1). Sekä ensimmäisen vaiheen insuliinieritys että toisen vaiheen insuliinieritys lisääntyivät merkitsevästi tyypin 2 diabeteksen potilailla, joita hoidettiin Byetta-valmisteella, suolaliuoksella (p
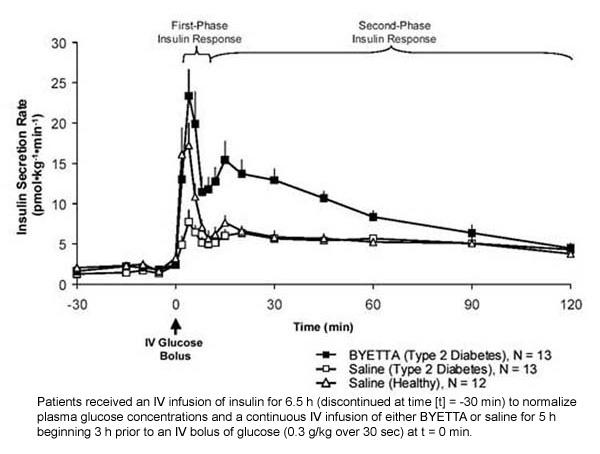
Kuvio 1: Keskimääräinen (+ SEM) insuliinin erityksenopeus Byetta- tai suolaliuosinfuusion aikana potilailla, joilla on tyypin 2 diabetes, ja suolaliuosinfuusion aikana terveillä koehenkilöillä
Glukagonin eritys: Tyypin 2 diabeteksen potilailla Byetta hillitsee glukagonin eritystä ja alentaa seerumin glukagonipitoisuuksia hyperglykemian aikana. Matalammat glukagonipitoisuudet johtavat vähentyneeseen maksan glukoosin tuotantoon ja vähentyneeseen insuliinin tarpeeseen. Byetta ei kuitenkaan heikennä normaalia glukagonivastetta hypoglykemiaan.
Mahalaukun tyhjennys: Byetta hidastaa mahalaukun tyhjentymistä, vähentäen siten aterioista peräisin olevan glukoosin ilmaantuvuutta verenkiertoon.
Ruoan saanti: Exenatidin antamisen on osoitettu vähentävän ruoan saantia sekä eläimillä että ihmisillä.
farmakokinetiikkaa
imeytyminen
Kun SC oli annettu tyypin 2 diabeetikoille, eksenatidi saavuttaa keskimääräiset huippupitoisuudet plasmassa 2,1 tunnissa. Eksenatidien keskimääräinen huippupitoisuus (Cmax) oli 211 pg / ml ja kokonaiskeskimääräinen pinta-ala käyrän alla (AUC0-inf) oli 1036 pg-h / ml sen jälkeen, kun SC annettiin 10 mikrogramman Byetta-annosta. Eksenatidi-altistus (AUC) kasvoi suhteellisesti terapeuttisen annosalueen 5 - 10 mikrog välillä. Cmax-arvot nousivat vähemmän kuin suhteellisesti samalla alueella. Samanlainen altistuminen saavutetaan, kun Byettaa annetaan SC: llä vatsassa, reidessä tai käsivarressa.
Jakelu
Exenatidin keskimääräinen näennäinen jakautumistilavuus SC: n annon jälkeen yhdellä Byetta-annoksella on 28,3 L.
Aineenvaihdunta ja eliminaatio
Ei-kliiniset tutkimukset ovat osoittaneet, että eksenatidi eliminoituu pääasiassa glomerulaarisuodatuksella, jota seuraa proteolyyttinen hajoaminen. Keskimääräinen eksenatidin puhdistuma ihmisillä on 9,1 l / h ja keskimääräinen terminaalinen puoliintumisaika on 2,4 tuntia. Nämä eksenatidin farmakokineettiset ominaisuudet ovat riippumattomia annoksesta. Useimmissa yksilöissä eksenatidipitoisuudet ovat mitattavissa noin 10 tuntia annoksen jälkeen.
Erityisväestöt
Munuaisten vajaatoiminta
Potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta (kreatiniinipuhdistuma 30 - 80 ml / min), eksenatidipuhdistuma laski vain lievästi; Sen vuoksi Byetta-valmisteen annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Dialyysihoitoa saavilla potilailla, joilla on loppuvaiheen munuaissairaus, keskimääräinen eksenatidipuhdistuma pienenee 0,9 l / h verrattuna terveisiin koehenkilöihin 9,1 l / h (ks. VAROTOIMET, Yleinen).
Maksan vajaatoiminta
Farmakokineettisiä tutkimuksia ei ole tehty potilailla, joilla on diagnosoitu akuutti tai krooninen maksan vajaatoiminta. Koska eksenatidi poistuu pääasiassa munuaisten kautta, maksan vajaatoiminnan ei odoteta vaikuttavan eksenatidin pitoisuuksiin veressä (ks. farmakokinetiikkaa, Aineenvaihdunta ja eliminaatio).
geriatrinen
Potilaiden populaatiofarmakokineettinen analyysi (vaihteluväli 22 - 73 vuotta) viittaa siihen, että ikä ei vaikuta eksenatidin farmakokineettisiin ominaisuuksiin.
pediatrinen
Exenatidea ei ole tutkittu lapsipotilailla.
sukupuoli
Mies- ja naispotilaiden populaatiofarmakokineettinen analyysi viittaa siihen, että sukupuoli ei vaikuta eksenatidin jakautumiseen ja eliminaatioon.
Rotu
Potilaiden, mukaan lukien valkoihoiset, latinalaisamerikkalaiset ja mustat, populaatiofarmakokineettinen analyysi viittaa siihen, että rodulla ei ole merkittävää vaikutusta eksenatidin farmakokinetiikkaan.
liikalihavuus
Liikalihavien (BMI - 30 kg / m2) ja liikalihamattomien potilaiden farmakokineettinen analyysi viittaa siihen, että liikalihavuudella ei ole merkittävää vaikutusta eksenatidin farmakokinetiikkaan.
Huumeiden yhteisvaikutukset
Digoksiini
Toistuvien Byetta-annosten samanaikainen käyttö (10 ug BID) laski C: tämax oraalisen digoksiinin (0,25 mg QD) 17%: lla ja viivästynyt Tmax noin 2,5 tunnilla; yleinen vakaan tilan farmakokineettinen altistus (AUC) ei kuitenkaan muuttunut.
lovastatiini
Lovastatiinin AUC laski noin 40% ja Cmax 28%, ja Tmax viivästyi noin 4 tuntia, kun Byetta (10 mikrogrammaa kahdesti vuorokaudessa) annettiin samanaikaisesti kerta-annoksena lovastatiinia (40 mg) verrattuna annettuun lovastatiiniin yksin. Byetan 30 viikon kontrolloiduissa kliinisissä tutkimuksissa Byetan käyttö potilaille, jotka jo saavat HMG: tä CoA-reduktaasinestäjiin ei liittynyt lipidiprofiilien jatkuvia muutoksia verrattuna lähtötilanteessa.
lisinopriili
Potilailla, joilla lievä tai kohtalainen verenpaine pysyi vakaana lisinopriilillä (5 - 20 mg / vrk), Byetta (10 mikrogrammaa kahdesti vuorokaudessa) ei muuttanut lisinopriilin vakaan tilan Cmax- tai AUC-arvoa. Lisinopriili vakaan tilan Tmax viivästyi 2 h. 24 tunnin keskimääräisessä systolisessa ja diastolisessa verenpaineessa ei tapahtunut muutoksia.
Parasetamoli
Kun 1000 mg asetaminofeenieliksiiriä annettiin 10 mcg Byetta (0 h) ja 1 h, 2 h ja 4 h Byetta injektion jälkeen, asetaminofeenin AUC laski vastaavasti 21%, 23%, 24% ja 14%; Cmax laski vastaavasti 37%, 56%, 54% ja 41%; Tmax kasvatettiin 0,6 tunnista kontrollointijaksolla vastaavasti 0,9 tuntiin, 4,2 tuntiin, 3,3 tuntiin ja 1,6 tuntiin. Asetaminofeeni AUC, Cmax ja Tmax eivät muuttuneet merkittävästi, kun asetaminofeenia annettiin 1 tunti ennen Byetta-injektiota.
varfariini
Toistuvien Byetta-annosten (5 ug BID päivinä 1-2 ja 10 µg BID päivinä 3-9) samanaikainen anto terveille vapaaehtoisille, varfariinin (25 mg) Tmax-arvo viivästyi noin 2 tunnilla. Varfariinin S- ja R-enantiomeerien Cmax-arvoon tai AUC-arvoon ei havaittu kliinisesti merkittäviä vaikutuksia. Byetta ei muuttanut varfariinin farmakodynaamisia ominaisuuksia (INR-vasteen perusteella arvioituna).
farmakodynamiikka
Postprandial glukoosi
Tyypin 2 diabeteksen potilailla Byetta vähentää ruokailun jälkeisiä plasman glukoosikonsentraatioita (kuva 2).
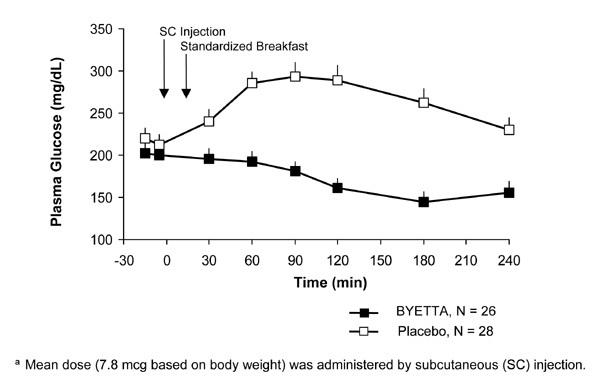
Kuvio 2: Keskimääräiset (+ SEM) aterian jälkeiset plasman glukoosipitoisuudet Byetta-päivän ensimmäisenä päivänä Hoito potilailla, joiden tyypin 2 diabetes on hoidettu metformiinilla, sulfonyyliurealla tai molemmilla (N = 54)
Paasto-glukoosi
Yhden annoksen ristiintutkimuksessa tyypin 2 diabeetikoilla ja paasto-hyperglykemiapotilailla, Byetta-injektio seurasi välittömästä insuliinin vapautumisesta. Plasman glukoosipitoisuudet pienenivät merkittävästi Byetta-valmisteessa verrattuna lumelääkkeeseen (kuvio 3).

Kuva 3: Seerumin insuliinin ja plasman glukoosin keskimääräiset (+ SEM) pitoisuudet Byetta-kerta-injektion jälkeen tai lumelääke paastopotilailla, joilla on tyypin 2 diabetes (N = 12)
ylin
Kliiniset tutkimukset
Käytetään metformiinin ja / tai sulfonyyliurean kanssa
Suoritettiin kolme 30 viikon kaksoissokkotutkimusta, lumekontrolloitua tutkimusta Byetta-valmisteen turvallisuuden ja tehon arvioimiseksi tyypin 1 2 diabetes, jonka glykeeminen hallinta oli riittämätöntä pelkästään metformiinin, sulfonyyliurean tai metformiinin kanssa yhdessä sulfonyyliurea.
Näissä kolmessa tutkimuksessa satunnaistettiin yhteensä 1446 potilasta: 991 (68,5%) oli valkoihoisia, 224 (15,5%) oli latinalaisamerikkalaisia ja 174 (12,0%) mustia. Keskimääräiset HbA1c-arvot lähtötilanteessa tutkimuksissa olivat 8,2% - 8,7%. Neljän viikon plasebo-aloitusjakson jälkeen potilaat määritettiin satunnaisesti ottamaan Byetta 5 mikrogrammaa kahdesti vuorokaudessa, Byetta 10 mcg BID tai plasebo BID ennen aamu- ja ilta-aterioita olemassa olevan oraalisen diabeteksen lisäksi agentti. Kaikki Byettaan osoitetut potilaat aloittivat hoidon aloittamisjakson 5 mikrogrammaa kahdesti vuorokaudessa 4 viikon ajan. Neljän viikon kuluttua nämä potilaat joko jatkoivat Byetta-valmisteen 5 mcg: n antamista kahdesti päivässä tai heidän annostaan nostettiin 10 mcg: aan kahdesti päivässä. Lumelääkkeeseen osoitetut potilaat saivat plasebo-BID: n koko tutkimuksen ajan.
Kunkin tutkimuksen ensisijainen päätetapahtuma oli keskimääräinen muutos lähtötasosta HbA1c 30 viikossa. Kolmenkymmenen viikon tutkimustulokset on koottu taulukkoon 1.
Taulukko 1: Kolmen viikon plasebokontrolloitujen Byetta-tutkimusten tulokset potilailla, joilla glukoosin hallinta on riittämätöntä metformiinin, sulfonyyliurean tai molempien käytöstä huolimatta
| Plasebo BID |
Byetta 5 ug kahdesti |
Byetta 10 mikrogrammaa* BID |
|
|---|---|---|---|
| |||
| Yhdessä metformiinin kanssa | |||
| Hoidettava aikomusväestö (N) | 113 | 110 | 113 |
| HbA1c (%), Tarkoittaa | |||
| lähtötilanteessa | 8.2 | 8.3 | 8.2 |
| Vaihda viikolla 30 | +0.1 | −0.4†| −0.8C |
| Suhde HbA: n saavuttamiseen1c≤7% § | 13.0% | 31.6%†| 46.4%†|
| Paino (kg), keskiarvo | |||
| lähtötilanteessa | 99.9 | 100.0 | 100.9 |
| Vaihda viikolla 30 | −0.3 | −1.6†| −2.8C |
| Yhdistelmässä sulfonyyliurean kanssa | |||
| Hoidettava aikomusväestö (N) | 123 | 125 | 129 |
| HbA1c (%), Tarkoittaa | |||
| lähtötilanteessa | 8.7 | 8.5 | 8.6 |
| Vaihda viikolla 30 | +0.1 | −0.5†| −0.9C |
| Suhde HbA: n saavuttamiseen1c≤7% § | 8.8% | 32.6%†| 41.3%C |
| Paino (kg), keskiarvo | |||
| lähtötilanteessa | 99.1 | 94.9 | 95.2 |
| Vaihda viikolla 30 | −0.6 | −0.9 | −1.6†|
| Yhdistelmässä metformiinin ja sulfonyyliurean kanssa | |||
| Hoidettava aikomusväestö (N) | 247 | 245 | 241 |
| HbA1c (%), Tarkoittaa | |||
| lähtötilanteessa | 8.5 | 8.5 | 8.5 |
| Vaihda viikolla 30 | +0.2 | −0.6C | −0.8C |
| Suhde HbA: n saavuttamiseen1c≤7% § | 9.2% | 27.4%C | 33.5%C |
| Paino (kg), keskiarvo | |||
| lähtötilanteessa | 99.1 | 96.9 | 98.4 |
| Vaihda viikolla 30 | −0.9 | −1.6†| −1.6†|
HbA1c
Byettan lisääminen metformiinin, sulfonyyliurean tai molempien hoito-ohjelmaan johti tilastollisesti merkitseviin laskuihin lähtötasosta HbA1c viikolla 30 verrattuna potilaisiin, jotka saivat lumelääkettä, jota oli lisätty näihin aineisiin kolmessa kontrolloidussa tutkimuksessa (pöytä 1). Lisäksi havaittiin tilastollisesti merkitsevä annosvaikutus 5 - 10 mikrogramman Byetta-ryhmissä muutoksesta lähtötasoon HbA1c viikolla 30 kolmessa tutkimuksessa.
Paasto- ja aterian jälkeinen glukoosi
Byetta-valmisteen pitkäaikainen käyttö yhdessä metformiinin, sulfonyyliurean tai molempien kanssa vähensi paastoa ja postprandiaaliset plasman glukoosipitoisuudet tilastollisesti merkitsevällä, annoksesta riippuvalla tavalla viikon ajan 30. Tilastollisesti merkitsevä lasku lähtötasosta nähden sekä keskimääräisissä paasto- että postprandiaalisissa glukoosipitoisuuksissa havaittiin viikolla 30 molemmissa Byetta-ryhmissä verrattuna lumelääkkeeseen kolmesta kontrolloidusta yhdistetyistä tiedoista tutkimuksissa. Paaston glukoosikonsentraation muutos viikolla 30 verrattuna lähtötilanteeseen oli <8 mg / dl Byetta-valmisteella 5 mikrogrammaa kahdesti vuorokaudessa ja> 10 mg / dl Byetta-valmisteella 10 mikrogrammaa kahdesti vuorokaudessa, verrattuna +12 mg / dl plaseboon. Muutosta 2 tunnin postprandiaalisessa glukoosikonsentraatiossa Byetta-valmisteen antamisen jälkeen viikolla 30 verrattuna lähtötason ollessa ≥ 63 mg / dl 5 mcg: n kahdesti päivässä ja âˆ'71 mg / dL 10 mc: n kahdesti päivässä, verrattuna +11 mg / dL plasebo.
HbA-arvon saavuttaneiden potilaiden osuus1c≤7%
Byetta yhdessä metformiinin, sulfonyyliurean tai molempien kanssa tuotti suuremman, tilastollisesti merkitsevän niiden potilaiden osuus, joilla saavutettiin HbA1câ ‰ ¤ 7% viikolla 30, verrattuna potilaisiin, jotka saivat lumelääkettä yhdessä nämä edustajat (pöytä 1).
Kehon paino
Kolmessa kontrolloidussa tutkimuksessa ruumiinpainon laskua lähtötasosta viikolla 30 liittyi Byetta 10 mikrogramman BID-arvoon verrattuna lumelääkkeeseen kahdeksan tyypin 2 diabeteksen potilailla (pöytä 1).
Yhden vuoden kliiniset tulokset
Ryhmässä 163 potilasta 30 viikon plasebokontrolloiduista tutkimuksista, jotka suorittivat yhteensä 52 viikon hoidon Byetta-valmisteella 10 mikrogrammaa kahdesti vuorokaudessa, HbA1c-muutokset lähtötasoon nähden olivat '1,0% ja' 1,1% 30 ja 52 hoitoviikolla, mukaan lukien muutokset lähtötasosta paastonneen plasman glukoosin ollessa 14,0 mg / dL ja 25,3 mg / dL, ja painon muutoksilla 2,6 kg ja 3,6. kg. Tällä kohortilla oli lähtöarvoja samanlaisia kuin koko kontrolloidun tutkimuksen populaatiossa.
Käytä tiatsolidiinidionin kanssa
Satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa tutkimuksessa, jonka kesto oli 16 viikkoa, Byetta (n = 121) tai plasebo (n = 112) lisättiin olemassa olevaan tiatsolidiinidionihoito (pioglitatsoni tai rosiglitatsoni), joko metformiinin kanssa tai ilman, potilailla, joilla on tyypin 2 diabetes, joilla on riittämätön glykeeminen hallinta. Satunnaistaminen Byettaan tai lumelääkkeeseen kerrotettiin sen perusteella, saivatko potilaat metformiinia. Lumelääkkeeseen osoitetut potilaat saivat plasebo-BID: n koko tutkimuksen ajan. Byetta tai lumelääke injektoitiin ihon alle ennen aamu- ja ilta-aterioita. 74 prosenttia potilaista käytti tiatsolidiinidionia ja metformiinia ja 21 prosenttia potilaita käytti pelkästään tiatsolidiinidionia. Suurin osa potilaista (84%) oli valkoihoisia, 8% latinalaisamerikkalaisia ja 3% mustia. Keskimääräiset lähtötason HbA1c-arvot olivat samanlaisia Byettalle ja lumelääkkeelle (7,9%). Byetta-hoito aloitettiin annoksella 5 ug BID 4 viikon ajan, minkä jälkeen se nostettiin 10 mikrogrammaan BID vielä 12 viikon ajan.
Kuudentoista viikon tutkimustulokset on koottu taulukkoon 2. Lumelääkkeeseen verrattuna Byetta johti tilastollisesti merkitsevään HbA1c-määrän laskuun lähtötasosta viikolla 16. HbA1c: n hoitotehosteet olivat samanlaiset kahdessa alaryhmässä, jotka määriteltiin taustalla olevan hoitokerroksen perusteella (pelkästään tiatsolidiinidionit verrattuna tiatsolidiinidioneihin plus metformiini). Muutos paastoarvojen seerumin glukoosikonsentraatiossa lähtötasosta viikkoon 16 oli tilastollisesti merkitsevä lumelääkkeeseen verrattuna (21ˆ 21 mg / dl Byetta-valmisteen 10 mikrogrammaa kohden päivässä verrattuna +4 mg / dl plaseboon).
Taulukko 2: 16 viikon plasebokontrolloidun Byetta-tutkimuksen tulokset potilailla, joilla glukoosin hallinta on riittämätöntä, vaikka tiatsolidiinidionia (TZD) tai tiatsolidiinidionia ja metformiinia käytettiin
| Plasebo BID |
Byetta 10 mikrogrammaa* BID |
|
|---|---|---|
| ||
| Yhdessä TZD: n tai TZD: n ja MET: n kanssa | ||
| Hoidettava aikomusväestö (N) | 112 | 121 |
| HbA1c (%), Tarkoittaa | ||
| lähtötilanteessa | 7.9 | 7.9 |
| Vaihda viikolla 16 | +0.1 | −0.8†|
| Suhde HbA: n saavuttamiseen1c≤7%C | 16.2% | 62.3%†|
| Paino (kg), keskiarvo | ||
| lähtötilanteessa | 96.9 | 97.5 |
| Vaihda viikolla 16 | −0.2 | −1.5†|
ylin
Käyttöaiheet ja käyttö
Byetta on tarkoitettu lisähoitoksi glykeemisen hoidon parantamiseksi potilailla, joilla on tyypin 2 diabetes mellitus ja jotka käyttävät metformiinia, sulfonyyliureaa, tiatsolidiinidioni, metformiinin ja sulfonyyliurean yhdistelmä tai metformiinin ja tiatsolidiinidionin yhdistelmä, mutta eivät ole saavuttaneet riittävää glykeemistä kontrolli.
ylin
Vasta
Byetta on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä eksenatidille tai jollekin valmisteen komponentille.
ylin
varotoimet
yleinen
Byetta ei korvaa insuliinia insuliinia tarvitsevilla potilailla. Byettaa ei tule käyttää potilailla, joilla on tyypin 1 diabetes tai diabeettisen ketoasidoosin hoitoon.
Potilaat voivat kehittää anti-eksenatidivasta-aineita Byetta-hoidon jälkeen, mikä on yhdenmukainen proteiini- ja peptidilääkkeiden mahdollisesti immunogeenisten ominaisuuksien kanssa. Byetta-hoitoa saavilla potilailla on tarkkailtava yliherkkyysreaktioiden merkkejä ja oireita.
Pienellä osalla potilaita anti-eksenatidi-vasta-aineiden muodostuminen korkeilla tiitterillä voi johtaa epäonnistumiseen riittävän parantamisen saavuttamisessa glykeemisessä kontrollissa. Jos glykeeminen ohjaus on heikentynyt tai kohdennettua glykeemista kontrollia ei saavuteta, vaihtoehtoista diabeteslääkitystä tulisi harkita.
Byetta-valmisteen samanaikaista käyttöä insuliinin, D-fenyylialaniinijohdannaisten, meglitinidien tai alfa-glukosidaasin estäjien kanssa ei ole tutkittu.
Byetta-valmistetta ei suositella käytettäväksi potilailla, joilla on loppuvaiheen munuaissairaus tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuman farmakokinetiikka, erityisryhmät). Dialyysipotilailla, joilla on loppuvaiheen munuaissairaus, Byetta 5 mikrogramman kerta-annokset eivät olleet hyvin siedettyjä maha-suolikanavan haittavaikutusten vuoksi.
Munuaisten toiminnan muutoksia, mukaan lukien kohonnut seerumi, on ollut harvinaisia, spontaanisti ilmoitettuja tapahtumia kreatiniini, munuaisten vajaatoiminta, pahentunut krooninen munuaisten vajaatoiminta ja akuutti munuaisten vajaatoiminta, joskus vaativat hemodialyysillä. Jotkut näistä tapahtumista tapahtuivat potilailla, jotka saivat yhtä tai useampaa farmakologista ainetta, jonka tiedettiin vaikuttavan munuaisiin toiminnan / nesteytyksen tila ja / tai potilailla, joilla on pahoinvointia, oksentelua ja / tai ripulia, joko tai ilman nestehukka. Samanaikaisiin aineisiin kuuluivat angiotensiiniä konvertoivat entsyymi-estäjät, ei-steroidiset anti-inflammatoriset lääkkeet ja diureetit. Munuaisten vajaatoiminnan palautuvuus on havaittu tukemalla hoitoa ja lopettamalla mahdollisesti aiheuttajat, mukaan lukien eksenatidi. Eksenatidin ei ole havaittu olevan suoraan munuaistoksinen prekliinisissä tai kliinisissä tutkimuksissa.
Byetta-valmistetta ei ole tutkittu potilailla, joilla on vakava maha-suolikanavan sairaus, mukaan lukien mahaparees. Sen käyttöön liittyy yleensä maha-suolikanavan haittavaikutuksia, mukaan lukien pahoinvointi, oksentelu ja ripuli. Siksi Byetta-valmisteen käyttöä ei suositella potilaille, joilla on vaikea maha-suolikanavan sairaus. Byetta-hoidolla kärsivän potilaan vakavan vatsakivun kehittymistä tulisi tutkia, koska se voi olla varoitus merkistä vakavasta tilasta.
hypoglykemia
Byetalla tehdyissä 30 viikon kontrolloiduissa kliinisissä tutkimuksissa hypoglykemiajakso todettiin haittavaikutukseksi, jos potilas ilmoitti hypoglykemiaan liittyvistä oireista ja siihen liittyvästä verensokerin annosta ja HALLINTO).
Taulukko 3: Hypoglykemian * esiintyvyys (%) samanaikaisella antidiabeettisella terapialla
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Plasebo BID |
5 mikrogrammaa BID |
10 mikrogrammaa BID |
Plasebo BID |
5 mikrogrammaa BID |
10 mikrogrammaa BID |
Plasebo BID |
5 mikrogrammaa BID |
10 mikrogrammaa BID |
|
| Metformiinin kanssa | Sulfonyyliurean kanssa | MET / SFU: lla | |||||||
| Byetta ja lumelääke annettiin ennen aamu- ja ilta-aterioita. | |||||||||
| Lyhenteet: BID, kahdesti päivässä; MET / SFU, metformiini ja sulfonyyliurea. | |||||||||
| |||||||||
| N | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| hypoglykemia | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Kun sitä lisättiin tiatsolidiinidioniin, yhdessä metformiinin kanssa tai ilman, Byetta-hoidon yhteydessä oireenmukaista lievää tai kohtalaista hypoglykemiaa oli 11%, kun taas plaseboa saaneiden potilaiden osuus oli 7%.
Byetta ei muuttanut vasta-säätelyhormonivasteita insuliinin aiheuttamaan hypoglykemiaan satunnaistetussa, kaksoissokkoutetussa, kontrolloidussa tutkimuksessa terveillä koehenkilöillä.
Tietoa potilaille
Potilaille on kerrottava Byettan mahdollisista riskeistä. Potilaille on myös tiedotettava täysin itsehallinnollisista käytännöistä, mukaan lukien Byetta-hoidon, injektioiden asianmukaisen varastoinnin merkitys tekniikka, Byettan ja samanaikaisesti suun kautta otettavien lääkkeiden annostelun ajoitus, aterian suunnittelusta huolehtiminen, säännöllinen fyysinen aktiivisuus, määräajoin verensokerin seuranta ja HbA1c-testaus, hypoglykemian ja hyperglykemian tunnistaminen ja hallinta sekä diabeteksen arviointi komplikaatioita.
Potilaita tulisi neuvoa ilmoittamaan lääkärilleen, jos he ovat raskaana tai aikovat tulla raskaaksi.
Jokainen Byetta-annos tulee antaa SC-injektiona reiteen, vatsaan tai olkavarteen milloin tahansa 60 minuutin jakso ennen aamu- ja ilta-aterioita (tai ennen päivän kahta pääateriaa, noin 6 tuntia tai enemmän) välein). Byettaa ei tule antaa aterian jälkeen. Jos annos unohdetaan, hoito-ohjelmaa tulee jatkaa seuraavan aikataulun mukaisen annostelun mukaisesti.
Hypoglykemian riski kasvaa, kun Byettaa käytetään yhdessä hypoglykemiaa indusoivan aineen, kuten sulfonyyliurean kanssa. Potilaalle tulee selittää oireet, hoito ja olosuhteet, jotka altistavat hypoglykemian kehittymiselle. Vaikka potilaan tavanomaisia hypoglykemian hallintaohjeita ei tarvitse muuttaa, näiden ohjeiden tulisi olla tarkistetaan ja vahvistetaan aloitettaessa Byetta-hoitoa, etenkin kun sitä annetaan samanaikaisesti sulfonyyliurean kanssa (katso VAROTOIMET, Hypoglykemia).
Potilaita tulee kertoa, että Byetta-hoito voi vähentää ruokahalua, ruokaa saanti ja / tai kehon paino, ja että annosteluohjelmaa ei tarvitse muuttaa tästä johtuen vaikutuksia. Byetta-hoito voi myös aiheuttaa pahoinvointia, etenkin hoidon aloittamisen yhteydessä (ks HAITTAVAIKUTUKSET).
Potilaan tulee lukea "Potilaalle tarkoitetut tiedot" ja kynän käyttöohjeet ennen Byetta-hoidon aloittamista ja tarkistaa ne aina, kun resepti täytetään. Potilaalle on annettava ohjeet kynän asianmukaisesta käytöstä ja säilyttämisestä, korostamalla kuinka ja milloin uusi kynä asetetaan, ja panee merkille, että ensimmäisessä käytössä on vain yksi asennusvaihe. Potilasta tulee neuvoa olemaan jakamatta kynää ja neuloja.
Potilaille on kerrottava, että kynänneulat eivät sisälly kynään ja että ne on ostettava erikseen. Potilaille tulee neuvoa käytettävää neulan pituutta ja mittaa.
Huumeiden yhteisvaikutukset
Byetta vaikuttaa hitaaseen mahalaukun tyhjentämiseen voi vähentää suun kautta annettavien lääkkeiden imeytymisen määrää ja nopeutta. Byettaa tulee käyttää varoen potilaille, jotka saavat suun kautta otettavia lääkkeitä, jotka vaativat nopeaa imeytymistä ruuansulatuskanavasta. Suun kautta otettaviin lääkkeisiin, jotka ovat riippuvaisia tehokkuuden kynnyspitoisuuksista, kuten ehkäisyvalmisteita ja antibiootteja, potilaita tulisi neuvoa ottamaan näitä lääkkeitä vähintään 1 tunti ennen Byetta-injektio. Jos tällaisia lääkkeitä annetaan ruoan kanssa, potilaita tulisi neuvoa ottamaan ne aterian tai välipalan kanssa, kun Byettaa ei anneta. Byetta-valmisteen vaikutusta suun kautta otettavien ehkäisyvalmisteiden imeytymiseen ja tehokkuuteen ei ole kuvattu.
varfariini
Kontrolloidussa kliinisessä farmakologisessa tutkimuksessa terveillä vapaaehtoisilla varfariinin Tmax-arvo viivästyi noin 2 tuntia, kun varfariinia annettiin 30 minuuttia Byetan jälkeen. Mitään kliinisesti merkitseviä vaikutuksia Cmax-arvoon tai AUC-arvoon ei havaittu. Markkinoilletulon jälkeen on kuitenkin ollut joitain spontaanisti ilmoitettuja tapauksia, joissa INR on noussut (Kansainvälinen normalisoitu suhde) sekä varfariinin ja Byetta-hoidon samanaikainen käyttö, joskus liitettynä verenvuoto.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
104 viikon karsinogeenisuustutkimus tehtiin uros- ja naarasrotilla annoksilla 18, 70 tai 250 mikrogrammaa / kg / päivä annettuna bolus-SC-injektiolla. Naaraattisilla rotilla havaittiin hyvänlaatuisia kilpirauhasen C-soluadenoomeja kaikilla eksenatidiannoksilla. Naispuolisten rottien esiintymistiheys oli 8% ja 5% kahdessa kontrolliryhmässä ja 14%, 11% ja 23% pienillä, keskipitkillä ja suuriannoksisilla ryhmillä, joille annettiin systeeminen altistus 5, 22 ja 130 kertaa, ihmisen altistuminen, joka johtuu suurimmasta suositeltavasta annoksesta 20 mcg / vrk, käyrän alapuolella olevan plasman pinta-alan perusteella (AUC).
104 viikon karsinogeenisuustutkimuksessa hiirillä annoksilla 18, 70 tai 250 mikrog / kg / vrk annettuna bolus-SC-injektiolla, merkkejä kasvaimista ei havaittu annoksilla jopa 250 mcg / kg / päivä, systeeminen altistus jopa 95-kertainen ihmisen altistumiseen, joka johtuu suurimmasta suositeltavasta annoksesta 20 mcg / vrk, perustuen AUC.
Eenatidi ei ollut mutageeninen tai klastogeeninen, metabolisella aktivaatiolla tai ilman, Ames-bakteerien mutageenisuusmäärityksessä tai kromosomaalisen aberraation määrityksessä kiinalaisen hamsterin munasarjasoluissa. Eksenadetidi oli negatiivinen hiiren mikrotuma-analyysissä in vivo.
Hiirien hedelmällisyystutkimuksissa SC-annoksilla 6, 68 tai 760 mikrog / kg / päivä miehiä hoidettiin 4 viikkoa ennen paritukseen ja sen aikana ja naaraita hoidettiin 2 viikkoa ennen parittelua ja koko sen ajan raskauspäivään saakka 7. Haitallisia vaikutuksia hedelmällisyyteen ei havaittu annoksella 760 mcg / kg / päivä, systeeminen altistus 390-kertainen ihmisen altistumiseen, joka johtui suurimmasta suositeltavasta annoksesta 20 mcg / vrk AUC: n perusteella.
raskaus
Raskausluokka C
Exenatidin on osoitettu aiheuttavan vähentynyttä sikiön ja vastasyntyneen kasvua ja luuvaikutuksia hiirissä kohdassa systeeminen altistus 3-kertainen ihmisen altistukselle, joka johtuu suositeltavasta enimmäisannosta 20 mikrog / vrk, perustuu AUC: iin. Exenatidin on osoitettu aiheuttavan luuvaikutuksia kaneilla systeemisellä altistuksella, joka on 12 kertaa suurempi kuin ihmisen altistus, joka johtuu suurimmasta suositeltavasta annoksesta 20 mikrog / vrk AUC: n perusteella. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Byetta-valmistetta tulisi käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan vaaran.
Naisilla hiirillä, joille annettiin SC-annoksia 6, 68 tai 760 mikrog / kg / päivä alkaen 2 viikkoa ennen parittelua ja sen ajan koko raskauspäivään 7 saakka, ei ollut haitallista sikiötä vaikutukset annoksilla jopa 760 mcg / kg / vrk, systeemiset altistukset jopa 390-kertaisesti ihmisen altistumiseen, joka johtuu suurimmasta suositeltavasta annoksesta 20 mcg / vrk, perustuen AUC.
Raskaana olevilla hiirillä, joille annettiin SC-annoksia 6, 68, 460 tai 760 mikrog / kg / päivä raskauspäivästä 6-15 (organogeneesi), kitalaessa (joissain on reikiä) ja epäsäännöllisessä luustossa kylkiluiden ja kallon luiden luutumista havaittiin annoksella 6 mcg / kg / päivä, systeeminen altistus kolminkertainen ihmisen altistumiseen, joka johtui suositeltavasta enimmäisannosta 20 mcg / kg / päivä, perustuu AUC: iin.
Tiineillä kaniineilla, joille annettiin SC-annoksia 0,2, 2, 22, 156 tai 260 mikrog / kg / päivä raskauspäivästä 6-18 (organogeneesi), epäsäännöllinen luu luunmuutoksia havaittiin annoksella 2 mcg / kg / päivä, systeeminen altistus 12-kertainen ihmisen altistumiseen, joka johtui suositeltavimmasta enimmäisannosta 20 mcg / päivä, perustuu AUC: iin.
Tiineillä hiirillä, joille annettiin SC-annoksia 6, 68 tai 760 mikrog / kg / päivä raskauspäivästä 6 - laktaation päivään 20 (vieroitus), havaittiin lisääntynyt vastasyntyneiden kuolemien määrä synnytyksen jälkeisinä päivinä 2–4 emoilla, joille annettiin 6 mikrogrammaa / kg / päivä, systeeminen altistus 3-kertainen ihmisen altistukselle, joka johtui suurimmasta suositeltavasta annoksesta 20 mikrogrammaa päivässä AUC: n perusteella.
Imettävät äidit
Ei tiedetä erittyykö eksenatidi äidinmaitoon. Monet lääkkeet erittyvät äidinmaitoon, ja koska eksenatidi saattaa aiheuttaa kliinisesti merkittäviä haittavaikutuksia imettäville lapsille, päätös tulisi päättää lopettaako maidontuotanto kulutukseen vai lopettaako lääke ottaen huomioon lääkkeen merkitys imetykselle nainen. Imettäviä hiiriä koskevat tutkimukset ovat osoittaneet, että eksenatidia on pieninä pitoisuuksina maidossa (pienempi tai yhtä suuri kuin 2,5% pitoisuudesta äidin plasmassa ihonalaisen annostelun jälkeen). Byettaa annettaessa imettävälle naiselle on noudatettava varovaisuutta.
Lasten käyttö
Byetta-valmisteen turvallisuutta ja tehoa ei ole osoitettu lapsipotilailla.
Geriatrinen käyttö
Byetta-valmistetta tutkittiin 282 potilaalla, jotka olivat 65-vuotiaita tai vanhempia, ja 16 potilaalla, jotka olivat 75-vuotiaita tai vanhempia. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu eroja turvallisuudessa tai tehokkuudessa.
ylin
Haitalliset reaktiot
Käytetään metformiinin ja / tai sulfonyyliurean kanssa
Kolmessa 30 viikon kontrolloidussa Byetta-tutkimuksessa, jotka koskivat metformiinin ja / tai sulfonyyliurean lisäystä, haittavaikutukset, joiden esiintyvyys oli ¥ ‰ 5% (pois lukien hypoglykemia; nähdä Taulukko 3), joita esiintyi useammin Byetta-hoitoa saaneilla potilailla verrattuna lumelääkehoitoon, on esitetty taulukossa 4.
Taulukko 4: Toistuvat hoidon aiheuttamat haittavaikutukset (â ¥ ¥ 5% ja suurempi esiintyvyys Byetta-hoidon yhteydessä) lukuun ottamatta hypoglykemiaa *
| Plasebo-BID N = 483 % |
Kaikki Byetta BID N = 963 % |
|
|---|---|---|
| ||
| Pahoinvointi | 18 | 44 |
| oksentelu | 4 | 13 |
| Ripuli | 6 | 13 |
| Tunne hermostunut | 4 | 9 |
| Huimaus | 6 | 9 |
| Päänsärky | 6 | 9 |
| ruoansulatushäiriö | 3 | 6 |
Byettaan liittyvät haittatapahtumat olivat yleensä lieviä tai kohtalaisia. Yleisimmin ilmoitettu haittavaikutus, lievä tai kohtalainen pahoinvointi, tapahtui annoksesta riippuen. Hoidon jatkamisen yhteydessä esiintyvyys ja vakavuus laskivat ajan kuluessa useimmilla potilailla, joilla alun perin ilmeni pahoinvointia. Haittatapahtumat, joita raportoitiin â ‰ ¥ 1,0– <5,0% Byettaa saaneista potilaista ja joita ilmoitettiin useammin kuin lumelääkkeellä mukaan lukien astenia (ilmoitettu useimmiten heikkoutena), ruokahalun heikkeneminen, gastroösofageaalinen refluksitauti ja liikahikoilu. Pidennystesteissä 52 viikon potilaat kokivat samanlaisia haittavaikutuksia 30 viikon kontrolloiduissa tutkimuksissa.
Haittavaikutusten takia vetäytyminen oli 7% Byetta-hoitoa saaneilla potilailla ja 3% lumelääkehoitoa saaneilla potilailla. Byettalla hoidetuilla potilailla yleisimmät haittavaikutukset, jotka johtivat vetäytymiseen, olivat pahoinvointi (3% potilaista) ja oksentelu (1%). Lumelääkehoitoa saaneilla potilailla <1% vetäytyi pahoinvoinnin vuoksi ja 0% oksentelun takia.
Käytä tiatsolidiinidionin kanssa
Byetta-lisäyksen tiatsolidiinidioniin 16-viikkoisessa lumelääkekontrolloidussa tutkimuksessa metformiinin kanssa tai ilman metformiinin kanssa esiintyvyys ja tyyppi muut havaitut haittavaikutukset olivat samanlaisia kuin 30 viikon kontrolloiduissa kliinisissä tutkimuksissa metformiinin ja / tai a: n kanssa sulfonyyliurea. Lumelääkeryhmässä ei ilmoitettu vakavista haittavaikutuksista. Byetta-käsivarressa ilmoitettiin kahta vakavaa haittavaikutusta, nimittäin rintakipua (johtaen vetäytymiseen) ja kroonista yliherkkyyspneumoniittia.
Haittavaikutusten takia vetäytyminen oli Byetta-hoitoa saaneilla potilailla 16% (19/121) ja plaseboa saaneilla potilailla 2% (2/112). Byetta-hoitoa saaneilla potilailla yleisimmät haittavaikutukset, jotka johtivat vetäytymiseen, olivat pahoinvointi (9%) ja oksentelu (5%). Lumelääkehoitoa saaneiden potilaiden hoidossa <1% lopetti pahoinvoinnin vuoksi. Vilunväristykset (n = 4) ja pistoskohdan reaktiot (n = 2) esiintyivät vain Byetta-potilailla. Kahdeilla potilailla, jotka ilmoittivat injektiokohdan reaktiosta, oli korkeita anti-eksenatidi-vasta-ainetiittereitä.
Spontaani tieto
Byettaan markkinoille tulon jälkeen seuraavia lisähaittavaikutuksia on ilmoitettu. Koska nämä tapahtumat ilmoitetaan vapaaehtoisesti epävarman koon väestöstä, ei aina ole mahdollista arvioida luotettavasti niiden esiintymistiheyttä tai vahvistaa syy-yhteys huumeiden altistumiseen.
Yleistä: pistoskohdan reaktiot; makuaistin; uneliaisuus, INR kasvoi samanaikaisen varfariinin käytön yhteydessä (jotkut ilmoitukset liittyivät verenvuotoon).
Allergia / yliherkkyys: yleistynyt kutina ja / tai nokkosihottuma, makula- tai papulaarinen ihottuma, angioödeema; harvinaiset anafylaktiset reaktiot.
Ruoansulatuskanava: pahoinvointi, oksentelu ja / tai ripuli, joka johtaa kuivumiseen; vatsan turvotus, vatsakipu, hengitys, ummetus, ilmavaivat, akuutti haimatulehdus.
Munuaisten ja virtsan häiriöt: muuttunut munuaisten toiminta, mukaan lukien akuutti munuaisten vajaatoiminta, kroonisen munuaisten vajaatoiminnan paheneminen, munuaisten vajaatoiminta, kohonnut seerumin kreatiniini (ks. VAROTOIMET).
Immunogeenisuus
Yhdessä proteiini- ja peptidilääkkeiden mahdollisesti immunogeenisten ominaisuuksien kanssa potilaat voivat kehittää anti-eksenatidivasta-aineita Byetta-hoidon jälkeen. Useimmilla potilailla, joilla kehittyy vasta-aineita, vasta-ainetiitterit vähenevät ajan myötä.
30 viikon kontrolloiduissa tutkimuksissa, joissa Byetta lisäsi metformiinia ja / tai sulfonyyliureaa, 38 prosentilla potilaista oli alhaisen tiitterin anti-eksenatidivasta-aineita 30 viikossa. Tämän ryhmän glykeemisen kontrollin (HbA1c) taso oli yleensä verrattavissa tasoon, jota havaittiin niissä, joilla ei ollut vasta-ainetiittereitä. Lisäksi 6 prosentilla potilaista tiitterivasta-aineet olivat korkeammat 30 viikossa. Noin puolella tästä 6%: sta (3% kaikista Byetta-potilaista, joille annettiin 30 viikon kontrolloiduissa tutkimuksissa) glykeeminen vaste Byettalle heikentyi; loppuosalla oli glykeeminen vaste, joka oli verrattavissa potilaisiin, joilla ei ollut vasta-aineita.
Byetta-valmisteen tiatsolidiinidionien lisäyksen 16 viikon tutkimuksessa, metformiinin kanssa tai ilman, 9 prosentilla potilaista oli korkeamman tiitterin vasta-aineet 16 viikossa. Verrattuna potilaisiin, joilla ei kehittynyt vasta-aineita Byettalle, keskimäärin glykeeminen vaste potilailla, joilla oli korkeamman tiitterin vasta-aineet, heikkeni.
Potilaan glykeemistä vastetta Byetta-hoitoa on seurattava. Jos glykeeminen ohjaus on heikentynyt tai kohdennettua glykeemista kontrollia ei saavuteta, vaihtoehtoista diabeteslääkitystä tulisi harkita.
ylin
yliannostus
Byetta-valmisteen kliinisessä tutkimuksessa kolmella tyypin 2 diabetesta sairastavalla potilaalla oli yksi kerta-annos, joka oli 100 mikrog SC (10 kertaa suurin suositeltu annos). Yliannosten vaikutuksiin kuului vaikea pahoinvointi, vaikea oksentelu ja nopeasti laskevat verensokeripitoisuudet. Yhdellä kolmesta potilaasta koettiin vaikea hypoglykemia, joka vaati parenteraalista glukoosin annosta. Kolme potilasta toipuivat ilman komplikaatioita. Yliannostuksen yhteydessä on aloitettava asianmukainen tukihoito potilaan kliinisten oireiden ja oireiden mukaan.
ylin
Annostelu ja hallinnointi
Byetta-hoito tulisi aloittaa 5 mikrogrammalla annosta kohden, joka annetaan kahdesti päivässä milloin tahansa 60 minuutin sisällä jakso ennen aamu- ja ilta-aterioita (tai ennen päivän kahta pääateriaa, noin 6 tuntia tai enemmän) välein). Byettaa ei tule antaa aterian jälkeen. Kliinisen vasteen perusteella Byetta-annosta voidaan nostaa 10 mikrogrammaan kahdesti päivässä yhden kuukauden hoidon jälkeen. Jokainen annos tulee antaa SC-injektiona reiteen, vatsaan tai olkavarteen.
Byetta-valmistetta suositellaan käytettäväksi tyypin 2 diabetes mellituspotilailla, jotka jo saavat metformiinia, sulfonyyliureaa, tiatsolidiinidionista, metformiinin ja sulfonyyliurean yhdistelmästä tai metformiinin ja tiatsolidiinidionin yhdistelmästä, ja glykeeminen hallinta. Kun Byetta lisätään metformiini- tai tiatsolidiinidionihoitoon, metformiinin tai tiatsolidiinidionin nykyistä annosta voidaan jatkaa koska on epätodennäköistä, että metformiinin tai tiatsolidiinidionin annos tarvitsee säätää hypoglykemian vuoksi käytettäessä Byetta-valmistetta. Kun Byetta lisätään sulfonyyliureahoitoon, sulfonyyliurean annoksen pienentämistä voidaan harkita hypoglykemian riskin vähentämiseksi (ks. VAROTOIMET, Hypoglykemia).
Byetta on kirkas ja väritön neste, eikä sitä tule käyttää, jos hiukkasia esiintyy tai jos liuos on sameaa tai värillistä. Byetta-valmistetta ei tule käyttää viimeisen käyttöpäivämäärän jälkeen. Byetta-valmisteen suonensisäisen tai lihaksensisäisen injektion turvallisuudesta tai tehosta ei ole tietoja.
ylin
varastointi
Ennen ensimmäistä käyttöä Byetta on säilytettävä jääkaapissa 2 ° C - 8 ° C: n lämpötilassa. Ensimmäisen käytön jälkeen Byetta voidaan pitää lämpötilassa, joka ei ylitä 25 ° C (77 ° F). Ei saa jäätyä. Älä käytä Byettaa, jos se on jäätynyt. Byetta on suojattava valolta. Kynä tulee hävittää 30 päivän kuluttua ensimmäisestä käytöstä, vaikka kynässä olisi jonkin verran lääkettä.
ylin
Kuinka toimitetaan
Byetta toimitetaan steriilinä liuoksena ihonalaista injektiota varten, joka sisältää 250 mcg / ml eksenatidiä. Seuraavat paketit ovat saatavana:
5 mikrogrammaa annosta kohti, 60 annosta, 1,2 ml esitäytettyä kynää NDC 66780-210-07
10 mikrogrammaa annosta kohti, 60 annosta, 2,4 ml esitäytettyä kynää NDC 66780-210-08
RX VAIN
Valmistettu yritykselle Amylin Pharmaceuticals, Inc., San Diego, CA 92121
Markkinoi Amylin Pharmaceuticals, Inc. ja Eli Lilly and Company
1-800-868-1190
http://www.Byetta.com
Byetta on Amylin Pharmaceuticals, Inc.:n rekisteröity tavaramerkki.
© 2007 Amylin Pharmaceuticals, Inc. Kaikki oikeudet pidätetään.
viimeksi päivitetty 09/2007
Byetta (Exenatide) -potilastiedot (selkeästi englanniksi)
Yksityiskohtaiset tiedot diabeteksen oireista, oireista, syistä ja hoidoista
Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötarkoituksia, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysymyksiä käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta.
takaisin: Selaa kaikkia diabeteksen lääkkeitä


