Avandia diabeteksen hoidossa
Tuotemerkki: AVANDIA
Geneerinen nimi: rosiglitatsonimaleaatti
Sisällys:
Käyttöaiheet ja käyttö
Annostelu ja hallinnointi
Annosmuodot ja vahvuudet
Vasta
Varoitukset ja varotoimet
Haitalliset reaktiot
Lääkkeiden yhteisvaikutukset
Käyttö tietyissä populaatioissa
yliannostus
Kuvaus
Kliininen farmakologia
Ei-kliininen toksikologia
Kliiniset tutkimukset
Kuinka toimitetaan
Avandia, rosiglitatsonimaleaatti, potilastiedot (selkeästi englanniksi)
VAROITUS
CONGESTIIVINEN SYDÄVIRHE JA SYYKARDINEN ISKEEMIA
- Tiatsolidiinidionit, mukaan lukien rosiglitatsoni, aiheuttavat tai pahentavat kongestiivista sydämen vajaatoimintaa joillakin potilailla [ks. VAROITUKSET JA VAROTOIMET]. AVANDIA-hoidon aloittamisen jälkeen ja annoksen suurentamisen jälkeen tarkkailla potilaita huolellisesti sydämen vajaatoiminnan oireiden (mukaan lukien liiallinen, nopea painonnousu, hengenahdistus ja / tai turvotus) varalta. Jos nämä oireet ilmenevät, sydämen vajaatoiminta tulee hoitaa nykyisten hoitostandardien mukaisesti. Lisäksi on harkittava AVANDIA-hoidon lopettamista tai pienentämistä.
- AVANDIAa ei suositella potilaille, joilla on oireellinen sydämen vajaatoiminta. AVANDIA-hoidon aloittaminen on vasta-aiheista potilailla, joilla on NYHA-luokan III tai IV sydämen vajaatoiminta. [See VASTA ja VAROITUKSET JA VAROTOIMET.]
- 42 kliinisen tutkimuksen metaanalyysi (keskimääräinen kesto 6 kuukautta; Yhteensä 14 237 potilasta), joista suurimmassa osassa AVANDIAa verrattiin lumelääkkeeseen, osoitettiin, että AVANDIA liittyi lisääntyneeseen sydänlihaksen iskeemisten tapahtumien, kuten angina tai sydäninfarktin, riskiin. Kolme muuta tutkimusta (keskimääräinen kesto 41 kuukautta; Yhteensä 14 067 potilasta), vertaamalla AVANDIAa muihin hyväksyttyihin suun kautta otettaviin diabeteslääkkeisiin tai lumelääkkeeseen, ei ole vahvistettu tai poissuljettu tätä riskiä. Käytettävissä olevat tiedot sydänlihaksen iskemian riskistä ovat kokonaisuudessaan epätarkkoja. [See VAROITUKSET JA VAROTOIMET.]
ylin
Käyttöaiheet ja käyttö
Monoterapia ja yhdistelmähoito
AVANDIA on tarkoitettu lisäaineeksi ruokavalioon ja liikuntaan glykeemisen hoidon parantamiseksi aikuisilla, joilla on tyypin 2 diabetes mellitus.
Tärkeät käyttörajoitukset
- Vaikutusmekanisminsa vuoksi AVANDIA on aktiivinen vain endogeenisen insuliinin läsnäollessa. Siksi AVANDIAa ei tule käyttää potilailla, joilla on tyypin 1 diabetes mellitus, tai diabeettisen ketoasidoosin hoitoon.
- AVANDIAn ja insuliinin samanaikaista käyttöä ei suositella.
- AVANDIAn käyttöä nitraattien kanssa ei suositella.
ylin
Annostelu ja hallinnointi
Diabeteslääkityksen hoito tulee räätälöidä. Kaikkien potilaiden tulee aloittaa AVANDIA pienimmällä suositellulla annoksella. AVANDIA-annoksen lisäämisessä on seurattava huolellisesti nesteretentioon liittyvien haittavaikutusten seurantaa [ks Varoitus ruudussa ja VAROITUKSET JA VAROTOIMET].
AVANDIA voidaan antaa aloitusannoksena 4 mg joko yhtenä päivittäisenä annoksena tai 2 jaettuna annoksena. Potilaille, jotka reagoivat riittämättömästi 8–12 viikon hoidon jälkeen, määritettynä paastohoidon plasmaglukoosin alenemisella (FPG), annosta voidaan nostaa 8 mg: aan päivittäin monoterapiana tai yhdistelmänä metformiinin, sulfonyyliurean tai sulfonyyliurean kanssa plus metformiini. Glykeemisten parametrien aleneminen annoksella ja hoito-ohjelmalla kuvataan kliinisissä tutkimuksissa. AVANDIA voidaan ottaa ruuan kanssa tai ilman.
AVANDIA-valmisteen kokonaispäiväannos ei saa ylittää 8 mg.
monoterapia
Tavallinen AVANDIA-aloitusannos on 4 mg, joka annetaan joko yhtenä annoksena kerran päivässä tai jaettuna annoksena kahdesti päivässä. Kliinisissä tutkimuksissa 4 mg kahdesti vuorokaudessa -hoito johti FPG: n ja hemoglobiinin A1c (HbA1c) vähentymiseen eniten.
Yhdistelmä sulfonyyliurean tai metformiinin kanssa
Kun AVANDIA lisätään olemassa olevaan hoitoon, lääkkeen / lääkkeiden nykyisiä annoksia voidaan jatkaa aloitettaessa AVANDIA-hoito.
sulfonyyliurea: Kun sitä käytetään yhdessä sulfonyyliurean kanssa, tavallinen AVANDIA-aloitusannos on 4 mg, joka annetaan joko yhtenä annoksena kerran päivässä tai jaettuna annoksena kahdesti päivässä. Jos potilaat ilmoittavat hypoglykemian, sulfonyyliurean annosta tulee pienentää.
metformiini: Tavallinen AVANDIA-aloitusannos yhdessä metformiinin kanssa on 4 mg joko yhtenä annoksena kerran päivässä tai jaettuna annoksena kahdesti päivässä. On epätodennäköistä, että metformiinin annos tarvitsee säätää hypoglykemian takia AVANDIA-yhdistelmähoidon aikana.
Yhdistelmä sulfonyyliurean ja metformiinin kanssa
Tavallinen AVANDIA-aloitusannos yhdessä sulfonyyliurean ja metformiinin kanssa on 4 mg joko yhtenä annoksena kerran päivässä tai jaettuna annoksena kahdesti päivässä. Jos potilaat ilmoittavat hypoglykemian, sulfonyyliurean annosta tulee pienentää.
Erityiset potilaspopulaatiot
Munuaisten vajaatoiminta: Annoksen säätäminen ei ole tarpeen, kun AVANDIAa käytetään monoterapiana potilailla, joilla on munuaisten vajaatoiminta. Koska metformiini on vasta-aiheinen tällaisille potilaille, metformiinin ja AVANDIAn samanaikainen käyttö on vasta-aiheista myös munuaisten vajaatoiminnasta kärsiville potilaille.
Maksan vajaatoiminta: Maksaentsyymit tulisi mitata ennen AVANDIA-hoidon aloittamista. AVANDIA-hoitoa ei tule aloittaa, jos potilaalla on kliinisiä todisteita aktiivisuudesta maksasairaus tai lisääntyneet seerumin transaminaasitasot (ALAT> 2,5 - kertainen normaalin yläraja vuoden 2009 alussa terapia). AVANDIA-hoidon aloittamisen jälkeen maksaentsyymejä on seurattava määräajoin lääkärin kliinisen päätöksen perusteella. [See VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA.]
Pediatric: Tiedot ovat riittämättömiä AVANDIA-hoidon suosittamiseksi lapsille [ks KÄYTTÖ ERITYISissä HENKILÖKOHDISSA].
ylin
Annosmuodot ja vahvuudet
Viisikulmainen kalvopäällysteinen TILTAB-tabletti sisältää rosiglitatsonia maleaattina seuraavasti:
- 2 mg - vaaleanpunainen, merkinnällä SB toisella puolella ja 2 toisella
- 4 mg - oranssia, merkinnällä SB toisella puolella ja 4 toisella
- 8 mg - punaisenruskea, merkinnällä SB toisella puolella ja 8 toisella
ylin
Vasta
AVANDIA-hoidon aloittaminen potilailla, joilla on perustettu New York Heart Association (NYHA) luokan III tai IV sydämen vajaatoiminta, on vasta-aiheista [ks. LAATIKKO VAROITUS].
ylin
Varoitukset ja varotoimet
Sydämen vajaatoiminta
AVANDIA, kuten muut tiatsolidiinidionit, voi yksinään tai yhdessä muiden diabeteksen vastaisten aineiden kanssa aiheuttaa nesteretention, joka voi pahentaa tai johtaa sydämen vajaatoimintaan. Potilaita tulee tarkkailla sydämen vajaatoiminnan oireiden varalta. Jos nämä oireet ilmenevät, sydämen vajaatoiminta tulee hoitaa nykyisten hoitostandardien mukaisesti. Lisäksi on harkittava rosiglitatsonin käytön lopettamista tai pienentämistä [ks LAATIKKO VAROITUS].
AVANDIAlla hoidetuilla kongestiivisella sydämen vajaatoiminnalla (CHF) NYHA-luokan I ja II potilailla on lisääntynyt sydän- ja verisuonitapahtumien riski. 52 viikon kaksoissokkoutettu, plasebokontrolloitu ehokardiografinen tutkimus tehtiin 224 tyypin 2 potilaalle diabetes mellitus ja NYHA-luokan I tai II CHF (ejektiofraktio â ¤ 45%) taustalla antidiabeettisella ja CHF: llä terapiaa. Riippumaton komitea suoritti sokean arvioinnin nesteisiin liittyvistä tapahtumista (mukaan lukien kongestiivinen sydämen vajaatoiminta) ja sydän- ja verisuonisairaalahoidot ennalta määriteltyjen perusteiden mukaisesti (Palkintolautakunta). Tutkijat ilmoittivat muista sydän- ja verisuonivaikutuksista erillään tuomiosta. Vaikka hoitoeroja muutoksessa muutoksessa ejektiofraktioiden lähtötasoon nähden ei havaittu, enemmän kardiovaskulaarisia haittavaikutuksia havaittiin AVANDIA-hoidon jälkeen plaseboon verrattuna 52 viikon tutkimus. (Katso taulukko 1.)
Pöytä 1. Esiintyvät sydän- ja verisuonivaikutukset potilailla, joilla on kongestiivinen sydämen vajaatoiminta (NYHA-luokka I ja II) ja joita hoidetaan AVANDIA: lla tai lumelääkkeellä (lisäksi taustadiabeettisella ja CHF-terapialla)
| Tapahtumat | AVANDIA N = 110 n (%) |
Plasebo N = 114 n (%) |
| ratkaisi | ||
| Sydän- ja verisuonikuolemat | 5 (5%) | 4 (4%) |
| CHF pahenee | 7 (6%) | 4 (4%) |
| - Yön yli sairaalahoidossa | 5 (5%) | 4 (4%) |
| - ilman yön yli sairaalahoitoa | 2 (2%) | 0 (0%) |
| Uusi tai paheneva turvotus | 28 (25%) | 10 (9%) |
| Uusi tai paheneva hengenahdistus | 29 (26%) | 19 (17%) |
| Lisääntynyt CHF-lääkitys | 36 (33%) | 20 (18%) |
| Sydän- ja verisuonisairaalahoito * | 21 (19%) | 15 (13%) |
| Tutkijan ilmoittama, tuomitsematon | ||
| Iskeemiset haittavaikutukset | 10 (9%) | 5 (4%) |
| - Sydäninfarkti | 5 (5%) | 2 (2%) |
| - angina | 6 (5%) | 3 (3%) |
| * Sisältää sairaalahoidon mistä tahansa sydän- ja verisuonisyistä. |
AVANDIA-hoidon aloittaminen on vasta-aiheista potilailla, joilla on NYHA-luokan III tai IV sydämen vajaatoiminta. AVANDIAa ei suositella potilaille, joilla on oireellinen sydämen vajaatoiminta. [See LAATIKKO VAROITUS.]
Potilaita, joilla on akuutti sepelvaltimoiden oireyhtymä, ei ole tutkittu kontrolloiduissa kliinisissä tutkimuksissa. Ottaen huomioon sydämen vajaatoiminnan kehittymispotentiaali potilailla, joilla on akuutti sepelvaltimo, AVANDIA ei aloiteta suositellaan potilaille, joilla on akuutti sepelvaltimo- tapahtuma, ja AVANDIA-hoidon lopettamisen tulisi olla tämän akuutin vaiheen aikana harkita.
Potilaita, joilla on NYHA-luokan III ja IV sydämen tila (CHF: n kanssa tai ilman), ei ole tutkittu kontrolloiduissa kliinisissä tutkimuksissa. AVANDIAa ei suositella potilaille, joilla on NYHA-luokan III ja IV sydämen tila.
Sydänlihasiskemia
Sydänlihasiskemian meta-analyysi ryhmässä 42 kliinistä tutkimusta
Meta-analyysi suoritettiin takautuvasti sydän- ja verisuonisairauden haittavaikutusten arvioimiseksi 42 kaksoissokkotetussa, satunnaistetussa, kontrolloidussa kliinisessä tutkimuksessa (keskimääräinen kesto 6 kuukautta).1
Nämä tutkimukset oli suoritettu glukoosipitoisuutta alentavan tehon arvioimiseksi tyypin 2 diabeteksessa, eikä sydän- ja verisuonitapahtumien ennakoivasti suunniteltua ratkaisua tutkimuksissa ollut tapahtunut. Jotkut tutkimukset olivat lumelääkekontrolloituja ja joissakin käytettiin kontrolleina aktiivisia oraalisia diabeteslääkkeitä. Plasebokontrolloidut tutkimukset sisälsivät monoterapiakokeita (monoterapia AVANDIAlla vs. lumelääkemonoterapia) ja lisätestejä (AVANDIA tai plasebo, lisättynä sulfonyyliureaan, metformiiniin tai insuliiniin). Aktiiviseen kontrollitutkimukseen sisältyivät monoterapiakokeet (monoterapia AVANDIA: lla vs. sulfonyyliurea tai metformiini) monoterapia) ja lisäkokeet (AVANDIA plus sulfonyyliurea tai AVANDIA plus metformiini vs. sulfonyyliurea plus metformiini). Kaikkiaan 14 237 potilasta sisällytettiin (8 604 AVANDIAa sisältävissä hoitoryhmissä, 5 633 tuumaa) vertailuryhmät), joissa AVANDIA-altistus oli 4 143 potilasvuotta ja 2 675 potilasvuotta vertailuryhmässä. Sydänlihaksen iskeemisiin tapahtumiin sisältyi angina pectoris, angina pectoriksen paheneminen, epästabiili angina, sydämenpysähdys, rintakipu, sepelvaltimo valtimoiden tukkeuma, hengenahdistus, sydäninfarkti, sepelvaltimoiden tromboosi, sydänlihaksen iskemia, sepelvaltimoiden sairaus ja sepelvaltimo häiriö. Tässä analyysissä lisääntynyt sydänlihasiskemian riski AVANDIA: lla verrattuna yhdistettyihin vertailuaineisiin havaittiin (2% AVANDIA vs. 1,5% vertailijat, kertoimen suhde 1,4, 95% luottamusväli [CI] 1,1, 1.8). Plasebokontrolloiduissa tutkimuksissa havaittiin lisääntynyttä sydänlihaksen iskeemisten tapahtumien riskiä AVANDIA: lla, mutta ei aktiivisesti kontrolloiduissa tutkimuksissa. (Katso kuva 1.)
Suurempi lisääntynyt sydänlihaksen iskeemisten tapahtumien riski havaittiin tutkimuksissa, joihin AVANDIAa lisättiin insuliiniin (2,8% AVANDIA plus insuliini verrattuna 1,4% lumelääkkeeseen plus insuliini) [TAI 2,1, 95% CI 0,9, 5.1]). Tämä lisääntynyt riski heijastaa eroa 3 tapahtumassa 100 potilasvuotta kohti (95% CI -0,1, 6,3) hoitoryhmien välillä. [See VAROITUKSET JA VAROTOIMET.]
Kuvio 1. Metsäkaavio kertoimien suhteista (95% luottamusvälit) sydänlihaksen iskeemisille tapahtumille 42 kliinisen tutkimuksen metaanalyysissä
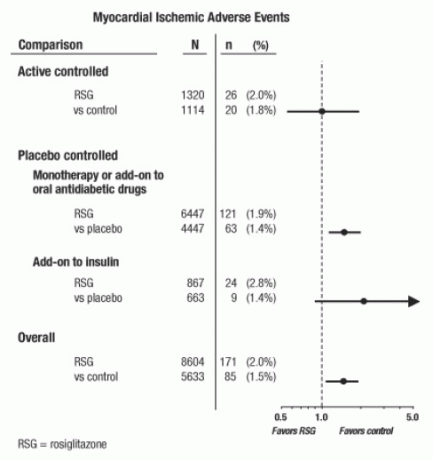
Suurempi lisääntynyt sydänlihasiskemian riski havaittiin myös potilailla, jotka saivat AVANDIA- ja taustanitraattihoitoa. AVANDIA: lla (N = 361) verrattuna kontrolliin (N = 244) nitraattien käyttäjillä kertoimen suhde oli 2,9 (95% CI 1,4, 5.9), kun taas ei-nitraattikäyttäjillä (yhteensä noin 14 000 potilasta) kertoimen suhde oli 1,3 (95% CI 0,9, 1.7). Tämä lisääntynyt riski edustaa eroa 12 sydänlihaksen iskeemisessä tapahtumassa 100 potilasvuotta kohti (95% CI 3,3, 21,4). Suurimmalla osalla nitraattien käyttäjistä oli todettu sepelvaltimo sydänsairaus. Niiden potilaiden keskuudessa, joilla tiedettiin sepelvaltimo sydänsairaus, jotka eivät olleet saaneet nitraattihoitoa, AVANDIA: n kohonneita sydänlihaksen iskeemisten tapahtumien riskiä ei voitu osoittaa verrattuna vertailuryhmään.
Sydänlihaksen iskeemiset tapahtumat suurissa pitkäaikaisissa mahdollisissa satunnaistetuissa kontrolloiduissa AVANDIA-tutkimuksissa
Tulokset kolmesta muusta suuresta, pitkäaikaisesta, mahdollisesta, satunnaistetusta, kontrolloidusta kliinisestä AVANDIA-tutkimuksesta arvioitiin erillään metaanalyysistä. Näihin 3 tutkimukseen osallistui yhteensä 14 067 potilasta (hoitoryhmät, jotka sisälsivät AVANDIA N = 6 311, vertailuryhmä) ryhmät N = 7 756), potilasvuoden altistumisella AVANDIAssa 21 803 potilasvuotta ja 25 998 potilasvuotta potilaiden vuodessa vertailuryhmässä. Seurannan kesto ylitti 3 vuotta kussakin tutkimuksessa. ADOPT (Diabetes Outomers Progression Trial) oli 4-6 vuoden satunnaistettu, aktiivisesti kontrolloitu tutkimus äskettäin diagnosoiduilla tyypin 2 diabeteksen potilailla, jotka eivät ole olleet lääkehoidon yhteydessä.
Se oli tehokkuutta ja yleistä turvallisuustutkimusta, jonka tarkoituksena oli tutkia
AVANDIA monoterapiana (N = 1 456) glykeemisen kontrollin aikaansaamiseksi tyypin 2 diabeteksessa, vertailuryhmissä sulfonyyliurean monoterapiaa (N = 1 441) ja metformiinin monoterapiaa (N = 1 454). DREAM (Diabetes Reduction Assessment with Rosiglitazone and Ramipril Medication, julkaistu raportti2) oli 3.-3. 5-vuoden satunnaistettu, lumekontrolloitu tutkimus potilailla, joilla on heikentynyt sokerinsietokyky ja / tai heikentynyt paasto glukoosi. Sillä oli 2x2: n tekijäsuunnitelma, joka oli tarkoitettu arvioimaan AVANDIA: n ja erikseen ramipriilin (angiotensiiniä konvertoiva entsyymi-inhibiittori [ACEI]) vaikutusta etenemiseen avoimuuden diabetekseen. DREAM-ohjelmassa 2635 potilasta oli hoitoryhmissä, jotka sisälsivät AVANDIA: ta, ja 2634 potilasta olivat hoitoryhmissä, jotka eivät sisältäneet AVANDIA.Väliaikaiset tulokset on julkaistu 3: lla RECORD (Rosiglitazone arvioitu sydämen tuloksista ja glysemian säätelystä) Diabetes), meneillään oleva avoin, 6-vuotinen sydän- ja verisuonitulostutkimus tyypin 2 diabeetikoilla, joiden keskimääräinen hoito kesto 3,75 vuotta. RECORD sisältää potilaat, joilla metformiinin tai sulfonyyliurean monoterapia on epäonnistunut; ne, joilla metformiinin epäonnistuminen, satunnaistetaan saamaan joko lisäavustan AVANDIA tai lisäsulfonyyliurean, ja ne, jotka ovat epäonnistuneet sulfonyyliureasta, satunnaistetaan saamaan joko lisäosan AVANDIA tai lisäosan metformiini. RECORD-ohjelmassa yhteensä 2220 potilasta saa lisä AVANDIAa ja 2227 potilasta yhdellä lisäohjelmasta, joka ei sisällä AVANDIAa.
Näille kolmelle tutkimukselle suoritettiin analyysit käyttämällä yhdistelmää tärkeimmistä haitallisista kardiovaskulaarisista tapahtumista (sydäninfarkti, sydän- ja verisuoni-kuolema tai aivohalvaus), joihin viitataan jäljempänä nimellä MACE. Tämä päätetapa erottui metaanalyysin "sydänlihaksen iskeemisten tapahtumien laajasta päätepisteestä, joista yli puolet oli angina. Sydäninfarkti sisälsi tuomitun kuolemaan johtavan ja ei-kuolemaan johtavan sydäninfarktin sekä äkillisen kuoleman. Kuten kuvassa 2 esitetään, kolmen päätepisteen (MACE, MI ja kokonaiskuolleisuus) tulokset eivät olleet tilastollisesti merkitsevästi erilaisia AVANDIA: n ja vertailijoiden välillä.
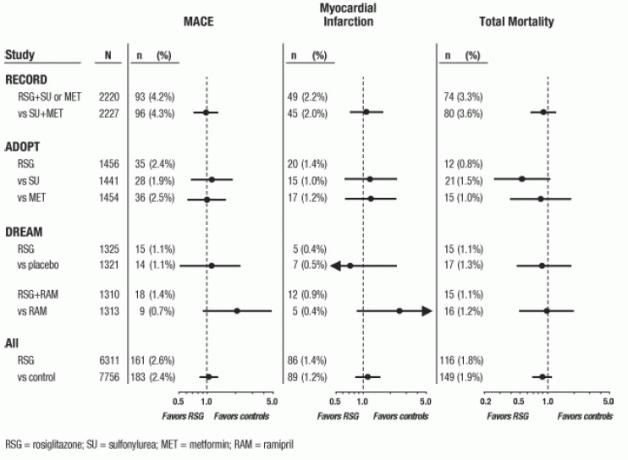
DREAM-tutkimuksen alustavissa analyyseissä kardiovaskulaaristen tapahtumien esiintyvyys oli suurempi potilailla, jotka saanut AVANDIAa yhdessä ramipriilin kanssa kuin potilailla, jotka saivat pelkästään ramipriilia, kuten kohdassa Kuvio 2. Tätä havaintoa ei vahvistettu ADOPT- ja RECORD-tutkimuksissa (aktiivisesti kontrolloidut tutkimukset diabeetikoilla), joissa vastaavasti 30% ja 40% potilaista ilmoitti ACE-estäjien käytön lähtötilanteessa.
Käytettävissä olevat tiedot sydänlihaksen iskemian riskistä ovat kokonaisuudessaan epätarkkoja. Tätä riskiä koskevat lopulliset johtopäätökset odottavat asianmukaisesti suunnitellun sydän- ja verisuonitulostutkimuksen loppuun saattamista.
AVANDIA: n tai minkään muun suun kautta otettavan diabeteksen käytön yhteydessä ei ole tehty kliinisiä tutkimuksia, jotka olisivat osoittaneet vakuuttavia todisteita makrovaskulaarisen riskin vähentämisestä.
Kongestiivinen sydämen vajaatoiminta ja sydänlihasiskemia AVANDIAn samanaikaisen käytön aikana insuliinin kanssa
Tutkimuksissa, joissa AVANDIA lisättiin insuliiniin, AVANDIA lisäsi kongestiivisen sydämen vajaatoiminnan ja sydänlihasiskemian riskiä. (Katso taulukko 2.)
AVANDIAn ja insuliinin samanaikaista käyttöä ei suositella. [See Käyttöaiheet ja käyttö ja VAROITUKSET JA VAROTOIMET.]
Viidessä, 26 viikon kontrolloidussa, satunnaistetussa, kaksoissokkotutkimuksessa, jotka sisältyivät metaanalyysiin [ks VAROITUKSET JA VAROTOIMET] tyypin 2 diabetes mellitusta sairastavat potilaat satunnaistettiin AVANDIA: n ja insuliinin (N = 867) tai insuliinin (N = 663) samanaikaiseen antoon. Näissä viidessä tutkimuksessa AVANDIA lisättiin insuliiniin. Näihin tutkimuksiin osallistui potilaita, joilla oli pitkäaikainen diabetes (keskimääräinen kesto 12 vuotta) ja joilla oli suuri esiintyvyys sairaudet, mukaan lukien perifeerinen neuropatia, retinopatia, iskeeminen sydänsairaus, verisuonitauti ja kongestiivinen sydän vajaatoiminta. Potilaita, joilla ilmeni kongestiivista sydämen vajaatoimintaa, oli 21 (2,4%) ja 7 (1,1%) AVANDIA plus insuliiniryhmässä ja insuliiniryhmissä. Potilaita, joilla oli esiintyvä sydänlihasiskemia, oli 24 (2,8%) ja 9 (1,4%) AVANDIA-potilailla plus insuliini- ja insuliiniryhmissä (TAI 2,1 [95% CI 0,9, 5,1]). Vaikka kongestiivisen sydämen vajaatoiminnan ja sydänlihasiskemian tapahtumaprosentti oli alhainen tutkituissa populaatiossa tapahtumaprosentti oli jatkuvasti 2-kertainen tai suurempi AVANDIA: n ja insuliini. Nämä sydän- ja verisuonitapahtumat havaittiin AVANDIA: n sekä 4 mg: n että 8 mg: n vuorokausiannoksilla. (Katso taulukko 2.)
Taulukko 2. Sydän- ja verisuonitapahtumien esiintyminen viidessä kontrolloidussa AVANDIA-tutkimuksen lisäyksessä vakiintuneeseen insuliinihoitoon
| Tapahtuma* | AVANDIA + insuliini (n = 867) n (%) |
insuliini (n = 663) n (%) |
| Sydämen vajaatoiminta | 21 (2.4%) | 7 (1.1%) |
| Sydänlihaksen iskemia | 24 (2.8%) | 9 (1.4%) |
| Yhdistelmä kardiovaskulaarista kuolemaa, sydäninfarktia tai aivohalvausta | 10 (1.2%) | 5 (0.8%) |
| tahti | 5 (0.6%) | 4 (0.6%) |
| Sydäninfarkti | 4 (0.5%) | 1 (0.2%) |
| Sydän- ja verisuonikuolema | 4 (0.5%) | 1 (0.2%) |
| Kaikki kuolemat | 6 (0.7%) | 1 (0.2%) |
| * Tapahtumat eivät ole yksinoikeudella; ts. potilas, jolla on sydän- ja infarktin aiheuttama kardiovaskulaarinen kuolema, lasketaan 4 tapahtumakategoriaan (sydänlihasiskemia; sydän- ja verisuonikuolema, sydäninfarkti tai aivohalvaus; sydäninfarkti; sydän- ja verisuonikuolema). |
Kuudennessa, 24 viikon kontrolloidussa, satunnaistetussa, kaksoissokkotutkimuksessa AVANDIAsta ja insuliinin samanaikaisesta käytöstä insuliinia lisättiin AVANDAMET®: iin. (rosiglitatsonimaleaatti ja metformiini-HCl) (n = 161) ja verrattuna insuliiniin plus plaseboon (n = 158), yhden sokean 8 viikon sisääntulon jälkeen AVANDAMETin. Farmakologista hoitoa tarvitsevat turvotuspotilaat ja kongestiivinen sydämen vajaatoiminta jätettiin tutkimuksen ulkopuolelle lähtötasolla ja aloitusjakson aikana.
AVANDAMETia plus insuliinia saaneessa ryhmässä oli yksi sydänlihaksen iskeeminen tapahtuma ja yksi äkillinen kuolema. Sydänlihasiskemiaa ei havaittu insuliiniryhmässä, eikä kongestiivista sydämen vajaatoimintaa raportoitu kummassakaan hoitoryhmässä.
turvotus
AVANDIAa tulee käyttää varoen turvotuspotilailla. Kliinisessä tutkimuksessa terveillä vapaaehtoisilla, jotka saivat 8 mg AVANDIAa kerran päivässä 8 viikon ajan, keskimääräinen plasmatilavuus kasvoi tilastollisesti merkitsevästi lumelääkkeeseen verrattuna.
Koska tiatsolidiinidionit, mukaan lukien rosiglitatsoni, voivat aiheuttaa nesteretention, mikä voi pahentaa tai aiheuttaen kongestiivista sydämen vajaatoimintaa, AVANDIAa tulee käyttää varoen potilaille, joilla on sydänriski vajaatoiminta. Potilaita on seurattava sydämen vajaatoiminnan oireiden ja oireiden varalta [ks LAATIKKO VAROITUS, VAROITUKSET JA VAROTOIMET ].
Kontrolloiduissa kliinisissä tutkimuksissa tyypin 2 diabetespotilailla, lievää tai kohtalaista turvotusta raportoitiin AVANDIA-hoitoa saaneilla potilailla, ja ne saattavat olla riippuvaisia annoksesta. Potilailla, joilla on jatkuva turvotus, oli todennäköisemmin turvotukseen liittyviä haittavaikutuksia, jos ne aloitettiin yhdistelmähoidolla insuliinin ja AVANDIAn kanssa [ks. HAITTAVAIKUTUKSET].
Painonnousu
Annokseen liittyvä painonnousu havaittiin pelkästään AVANDIA: lla ja yhdessä muiden hypoglykeemisten aineiden kanssa (taulukko 3). Painonnousumekanismi on epäselvä, mutta siihen liittyy todennäköisesti nesteretention ja rasvan kertymisen yhdistelmä.
Markkinoille saattamisen jälkeisessä kokemuksessa on ilmoitettu poikkeuksellisen nopeasta painon noususta ja lisääntymisestä, joka ylittää kliinisissä tutkimuksissa yleisesti havaitun. Potilaat, joilla kokee tällaista nousua, on arvioitava nesteen kertymisen ja tilavuuteen liittyvien tapahtumien, kuten liiallisen turvotuksen ja kongestiivisen sydämen vajaatoiminnan suhteen [ks. LAATIKKO VAROITUS].
Taulukko 3. Painon muutokset (kg) lähtötasosta loppupisteessä kliinisten tutkimusten aikana
| monoterapia | Kesto | Ohjausryhmä | AVANDIA 4 mg Mediaani (25., 75 persentiili) |
AVANDIA 8 mg Mediaani (25., 75 persentiili) |
|
| Mediaani (25., 75 persentiili) | |||||
| 26 viikkoa | plasebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 viikkoa | sulfonyyliurea | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Yhdistelmähoito | |||||
| sulfonyyliurea | 24-26 viikkoa | sulfonyyliurea | 0 (-1.0, 1.3) n = 1,155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| metformiini | 26 viikkoa | metformiini | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| insuliini | 26 viikkoa | insuliini | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonyyliurea + metformiini | 26 viikkoa | sulfonyyliurea + metformiini | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
4-6 vuoden monoterapiavertailussa, vertailevassa tutkimuksessa (ADOPT) potilailla, joilla on äskettäin diagnosoitu tyypin 2 diabetes, jota ei ole aiemmin hoidettu diabeteksen vastaisilla lääkkeillä [ks. Kliininen tutkimuss], painon mediaanimuutos (25%)th, 75th prosentilit) lähtötasosta 4 vuoden kohdalla oli 3,5 kg (0,0, 8,1) AVANDIA: lla, 2,0 kg (-1,0, 4,8) glyburidille ja -2,4 kg (-5,4, 0,5) metformiinille.
24-viikkoisessa tutkimuksessa 10–17-vuotiailla lapsipotilailla, joita hoidettiin AVANDIA 4–8 mg: lla vuorokaudessa, keskimääräinen painonnousu oli 2,8 kg (25).th, 75th prosenttipisteet: 0,0, 5,8) raportoitiin.
Maksan vaikutukset
Maksaentsyymit tulisi mitata ennen AVANDIA-hoidon aloittamista kaikilla potilailla ja säännöllisesti sen jälkeen terveydenhuollon ammattihenkilön kliinisen päätöksen perusteella. AVANDIA-hoitoa ei tule aloittaa potilailla, joilla maksaentsyymiarvot ovat kohonneet (ALAT> 2,5-kertainen normaalin yläraja). Potilaat, joilla maksan entsyymit ovat lievästi kohonneet (ALAT-tasot â ‰ 2,5 x normaalin yläraja) lähtötasolla tai AVANDIA-hoidon aikana tulee arvioida maksaentsyymien syyn selvittäminen korkeus. AVANDIA-hoidon aloittaminen tai jatkaminen potilailla, joilla on lievä maksaentsyymiarvo, tulee toimia varoen ja niihin kuuluu tiivis kliininen seuranta, mukaan lukien maksaentsyymien seuranta, sen selvittämiseksi, korjautuvatko maksaentsyymiarvot vai pahentaa. Jos ALAT-tasot nousevat milloin tahansa> 3x: n ylärajaan normaaliarvon yläpuolella AVANDIA-hoitoa saavilla potilailla, maksaentsyymitasot tulee tarkistaa mahdollisimman pian. Jos ALAT-tasot pysyvät yli 3X normin ylärajasta, AVANDIA-hoito on lopetettava.
Jos jollain potilaalla kehittyy maksan toimintahäiriöön viittaavia oireita, joihin voi kuulua selittämätön pahoinvointi, oksentelu, vatsakipu, väsymys, ruokahaluttomuus ja / tai tumma virtsa, maksaentsyymit on tarkistettava. Päätöksessä jatkaa potilaan hoitoa AVANDIA-hoidolla tulisi olla kliinisen päätöksen perusteella laboratorioarviointeihin asti. Jos keltaisuutta havaitaan, lääkehoito tulee lopettaa. [See HAITTAVAIKUTUKSET.]
Makulan turvotus
Makulaarista turvotusta on ilmoitettu markkinoille tulon jälkeisessä kokemuksessa joillakin diabeetikoilla, jotka ovat käyttäneet AVANDIAa tai muuta tiatsolidiinidionia. Joillakin potilailla näön hämärtyminen tai heikentynyt näkökyky on heikentynyt, mutta joillakin potilailla näyttää olevan diagnosoitu rutiininomainen oftalmologinen tutkimus. Useimmilla potilailla oli perifeerinen turvotus silloin, kun makulaödeema diagnosoitiin. Joillakin potilailla makulaödeema parani, kun tiatsolidiinidionin käyttö oli lopetettu. Diabetespotilailla tulee olla säännöllinen silmälääketutkimus silmälääkäriltä American Diabetes Associationin hoitostandardien mukaisesti. Lisäksi diabeetikko, joka ilmoittaa minkä tahansa näköoireen, tulee viipymättä lähettää silmälääkärille riippumatta potilaan taustalla olevista lääkkeistä tai muista fyysisistä havainnoista. [See HAITTAVAIKUTUKSET.]
murtumat
Äskettäin 4-6 vuoden vertailevassa tutkimuksessa (ADOPT) glykeemisen kontrollin kanssa monoterapiassa lääkkeillä aiemmin käyttämättömillä potilailla Kun diagnoosilla oli tyypin 2 diabetes mellitus, luunmurtumien esiintyvyyden lisääntyminen havaittiin naisilla, jotka käyttivät potilaita AVANDIA. 4 - 6 vuoden ajanjaksolla naisten luunmurtumien esiintyvyys oli 9,3% (60/645) AVANDIA: lla verrattuna 3,5%: iin (21/605) glyburidin ja 5,1% (30/590) metformiinin kohdalla. Tämä lisääntynyt esiintyvyys havaittiin ensimmäisen hoitovuoden jälkeen ja jatkui tutkimuksen aikana. Suurin osa AVANDIAa saaneiden naisten murtumista tapahtui olkavarteen, käsiin ja jalkaan. Nämä murtumakohdat eroavat niistä, jotka yleensä liittyvät postmenopausaaliseen osteoporoosiin (esim. Lonkka tai selkäranka). AVANDIA-hoitoa saaneilla miehillä ei havaittu murtumien lisääntymistä. Murtumisriski tulee ottaa huomioon hoidettaessa potilaita, erityisesti naispotilaita AVANDIA ja luiden terveyden arviointiin ja ylläpitoon nykyisten standardien mukaisesti kiinnitetty huomiota hoito.
Hematologiset vaikutukset
Keskimääräisen hemoglobiinin ja hematokriitin pieneneminen tapahtui annoksesta riippuen AVANDIA-hoitoa saaneilla aikuisilla potilailla [ks. HAITTAVAIKUTUKSET]. Havaitut muutokset voivat liittyä AVANDIA-hoidolla havaittuun lisääntyneeseen plasmamäärään.
Diabetes ja verensokerin hallinta
Potilailla, jotka saavat AVANDIAa yhdessä muiden hypoglykeemisten aineiden kanssa, saattaa olla hypoglykemian riski, ja samanaikaisen aineen annosta on ehkä pienennettävä.
Ajoittaiset paastoverensokeri- ja HbA1c-mittaukset tulisi suorittaa terapeuttisen vasteen seuraamiseksi.
ovulaatio
AVANDIA-hoito, kuten muut tiatsolidiinidionit, voi johtaa ovulaatioon joihinkin premenopausaalisiin anovulatoiviin naisiin. Seurauksena on, että näillä potilailla voi olla lisääntynyt raskausriski AVANDIA-hoidon aikana [ks Käyttö tietyissä populaatioissa]. Siksi riittävä ehkäisymenetelmä premenopausaalisilla naisilla tulisi suositella. Tätä mahdollista vaikutusta ei ole erityisesti tutkittu kliinisissä tutkimuksissa; siksi tämän esiintymistiheyttä ei tunneta.
Vaikka prekliinisissä tutkimuksissa on havaittu hormonaalista epätasapainoa [ks Ei-kliininen toksikologia], tämän löydöksen kliinistä merkitystä ei tunneta. Jos odottamattomia kuukautisten toimintahäiriöitä ilmenee, AVANDIA-hoidon jatkamisen hyötyjä tulee arvioida.
ylin
Haitalliset reaktiot
Kliinisen tutkimuksen kokemus
Aikuinen
Kliinisissä tutkimuksissa AVANDIAlla on hoidettu noin 9 900 tyypin 2 diabetesta sairastavaa potilasta.
AVANDIA: n lyhytaikaiset kokeet monoterapiana ja yhdessä muiden hypoglykeemisten aineiden kanssa
Tapauksessa 4 esitetään haittavaikutusten esiintyvyys ja tyypit AVANDIA-hoidon lyhytaikaisissa kliinisissä tutkimuksissa monoterapiana.
Taulukko 4. Haittavaikutukset ((‰ 5% kaikissa hoitoryhmissä) potilaiden ilmoittamat lyhytaikaisissa * kaksoissokkoutetuissa kliinisissä tutkimuksissa, joissa AVANDIA on monoterapia
| Haluttu termi | AVANDIA monoterapia N = 2 526 % |
Plasebo N = 601 % |
metformiini N = 225 % |
Sulfonylureasâ € N = 626 % |
| Ylähengitysteiden infektio | 9.9 | 8.7 | 8.9 | 7.3 |
| vahinko | 7.6 | 4.3 | 7.6 | 6.1 |
| Päänsärky | 5.9 | 5.0 | 8.9 | 5.4 |
| Selkäkipu | 4.0 | 3.8 | 4.0 | 5.0 |
| hyperglykemia | 3.9 | 5.7 | 4.4 | 8.1 |
| Väsymys | 3.6 | 5.0 | 4.0 | 1.9 |
| poskiontelotulehdus | 3.2 | 4.5 | 5.3 | 3.0 |
| Ripuli | 2.3 | 3.3 | 15.6 | 3.0 |
| hypoglykemia | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Lyhytaikaiset tutkimukset vaihtelivat 8 viikosta 1 vuoteen. †Sisältää potilaat, jotka saavat glyburidia (N = 514), gliklatsidia (N = 91) tai glipitsidiä (N = 21). |
Kaiken kaikkiaan AVANDIAa käytettäessä ilmoitetut haittavaikutustyypit ottamatta huomioon syy-yhteyttä yhdessä sulfonyyliurean tai metformiinin kanssa olivat samanlaisia kuin monoterapiassa AVANDIA.
Anemian ja turvotuksen tapahtumista yleensä ilmoitettiin suuremmissa annoksissa, ja ne olivat yleensä lieviä tai keskivaikeita eikä yleensä vaadi AVANDIA-hoidon keskeyttämistä.
Tuplasokeissa tutkimuksissa anemiaa ilmoitettiin 1,9%: lla AVANDIA-monoterapiaa saaneista potilaista, kun taas plaseboa saaneiden 0,7%: n, sulfonyyliureoiden 0,6%: lla ja metformiinin ryhmässä 2,2%. Anemiaa ilmoitettiin enemmän potilailla, joita hoidettiin AVANDIA: n ja metformiinin yhdistelmällä (7,1%) ja AVANDIA ja sulfonyyliureat sekä metformiini (6,7%) verrattuna monoterapiaan AVANDIA: lla tai yhdistelmänä sulfonyyliurean kanssa (2.3%). Metformiiniyhdistelmäkliinisiin tutkimuksiin osallistuneiden potilaiden alhaisemmat esikäsittelyä edeltävät hemoglobiini / hematokriititasot ovat saattaneet osaltaan lisätä anemian ilmoittamisprosenttia näissä tutkimuksissa [ks. HAITTAVAIKUTUKSET].
Kliinisissä tutkimuksissa ödeemaa ilmoitettiin 4,8%: lla AVANDIA-monoterapiaa saaneista potilaista, kun taas lumelääkeryhmässä 1,3%, sulfonyyliureoissa 1,0% ja metformiinilla 2,2%. Turvotusten esiintyvyys oli suurempi AVANDIA 8 mg: n tapauksessa sulfonyyliureakombinaatioissa (12,4%) verrattuna muihin yhdistelmiin insuliinia lukuun ottamatta. Turvotusta ilmoitettiin 14,7%: lla AVANDIAa saaneista potilaista insuliinikombinaatiotutkimuksissa verrattuna 5,4%: iin pelkästään insuliinin yhteydessä. Raportteja uudesta kongestiivisen sydämen vajaatoiminnan puhkeamisesta tai pahenemisesta tapahtui 1%: lla pelkästään insuliinilla ja 2% (4 mg) ja 3% (8 mg) insuliinilla yhdessä AVANDIA: n kanssa [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET].
Kontrolloiduissa yhdistelmähoitotutkimuksissa sulfonyyliureoilla ilmoitettiin lieviä tai kohtalaisia hypoglykemiaoireita, jotka näyttävät olevan riippuvaisia annoksesta. Harva potilas vetäytyi hypoglykemian vuoksi (<1%), ja harvojen hypoglykemiajakson katsottiin olevan vakava (<1%). Hypoglykemia oli yleisimmin ilmoitettu haittavaikutus kiinteäannoksisissa insuliinikombinaatiotutkimuksissa, vaikka harvat potilaat vetäytyivät hypoglykemian takia (4: lla 408: sta AVANDIA plus insuliini ja 1: lla 203: sta insuliinia) yksin). Hypoglykemian määrät, jotka vahvistetaan kapillaarisen verensokeripitoisuudella 50 mg / dl, olivat 6% pelkästään insuliinin suhteen ja 12% (4 mg) ja 14% (8 mg) insuliinin yhdistelmässä AVANDIA: n kanssa. [See VAROITUKSET JA VAROTOIMET.]
AVANDIAn pitkäaikainen tutkimus monoterapiana
4-6-vuotisessa tutkimuksessa (ADOPT) verrattiin AVANDIA: n (n = 1 456), glyburidin (n = 1 441) ja metformiinin (n = 1 454) käyttöä monoterapia potilaille, joilla on äskettäin diagnosoitu tyypin 2 diabetes, joita ei ole aikaisemmin hoidettu diabeteslääkkeillä lääkitys. Taulukossa 5 esitetään haittavaikutukset ottamatta huomioon syy-yhteyttä; prosenttimäärät ilmaistaan 100 potilasvuotta kohti (PY), ottaen huomioon tutkimuksen lääkkeille altistumisen erot kolmella hoitoryhmällä.
ADOPT-hoidossa murtumia ilmoitettiin suuremmalla määrällä AVANDIA-hoitoa saaneita naisia (9,3%, 2,7 / 100 potilasvuosia) verrattuna glyburidiin (3,5%, 1,3 / 100 potilasvuotta) tai metformiiniin (5,1%, 1,5 / 100) potilasvuotta).
Suurin osa rosiglitatsonia saaneiden naisten murtumista ilmoitettiin olkavarteen, käsiin ja jalkaan. [See VAROITUKSET JA VAROTOIMET.] Miespotilaiden havaittu murtumien esiintyvyys oli samanlainen kolmella hoitoryhmällä.
Taulukko 5. Hoitoon kohdistuvat haittatapahtumat (â ‰ ¥ 5 tapahtumaa / 100 potilasvuotta [PY]) missä tahansa hoitoryhmässä, joka raportoitiin AVANDIAn 4–6-vuotisessa kliinisessä tutkimuksessa monoterapiana (ADOPT)
| AVANDIA N = 1,456 PY = 4,954 |
glyburide N = 1 441 PY = 4 244 |
metformiini N = 1,454 PY = 4 906 |
|
| nasofaryngiitti | 6.3 | 6.9 | 6.6 |
| Selkäkipu | 5.1 | 4.9 | 5.3 |
| nivelkipu | 5.0 | 4.8 | 4.2 |
| verenpainetauti | 4.4 | 6.0 | 6.1 |
| Ylähengitysteiden infektio | 4.3 | 5.0 | 4.7 |
| hypoglykemia | 2.9 | 13.0 | 3.4 |
| Ripuli | 2.5 | 3.2 | 6.8 |
pediatrinen
Avandian turvallisuutta on arvioitu yhdessä, aktiivisesti kontrolloidussa tutkimuksessa tyypin 2 diabeteksen kanssa lapsipotilailla, joissa 99 hoidettiin Avandialla ja 101 hoidettiin metformiinilla. Yleisimmät haittavaikutukset (> 10%) ottamatta huomioon syy-yhteyttä Avandiassa tai metformiinissa olivat päänsärky (17% vs. 14%), pahoinvointi (4% vs. 11%), nenänieluntulehdus (3% vs. 12%) ja ripuli (1% vs. 13%). Tässä tutkimuksessa ilmoitettiin yhdestä diabeettisesta ketoasidoositapauksesta metformiiniryhmässä. Lisäksi rosiglitatsoniryhmässä oli 3 potilasta, joiden FPG oli> 300 mg / dl, 2 + ketonuria ja kohonnut anioniväli.
Laboratorion poikkeavuudet
hematologic
Keskimääräisen hemoglobiinin ja hematokriitin lasku tapahtui annoksesta riippuen hoidetuilla aikuisilla potilailla Avandian kanssa (keskimääräiset laskut yksittäisissä tutkimuksissa jopa 1,0 g / dl hemoglobiinia ja jopa 3,3% hematokriitti). Muutokset tapahtuivat pääasiassa kolmen ensimmäisen kuukauden aikana Avandia-hoidon aloittamisen jälkeen tai Avandia-annoksen suurentamisen jälkeen. Alennusten kulku ja suuruus olivat samanlaiset potilailla, joita hoidettiin Avandian ja muiden hypoglykeemisten lääkkeiden yhdistelmällä tai Avandian monoterapialla. Hoitoa edeltäneet hemoglobiinin ja hematokriitin tasot olivat alhaisemmat metformiiniyhdistelmätutkimuksissa olevilla potilailla, ja ne saattoivat osaltaan lisätä anemian ilmoittamisprosenttia. Yhdessä tutkimuksessa lapsipotilailla ilmoitettiin hemoglobiinin ja hematokriitin laskua (keskimäärin 0,29 g / dl ja 0,95%). Pieniä hemoglobiinin ja hematokriitin laskuja on ilmoitettu myös Avandialla hoidetuilla lapsipotilailla. Valkosolujen määrä laski myös hieman aikuisilla, Avandia-hoitoa saaneilla potilailla. Hematologisten parametrien lasku voi liittyä Avandia-hoidolla havaittuun lisääntyneeseen plasmamäärään.
lipidejä
Seerumin lipidien muutoksia on havaittu aikuisilla tehdyn Avandia-hoidon jälkeen [ks Kliininen farmakologia ]. Pieniä muutoksia seerumin lipidiparametreissa ilmoitettiin lapsilla, joita hoidettiin Avandialla 24 viikon ajan.
Seerumin transaminaasitasot
Hyväksyntää edeltävissä kliinisissä tutkimuksissa 4598 Avandialla hoidetulla potilaalla (3 600 potilasvuotta altistumista) ja pitkällä aikavälillä 4- 6-vuoden tutkimuksessa 1 456 Avandialla hoidetulla potilaalla (4 954 potilasvuotta altistuminen), ei ollut näyttöä lääkkeiden aiheuttamasta maksatoksisuus.
Ennakkohyväksyntää koskevissa kontrolloiduissa tutkimuksissa 0,2%: lla Avandia-hoitoa saaneista potilaista ALAT-arvot nousivat> 3x normin ylärajaan verrattuna 0,2%: iin lumelääkeryhmässä ja 0,5%: iin aktiivisten vertailijoiden kohdalla. ALAT-arvon nousu Avandialla hoidetuilla potilailla oli palautuvaa. Hyperbilirubinemia todettiin 0,3%: lla Avandia-hoitoa saaneista potilaista, kun taas 0,9%: lla lumelääkehoitoa saaneista ja 1%: lla potilaista, joita hoidettiin aktiivisilla vertailuarvoilla. Hyväksyntää edeltävissä kliinisissä tutkimuksissa ei ollut tapauksia idiosykraattisista lääkereaktioista, jotka johtaisivat maksan vajaatoimintaan. [See Varoitukset ja varotoimet]
4-6-vuotisessa ADOPT-tutkimuksessa potilaat, joita hoidettiin Avandialla (4 954 potilasvuotta), glyburidilla (4 244 potilasvuotta) tai metformiinilla (4 906 potilasvuotta altistuminen) monoterapiana samanaikainen ALAT-arvon nousu nousi yli 3-kertaiseen normin ylärajaan (0,3 / 100 potilasvuotta) valotus).
Markkinoinnin jälkeinen kokemus
Kliinisissä tutkimuksissa ilmoitettujen haittavaikutusten lisäksi alla kuvatut tapahtumat on tunnistettu Avandian käytön jälkeen hyväksynnän jälkeen. Koska näitä tapahtumia ilmoitetaan vapaaehtoisesti populaatiolta, jonka koko on tuntematon, ei ole mahdollista arvioida luotettavasti niiden esiintymistiheyttä tai aina osoittaa syy-yhteys huumeiden altistumiseen.
Tiatsolidiinidionihoitoa saaneilla potilailla voi olla vakavia haittavaikutuksia, jotka voivat johtaa kuolemaan johtaviin seurauksiin tai ilman niitä liittyneenä tilavuuden laajenemiseen (esim. kongestiivinen sydämen vajaatoiminta, keuhkoödeema ja keuhkopussin effuusiot) on raportoitu [katso Varoitus ruudussa ja Varoitukset ja varotoimet].
Markkinoille saattamisen jälkeisiä raportteja on esiintynyt hepatiitin avandiassa, maksaentsyymiarvojen nousussa vähintään kolme kertaa normaalin yläraja ja maksan vajaatoiminta kuolemaan johtavien tulosten kanssa ja ilman niitä, vaikka syy-yhteyttä ei ole ollut perusti.
Ihottumaa, kutinaa, nokkosihottumaa, angioedeemaa, anafylaktisia reaktioita ja Stevens-Johnsonin oireyhtymää on raportoitu harvoin.
On myös saatu ilmoituksia diabeettisen makulaödeeman puhkeamisesta tai pahenemisesta, jonka näkökyky on heikentynyt [ks Varoitukset ja varotoimet].
ylin
Lääkkeiden yhteisvaikutukset
CYP2C8-estäjät ja induktorit
CYP2C8: n estäjä (esim. Gemfibrozili) voi lisätä rosiglitatsonin AUC: ta ja CYP2C8: n indusoija (esim. Rifampiini) voi vähentää rosiglitatsonin AUC: ta. Siksi, jos CYP2C8: n estäjä tai indusoija aloitetaan tai lopetetaan rosiglitatsonihoidon aikana, diabeteksen hoidossa voidaan tarvita muutoksia kliinisen vasteen perusteella. [See KLIININEN FARMAKOLOGIA.]
ylin
Käyttö tietyissä populaatioissa
raskaus
Raskausluokka C.
Kaikilla raskauksilla on taustan riski syntymävaurioista, menetyksistä tai muista haitallisista seurauksista riippumatta lääkealtistuksesta. Tämä taustariski kasvaa raskauksissa, joita vaikeuttaa hyperglykemia, ja se voi vähentyä, jos aineenvaihdunnan hallinta on hyvä. Diabetespotilailla tai raskausdiabetesta kärsivillä potilailla on välttämätöntä ylläpitää hyvää aineenvaihdunnan hallintaa ennen raskautta ja koko raskauden ajan. Näiden potilaiden glukoosipitoisuuden tarkka seuranta on välttämätöntä. Useimmat asiantuntijat suosittelevat, että insuliinimonoterapiaa käytetään raskauden aikana, jotta verensokeritasot pysyisivät mahdollisimman lähellä normaalia.
Ihmiset: Rosiglitatsonin on ilmoitettu läpäisevän ihmisen istukan ja osoittavissa olevan sikiön kudoksessa. Näiden löydösten kliinistä merkitystä ei tunneta. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. AVANDIAa ei tule käyttää raskauden aikana.
Eläintutkimukset: Rosiglitatsonihoidolla ei ollut vaikutusta implantointiin tai alkioihin varhaisen raskauden aikana rotilla, mutta Hoito keski-myöhään raskauden aikana liittyi sikiön kuolemaan ja kasvun hidastumiseen sekä rotilla että kaneilla. Teratogeenisuutta ei havaittu annoksilla, jotka olivat korkeintaan 3 mg / kg rotilla ja 100 mg / kg kaneilla (noin 20-kertainen ihmisen AUC-arvoon ja 75-kertaiseen ihmisen suositeltuun vuorokausiannokseen 75-kertaisesti). Rosiglitatsoni aiheutti istukan patologiaa rotilla (3 mg / kg / päivä). Rotien hoitaminen raskauden aikana imetyksen aikana vähensi pentueen kokoa, vastasyntyneen elinkykyä ja synnytyksen jälkeistä kasvua, ja kasvun hidastuminen oli palautuvaa murrosiän jälkeen. Istukkeeseen, alkioon / sikiöön ja jälkeläisiin kohdistuvien vaikutusten osalta vaikutukseton annos oli 0,2 mg / kg / päivä rotilla ja 15 mg / kg / päivä kaneilla. Nämä vaikutuksettomat tasot ovat noin 4-kertaiset ihmisen AUC-arvon kanssa ihmisen suurimmassa suositusannossa. Rosiglitatsoni vähensi kohdun istutusten ja elävien jälkeläisten lukumäärää, kun nuoria naarasrotia hoidettiin 40 ° C: ssa. mg / kg / päivä 27 päivän iästä seksuaaliseen kypsyyteen (noin 68-kertainen ihmisen AUC-arvo enimmäissuosituksena päivittäin annos). Vaikuttamaton taso oli 2 mg / kg / päivä (suunnilleen 4-kertainen ihmisen AUC-arvon kanssa suurimmassa suositellussa päiväannoksessa). Ei ollut vaikutusta pre- tai postnataaliseen eloonjäämiseen tai kasvuun.
Työ ja toimitus
Rosiglitatsonin vaikutusta synnytykseen ja synnytykseen ihmisillä ei tunneta.
Imettävät äidit
Lääkkeisiin liittyvä aine löydettiin maitoa imettävistä rotista. Ei tiedetä erittyykö AVANDIA äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, AVANDIAa ei tule antaa imettävälle naiselle.
Lasten käyttö
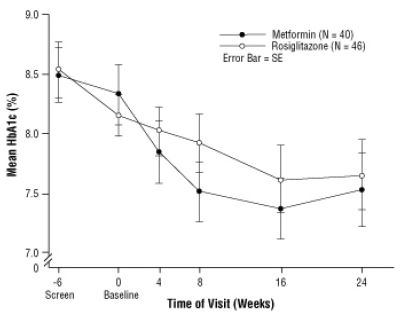
Lumelääkevalmistelun jälkeen, mukaan lukien ruokavalioneuvonta, tyypin 2 diabetes mellitusta saaneet lapset, ikäiset 10–17-vuotiaat ja joiden lähtötason keskimääräinen kehon massaindeksi (BMI) on 33 kg / m, satunnaistettiin hoitoon 2 mg kahdesti päivässä AVANDIA (n = 99) tai 500 mg kahdesti päivässä metformiinia (n = 101) 24 viikon kaksoissokkotutkimuksessa. oikeudenkäyntiä. Odotetusti FPG laski potilailla, jotka eivät olleet saaneet diabeteslääkettä (n = 104), ja lisääntyivät potilailla, jotka olivat lopettaneet aikaisemman lääkityksen (yleensä metformiini) (n = 90) aloitusajanjakson aikana. Ainakin 8 viikon hoidon jälkeen 49%: lla AVANDIA: lla hoidetuista potilaista ja 55%: lla metformiinilla hoidetuista potilaista annos kaksinkertaistui, jos FPG> 126 mg / dL. Kokonaislääkehoitopopulaatiossa viikolla 24 HbA1c: n keskimääräinen muutos lähtötasosta oli -0,14% AVANDIA: lla ja -0,49% metformiinin kanssa. Tässä tutkimuksessa ei ollut riittävästi potilaita voidakseen tilastollisesti määrittää, onko kyse näistä
havaitut keskimääräiset hoidon vaikutukset olivat samanlaisia tai erilaisia. Hoitovaikutukset vaihtelivat potilailla, jotka eivät olleet saaneet diabeteslääkehoitoa, ja potilailla, joita oli aikaisemmin hoidettu diabeteksen vastaisella terapialla (taulukko 6).
Taulukko 6. Viikko 24 FPG- ja HbA1c-arvot muuttuvat lähtötasosta viimeisimmän havainnon perusteella eteenpäin lapsilla, joiden HbA1c-lähtötaso on> 6,5%
| En ole potilaita | Aikaisemmin hoidetut potilaat | |||
|
metformiini N = 40 |
rosiglitatsoni N = 45 |
metformiini N = 43 |
rosiglitatsoni N = 32 |
|
| FPG (mg / dL) | ||||
| Perustaso (keskiarvo) | 170 | 165 | 221 | 205 |
| Muutos lähtötasoon nähden (keskiarvo) | -21 | -11 | -33 | -5 |
| Oikaistu hoitoero * (rosiglitatsoni-metformiini) â € (95% CI) | 8 (-15, 30) |
21 (-9, 51) |
||
| % potilaista, joilla â with ¥ 30 mg / dL, lasku lähtötasosta | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Perustaso (keskiarvo) | 8.3 | 8.2 | 8.8 | 8.5 |
| Muutos lähtötasoon nähden (keskiarvo) | -0.7 | -0.5 | -0.4 | 0.1 |
| Oikaistu hoitoero * (rosiglitatsoni-metformiini) â € (95% CI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % potilaista, joilla <0,7% laskua lähtötasosta | 63% | 52% | 54% | 31% |
|
* Muutos perustasoon nähden on vähiten neliösummaa tarkoittaa säätämistä perustasolle HbA1c, sukupuolelle ja alueelle. †Eroon positiiviset arvot suosivat metformiinia. |
Hoitoerot riippuivat lähtötilanteen BMI: stä tai painosta siten, että AVANDIA: n ja metformiinin vaikutukset näyttivät paremmin vertailukelpoisiksi raskaampien potilaiden välillä. Keskimääräinen painonnousu oli 2,8 kg rosiglitatsonilla ja 0,2 kg metformiinilla [ks VAROITUKSET JA VAROTOIMET]. 54 prosenttia rosiglitatsonilla hoidetuista potilaista ja 32% metformiinilla hoidetuista potilaista sai patients ¥ kg, ja 33% rosiglitatsonilla hoidetuista potilaista ja 7% metformiinilla hoidetuista potilaista sai ≥ 5 kg opiskella.
Tässä tutkimuksessa havaitut haittavaikutukset on kuvattu osassa Haittavaikutukset).
Kuvio 3. Keskimääräinen HbA1c ajan myötä AVANDIA: n ja metformiinin 24 viikon tutkimuksessa lapsipotilailla - Drug-Naïve-alaryhmä
Geriatrinen käyttö
Populaatiofarmakokineettisen analyysin tulokset osoittivat, että ikä ei vaikuta merkittävästi rosiglitatsonin farmakokinetiikkaan [ks. KLIININEN FARMAKOLOGIA]. Sen vuoksi vanhusten annosta ei tarvitse muuttaa. Kontrolloiduissa kliinisissä tutkimuksissa ei havaittu yleisiä eroja turvallisuudessa ja tehokkuudessa vanhempien (¥ ‰ years 65-vuotiaat) ja nuorempien (<65-vuotiaat) potilaiden välillä.
ylin
yliannostus
Ihmisten yliannostuksesta on rajoitetusti tietoa. Vapaaehtoisilla tehdyissä kliinisissä tutkimuksissa AVANDIA-valmistetta on annettu yhtenä kerta-annoksena, joka on korkeintaan 20 mg, ja se oli hyvin siedetty. Yliannostuksen yhteydessä on aloitettava asianmukainen tukihoito potilaan kliinisen tilan mukaan.
ylin
Kuvaus
AVANDIA (rosiglitatsonimaleaatti) on suun kautta otettava diabeteslääke, joka vaikuttaa ensisijaisesti lisäämällä insuliiniherkkyyttä. AVANDIA parantaa verensokeritasapainoa vähentäen samalla verenkierron insuliinitasoja.
Rosiglitatsonimaleaatti ei ole kemiallisesti tai toiminnallisesti sukulainen sulfonyyliureoihin, biguanideihin tai alfa-glukosidaasin estäjiin.
Kemiallisesti rosiglitatsonimaleaatti on (±) -5 - [[4- [2- (metyyli-2-pyridinyyliamino) etoksi] fenyyli] metyyli] -2,4-tiatsolidiinidioni, (Z) -2-buteenidioaatti (1: 1) molekyylipainolla 473,52 (357,44 vapaa emäs). Molekyylillä on yksi kiraalinen keskus ja se on läsnä rasemaattina. Nopean muunnoksen takia enantiomeerit ovat toiminnallisesti erottamattomia. Rosiglitatsonimaleaatin rakennekaava on:
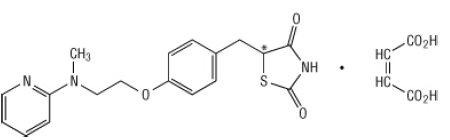
Molekyylikaava on C18H19N3O3S-C4H4O4. Rosiglitatsonimaleaatti on valkoinen tai luonnonvalkoinen kiinteä aine, jonka sulamispiste on välillä 122 - 123 ° C. Rosiglitatsonimaleaatin pKa-arvot ovat 6,8 ja 6,1. Se liukenee helposti etanoliin ja a puskuroitu vesiliuos, jonka pH on 2,3; liukoisuus laskee pH: n noustessa fysiologisessa alue.
Jokainen viisikulmainen kalvopäällysteinen TILTAB-tabletti sisältää rosiglitatsonimaleaattia, joka vastaa 2 mg: n, 4 mg: n tai 8 mg: n rosiglitatsonia, suun kautta annettavaksi. Inaktiiviset aineosat ovat: Hypromelloosi 2910, laktoosimonohydraatti, magnesiumstearaatti, mikrokiteinen selluloosa, polyeteeniglykoli 3000, natriumtärkkelysglykolaatti, titaanidioksidi, triasetiini ja vähintään yksi seuraavista: synteettiset punaiset ja keltaiset rautaoksidit ja talkki.
ylin
Kliininen farmakologia
Toimintamekanismi
Tiatsolidiinidioniryhmän antidiabeettisten aineiden ryhmään kuuluva rosiglitatsoni parantaa glykeemistä hallintaa parantamalla insuliiniherkkyyttä. Rosiglitatsoni on erittäin selektiivinen ja voimakas agonisti peroksisomiproliferaattorilla aktivoidulle reseptor gammalle (PPARØ). Ihmisillä PPAR-reseptoreita löytyy tärkeimmistä insuliinitoiminnan kohdekudoksista, kuten rasvakudoksesta, luu-lihaksesta ja maksasta. PPARγ-ydinreseptoreiden aktivointi säätelee insuliinivasteisten geenien transkriptiota, jotka osallistuvat glukoosin tuotannon, kuljetuksen ja käytön hallintaan. Lisäksi PPARγ-reagoivat geenit osallistuvat myös rasvahappojen metabolian säätelyyn.
Insuliiniresistenssi on yleinen piirre tyypin 2 diabeteksen patogeneesille. Rosiglitatsonin diabeteksen vastainen vaikutus on osoitettu tyypin 2 diabeteksen eläinmalleissa vuonna 2003 mikä hyperglykemia ja / tai heikentynyt glukoositoleranssi on seurausta kohteen insuliiniresistenssistä kudoksia. Rosiglitatsoni vähentää verensokeripitoisuuksia ja vähentää liikalihavien / liikalihavien hiirien, db / db-diabeettisten hiirien ja rasva-rasvaisen Zucker-rottien hyperinsulinemiaa.
Eläinmalleissa rosiglitatsonin antidiabeettisen vaikutuksen osoitettiin välittyvän lisääntyneellä herkkyydellä insuliinin vaikutukselle maksassa, lihaksissa ja rasvakudoksissa. Farmakologiset tutkimukset eläinmalleissa osoittavat, että rosiglitatsoni estää maksan glukoneogeneesiä. Insuliinin säätelemän glukoosin kuljettajan GLUT-4: n ilmentyminen lisääntyi rasvakudoksessa. Rosiglitatsoni ei aiheuttanut hypoglykemiaa tyypin 2 diabeteksen eläinmalleissa ja / tai heikentyneen sokerin sietokyvyn suhteen.
farmakodynamiikka
Potilaita, joilla oli lipidien poikkeavuuksia, ei jätetty ulkopuolelle AVANDIAn kliinisistä tutkimuksista.
Kaikissa 26 viikon kontrolloiduissa tutkimuksissa suositellulla annosalueella AVANDIA monoterapiana liittyi kokonaiskolesterolin, LDL: n ja HDL: n nousuun ja vapaiden rasvahappojen vähenemiseen. Nämä muutokset olivat tilastollisesti merkitsevästi erilaisia kuin lumelääke- tai glyburidikontrolleissa (taulukko 7).
LDL-arvon nousu tapahtui pääasiassa AVANDIA-hoidon ensimmäisen 1-2 kuukauden aikana, ja LDL-tasot pysyivät koholla perustasoon kaikissa tutkimuksissa. Sen sijaan HDL jatkoi nousuaan ajan myötä. Seurauksena oli, että LDL / HDL-suhde saavutti huippunsa 2 kuukauden hoidon jälkeen ja näytti sitten laskevan ajan myötä. Lipidimuutosten ajallisen luonteen vuoksi 52 viikon glyburidiohjattu tutkimus on sopivin arvioimaan lipideihin kohdistuvia pitkäaikaisia vaikutuksia. Perustasolla, viikolla 26 ja viikolla 52, keskimääräiset LDL / HDL-suhteet olivat vastaavasti 3,1, 3,2 ja 3,0, AVANDIA 4 mg: n kahdesti päivässä, vastaavasti. Glyburidin vastaavat arvot olivat 3,2, 3,1 ja 2,9. AVANDIA: n ja glyburidin väliset muutokset lähtötilanteesta viikolla 52 olivat tilastollisesti merkitseviä.
LDL- ja HDL-muutosten malli AVANDIA-hoidon ja muiden hypoglykeemisten aineiden yhdistelmähoidon jälkeen olivat yleensä samanlaisia kuin AVANDIA-hoidossa monoterapiassa.
Triglyseridien muutokset AVANDIA-hoidon aikana olivat vaihtelevia eivätkä yleensä poikenneet tilastollisesti lumelääke- tai glyburidikontrolleista.
Taulukko 7. Yhteenveto keskimääräisistä lipidimuutoksista 26 viikon plasebokontrolloidussa ja 52 viikon glyburidiohjatussa monoterapiakokeessa
| Lumekontrolloidut tutkimukset, viikko 26 | Glyburide-ohjattu tutkimusviikko 26 ja viikko 52 | ||||||
| Plasebo | AVANDIA | Glyburidititraus | AVANDIA 8 mg | ||||
| 4 mg päivässä * | 8 mg päivässä * | Viikko 26 | Viikko 52 | Viikko 26 | Viikko 52 | ||
| Vapaat rasvahapot | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Perustaso (keskiarvo)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Muutos lähtötasoon nähden (keskiarvo) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Perustaso (keskiarvo)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Muutos lähtötasoon nähden (keskiarvo) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Perustaso (keskiarvo)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Muutos lähtötasoon nähden (keskiarvo) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Annosteluryhmät yhdistettiin kerran päivässä ja kahdesti päivässä. |
farmakokinetiikkaa
Rosiglitatsonin enimmäispitoisuus plasmassa (Cmax) ja käyrän alla oleva pinta-ala (AUC) kasvavat suhteessa annokseen terapeuttisella annosalueella (taulukko 8). Eliminaation puoliintumisaika on 3 - 4 tuntia ja se on riippumaton annoksesta.
Taulukko 8. Rosiglitatsonin keskimääräiset (SD) farmakokineettiset parametrit yksittäisten suun kautta annettavien annosten jälkeen (N = 32)
| Parametri | 1 mg paasto | 2 mg paasto | 8 mg paasto | 8 mg syöttöä |
| AUC0-inf [Ng-h / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [Ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Puolikas elämä [H] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / h] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = Suullinen puhdistuma. |
imeytyminen
Rosiglitatsonin absoluuttinen hyötyosuus on 99%. Huippupitoisuudet plasmassa havaitaan noin tunnin kuluttua annosta. Rosiglitatsonin antaminen ruuan kanssa ei aiheuttanut muutosta kokonaisaltistuksessa (AUC), mutta Cmax laski noin 28% ja Tmax viivästyi (1,75 tuntia). Nämä muutokset eivät todennäköisesti ole kliinisesti merkittäviä; siksi AVANDIA voidaan antaa ruuan kanssa tai ilman.
Jakelu
Rosiglitatsonin keskimääräinen (CV%) suun kautta jakautumistilavuus (Vss / F) on noin 17,6 (30%) litraa, perustuen populaation farmakokineettiseen analyysiin. Rosiglitatsoni sitoutuu noin 99,8%: iin plasmaproteiineihin, pääasiassa albumiiniin.
aineenvaihdunta
Rosiglitatsoni metaboloituu laajasti ilman, että muuttumaton lääke erittyy virtsaan. Metabolian pääreitit olivat N-demetylointi ja hydroksylaatio, mitä seurasi konjugointi sulfaatin ja glukuronihapon kanssa. Kaikki kiertävät metaboliitit ovat huomattavasti vähemmän tehokkaita kuin vanhemmat, ja siksi niiden ei odoteta edistävän rosiglitatsonin insuliinia herkistävää vaikutusta.
In vitro -tiedot osoittavat, että rosiglitatsoni metaboloituu pääasiassa sytokromi P450 (CYP) isoentsyymin 2C8 kanssa, ja CYP2C9 myötävaikuttaa vähäisessä määrin.
eritys
[14C] rosiglitatsonimaleaatin oraalisen tai laskimonsisäisen annon jälkeen noin 64% annoksesta erittyi virtsaan ja 23% ulosteeseen. [14C]: een liittyvän materiaalin puoliintumisaika plasmassa vaihteli välillä 103-158 tuntia.
Populaation farmakokinetiikka tyypin 2 diabeetikoilla
Väestön farmakokineettinen analyysi kolmesta suuresta kliinisestä tutkimuksesta, joihin osallistui 642 miestä ja 405 naista, joilla oli tyypin 2 diabetes (35 - vuotiaita) 80-vuotiaita) osoitti, että ikä, rotu, tupakointi tai alkoholi eivät vaikuta rosiglitatsonin farmakokinetiikkaan kulutus. Sekä suun kautta tapahtuvan puhdistuman (CL / F) että suun kautta tapahtuvan vakaan tilan jakautumistilavuuden (Vss / F) osoitettiin lisääntyvän painon noustessa. Näissä analyyseissä havaitulla painoalueella (50-150 kg) ennustettujen CL / F- ja Vss / F-arvojen alue vaihteli vastaavasti <1,7-kertaisesti ja <2,3-kertaiseksi.
Lisäksi rosiglitatsoni CL / F: n osoitettiin vaikuttavan sekä painosta että sukupuolesta, koska se oli pienempi (noin 15%) naispotilailla.
Erityisväestöt
geriatrinen
Populaatiofarmakokineettisen analyysin tulokset (n = 716 <65 vuotta; n = 331 - 65 vuotta) osoitti, että ikä ei vaikuta merkittävästi rosiglitatsonin farmakokinetiikkaan.
sukupuoli
Populaatiofarmakokineettisen analyysin tulokset osoittivat, että rosiglitatsonin keskimääräinen puhdistuma suun kautta naispotilaat (n = 405) olivat noin 6% pienemmät kuin saman painoisilla miespotilailla (n = 642).
Monoterapiana ja yhdessä metformiinin kanssa AVANDIA paransi verensokerin hallintaa sekä miehillä että naisilla. Metformiiniyhdistelmätutkimuksissa tehokkuus osoitettiin ilman sukupuolieroja glykeemisessä vasteessa.
Monoterapiatutkimuksissa suurempi terapeuttinen vaste havaittiin naisilla; liikalihavammilla potilailla sukupuolierot olivat kuitenkin vähemmän ilmeisiä. Tietyllä kehon massaindeksillä (BMI) naisilla on yleensä suurempi rasvamassa kuin miehillä. Koska molekyylikohde PPARÎ3 ekspressoituu rasvakudoksissa, tämä erottava ominaisuus voi ainakin osittain johtaa suurempaan vasteeseen AVANDIA: lle naisilla. Koska hoito tulisi räätälöidä, annosta ei tarvitse muuttaa pelkän sukupuolen perusteella.
Maksan vajaatoiminta
Sitoutumaton rosiglitatsonin puhdistuma oli merkitsevästi alhaisempi potilailla, joilla oli kohtalainen tai vaikea maksasairaus (Child-Pugh-luokka B / C) kuin terveillä koehenkilöillä. Seurauksena sitoutumaton Cmax ja AUC0-inf nousivat vastaavasti 2 ja 3 kertaa. Rosiglitatsonin eliminaation puoliintumisaika oli noin 2 tuntia pidempi potilailla, joilla oli maksasairaus, verrattuna terveisiin koehenkilöihin.
AVANDIA-hoitoa ei tule aloittaa, jos potilaalla on kliinisiä todisteita aktiivisuudesta maksasairaus tai lisääntyneet seerumin transaminaasitasot (ALAT> 2,5 x normaalin yläraja) lähtötasolla [katso VAROITUKSET JA VAROTOIMET].
pediatrinen
Rosiglitatsonin farmakokinetiikkaparametrit lapsipotilailla määritettiin käyttämällä populaatiofarmakokineettistä analyysiä, jonka tiedot olivat vähäisiä 96: lta. lapsipotilaat yhdessä lastenlääketieteellisessä tutkimuksessa, mukaan lukien 33 miestä ja 63 naista, ikä välillä 10 - 17 vuotta (paino vaihtelee 35 - 35 178,3 kg). Rosiglitatsonin populaation keskimääräinen CL / F ja V / F oli vastaavasti 3,15 l / h ja 13,5 L. Nämä arviot CL / F: stä ja V / F: stä olivat yhdenmukaisia aiempien aikuisten väestöanalyysin tyypillisten parametriarvioiden kanssa.
Munuaisten vajaatoiminta
Rosiglitatsonin farmakokinetiikassa ei ole kliinisesti merkittäviä eroja potilailla, joilla on lievä vaikeaan munuaisten vajaatoimintaan tai hemodialyysiriippuvaisiin potilaisiin verrattuna potilaisiin, joilla munuaisten toiminta on normaalia toimia. Annosta ei siis tarvitse muuttaa sellaisilla potilailla, jotka saavat AVANDIAa. Koska metformiini on vasta-aiheinen munuaisten vajaatoiminnasta kärsiville potilaille, metformiinin ja AVANDIAn samanaikainen käyttö on vasta-aiheista näille potilaille.
Rotu
Kaukasialaisista, mustista ja muista etnistä alkuperää olevista populaatiofarmakokineettisen analyysin tulokset osoittavat, että rodulla ei ole vaikutusta rosiglitatsonin farmakokinetiikkaan.
Huumeiden ja lääkkeiden yhteisvaikutukset
Lääkkeet, jotka estävät, indusoivat tai metaboloidaan sytokromi P450: llä
In vitro lääkeaineenvaihduntatutkimukset viittaavat siihen, että rosiglitatsoni ei estä yhtäkään tärkeimmistä P450-entsyymeistä kliinisesti merkityksellisissä pitoisuuksissa. In vitro -tiedot osoittavat, että rosiglitatsoni metaboloituu pääasiassa CYP2C8: n ja vähäisemmässä määrin 2C9: n kautta. AVANDIA: lla (4 mg kahdesti päivässä) ei osoitettu olevan kliinisesti merkitsevää vaikutusta nifedipiini ja oraaliset ehkäisyvalmisteet (etinyyliestradioli ja noretindroni), jotka metaboloituvat pääasiassa kirjoittanut CYP3A4.
gemfibrotsiili
CYP2C8: n estäjän gemfibrosiilin (600 mg kahdesti päivässä) ja rosiglitatsonin (4 mg kerran) samanaikainen anto päivittäin) seitsemän päivän ajan rosiglitatsonin AUC kasvoi 127% verrattuna rosiglitatsonin (4 mg kerran päivässä) antamiseen yksin. Koska rosiglitatsonilla voi olla annokseen liittyviä haittavaikutuksia, rosemlitatsonin annosta voidaan joutua pienentämään, kun gemfibrosiili otetaan käyttöön [ks. Huumausaineiden vuorovaikutukset].
rifampiinille
Rifampiinin antamisen (600 mg kerran päivässä), joka on CYP2C8: n indusoija, 6 päivän ajan on ilmoitettu vähentävän rosiglitatsonin AUC: ta 66% verrattuna pelkästään rosiglitatsonin (8 mg) antoon [ks. Huumausaineiden vuorovaikutukset].4
glyburide
AVANDIA (2 mg kahdesti päivässä), jota otettiin samanaikaisesti glyburidin (3,75 - 10 mg / päivä) kanssa 7 päivän ajan, ei muuttunut keskimääräiset vakaan tilan 24 tunnin plasman glukoosipitoisuudet diabeetikoilla vakautuivat glyburidilla terapiaa. Toistetut AVANDIA-annokset (8 mg kerran päivässä) 8 päivän ajan terveillä aikuisilla valkoihoisilla koehenkilöillä aiheuttivat glyburidin AUC: n ja Cmax-arvon laskun noin 30%. Japanilaisilla koehenkilöillä glyburidin AUC ja Cmax nousivat hieman AVANDIAn samanaikaisen käytön jälkeen.
glimepiridi
Glimepiridin kerta-annoksilla 14 terveellä aikuisilla koehenkilöillä ei ollut kliinisesti merkitsevää vaikutusta vakaan tilan farmakokinetiikkaan AVANDIAssa. Ei kliinisesti merkittävää glimepiridin AUC: n ja C: n laskuamax havaittiin toistuvien AVANDIA-annosten (8 mg kerran päivässä) jälkeen 8 päivän ajan terveillä aikuisilla koehenkilöillä.
metformiini
AVANDIA: n (2 mg kahdesti päivässä) ja metformiinin (500 mg kahdesti päivässä) samanaikainen anto terveenä 4 vuorokauden vapaaehtoisilla ei ollut vaikutusta metformiinin tai metformiinin vakaan tilan farmakokinetiikkaan rosiglitatsoni.
Acarbose
Akarboosin (100 mg kolme kertaa päivässä) samanaikaisella käytöllä 7 päivän ajan terveillä vapaaehtoisilla ei ollut kliinisesti merkitsevää vaikutusta AVANDIA-kerta-annoksen yhden kerta-annoksen farmakokinetiikkaan.
Digoksiini
AVANDIA: n (8 mg kerran päivässä) toistaminen suun kautta 14 vuorokauden ajan ei muuttanut digoksiinin (0,375 mg kerran päivässä) vakaan tilan farmakokinetiikkaa terveillä vapaaehtoisilla.
varfariini
AVANDIA-valmisteen toistamisella ei ollut kliinisesti merkitsevää vaikutusta varfariini-enantiomeerien vakaan tilan farmakokinetiikkaan.
etanoli
Kerta-annoksen maltillinen määrä alkoholia ei lisännyt akuutin hypoglykemian riskiä tyypin 2 diabetes mellituspotilailla, joita hoidettiin AVANDIA: lla.
ranitidiini
Esikäsittely ranitidiinilla (150 mg kahdesti päivässä 4 päivän ajan) ei muuttanut terveiden vapaaehtoisten rosiglitatsonin yksittäisten suun kautta annettavien tai laskimonsisäisten annosten farmakokinetiikkaa.
Nämä tulokset viittaavat siihen, että suun kautta annettavan rosiglitatsonin imeytyminen ei muutu olosuhteissa, joihin liittyy ruoansulatuskanavan pH-arvon nousu.
ylin
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Carcinogenesis:
Kahden vuoden karsinogeenisuustutkimus tehtiin Charles River CD-1 -hiirillä annoksilla 0,4, 1,5 ja 6 mg / kg / päivä ruokavalio (suurin annos, joka vastaa noin 12-kertaista ihmisen AUC: tä enimmäissuosituksella ihmiselle päivittäin annos). Sprague-Dawley-rotille annettiin 2 vuoden ajan suun kautta annettava annos 0,05, 0,3 ja 2 mg / kg / päivä (suurin annosekvivalentti) noin 10 ja 20-kertaiseen ihmisen AUC-arvoon ihmisen uros- ja naarasrottien enimmäissuosituksella, vastaavasti).
Rosiglitatsoni ei ollut karsinogeeninen hiirissä. Hiiren rasvaisen hyperplasian esiintyvyys lisääntyi annoksilla 1,5 mg / kg / päivä (noin 2-kertainen ihmisen AUC-annoksella ihmisen suurimmalla suositellulla vuorokausiannoksella). Rottien hyvänlaatuisten rasvakudoskasvaimien (lipoomien) esiintyvyys lisääntyi merkittävästi annoksilla 0,3 mg / kg / vrk (noin 2-kertainen ihmisen AUC-arvolla ihmisen suurimmalla suositusannolla). Näitä proliferatiivisia muutoksia molemmissa lajeissa pidetään rasvakudoksen jatkuvan farmakologisen yliastimulaation vuoksi.
mutageneesi:
Rosiglitatsoni ei ollut mutageeninen tai klastogeeninen in vitro bakteerimäärityksissä geenimutaation, in vitro kromosomipoikkeavuustesti ihmisen lymfosyyteissä, hiiren in vivo mikrotumatesti ja in vivo / in vitro rottien UDS määritys. Hiiren lymfoomamäärityksessä in vitro tapahtui pieni (noin 2-kertainen) mutaation lisäys metabolisen aktivaation läsnä ollessa.
Hedelmällisyyden heikkeneminen:
Rosiglitatsonilla ei ollut vaikutusta urosrottien paritukseen tai hedelmällisyyteen, kun annos oli korkeintaan 40 mg / kg / päivä (noin 116-kertainen ihmisen AUC-arvon kanssa ihmisen suurimmassa suositusannossa). Rosiglitatsoni muutti naarasrotien estroosista syklisyyttä (2 mg / kg / vrk) ja heikentää hedelmällisyyttä (40 mg / kg / vrk) yhdessä alempien rottien kanssa progesteronin ja estradiolin pitoisuudet plasmassa (noin 20 ja 200-kertainen ihmisen AUC-arvon kanssa ihmisen suurimmassa suositusannossa, vastaavasti). Tällaisia vaikutuksia ei havaittu annoksella 0,2 mg / kg / päivä (noin 3-kertainen ihmisen AUC-arvolla ihmisen suurimmalla suositusannolla). Nuorilla rotilla, joille annettiin 27 päivän ikästä sukupuolikypsyyteen asti (jopa 40 mg / kg / päivä), ei ollut vaikutusta urosten lisääntymiskykyyn tai naisilla esiintyvän kiertosyklisyyden, pariutumissuorituskyvyn tai raskauden esiintyvyyden suhteen (noin 68-kertainen ihmisen AUC-arvo enimmäissuosituksella ihmiselle päivittäin annos). Apinoissa rosiglitatsoni (0,6 ja 4,6 mg / kg / päivä; noin 3 ja 15-kertainen ihmisen AUC ihmisen suurimmalla suositellulla vuorokausiannoksella), vähentää follikulaarivaiheen nousua seerumin estradiolissa, jolloin seurauksena on luteinisoivan hormonin alentumisen väheneminen, matalampi luteaalifaasin progesteronitaso ja kuukautisia. Näiden vaikutusten mekanismi näyttää olevan munasarjojen steroidogeneesin suora estyminen.
Eläinten toksikologia
Sydänpainot kasvoivat hiirillä (3 mg / kg / päivä), rotilla (5 mg / kg / päivä) ja koirilla (2 mg / kg / päivä) rosiglitatsonilla. hoidot (vastaavasti noin 5, 22 ja 2-kertainen ihmisen AUC-annoksella ihmisen suurimmalla suositusannolla). Nuorilla rotilla tehdyt vaikutukset olivat yhdenmukaisia aikuisten kanssa havaittujen kanssa. Morfometrinen mittaus osoitti, että sydämen kammiokudoksissa esiintyi hypertrofiaa, mikä voi johtua lisääntyneestä sydämen työstä plasman tilavuuden laajenemisen seurauksena.
ylin
Kliiniset tutkimukset
monoterapia
Kliinisissä tutkimuksissa AVANDIA-hoito johti parantamaan glykeemistä kontrollia FPG: n ja HbA1c: n avulla mitattuna samalla, kun väheni insuliinia ja C-peptidiä. Postprandiaalinen glukoosi ja insuliini vähenivät myös. Tämä on johdonmukaista AVANDIA: n vaikutusmekanismin kanssa insuliiniherkistimenä.
Suurin suositeltu vuorokausiannos on 8 mg. Annoskohtaiset tutkimukset osoittivat, että ylimääräistä hyötyä ei saatu 12 mg: n päivittäisannostuksella.
Lyhytaikaiset kliiniset tutkimukset: AVANDIA: lla hoidettiin AVANDIA: lla monoterapiana kuudessa kaksoissokkotutkimuksessa, 2 235 tyypin 2 diabeetikkoa, joille aiemmin annettiin pelkästään ruokavaliota tai antidiabeettisia lääkkeitä. tutkimukset, jotka sisälsivät kaksi 26 viikon lumelääkekontrolloitua tutkimusta, yhden 52 viikon glyburidikontrolloidun tutkimuksen ja 3 lumelääkekontrolloitua annossuuntaista tutkimusta, joiden kesto oli 8–12 viikkoa. Aikaisemmat antidiabeettiset lääkkeet lopetettiin ja potilaat aloittivat 2 - 4 viikon plasebo-aloitusjakson ennen satunnaistamista.
Kaksi 26 viikon kaksoissokkotutkimusta, plasebokontrolloitua tutkimusta tyypin 2 diabeteksen (n = 1 401) potilailla, joilla oli riittämätön glykeeminen kontrolli (keskimääräinen lähtötason FPG noin 228 mg / dl [101 - 425 mg / dL] ja keskimääräinen lähtötaso HbA1c 8,9% [5,2% - 16,2%]) olivat suoritettu. AVANDIA-hoito tuotti tilastollisesti merkittäviä parannuksia FPG: ssä ja HbA1c: ssä verrattuna lähtötilanteeseen ja suhteessa plaseboon. Yhden näistä tutkimuksista saadut tiedot on koottu taulukkoon 9.
Taulukko 9: glykeemiset parametrit 26 viikon lumekontrolloidussa tutkimuksessa
| Plasebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg kerran päivässä N = 180 |
2 mg kahdesti päivässä N = 186 |
8 mg kerran päivässä N = 181 |
4 mg kahdesti päivässä N = 187 |
||
| FPG (mg / dL) | |||||
| Perustaso (keskiarvo) | 225 | 229 | 225 | 228 | 228 |
| Muutos lähtötasoon nähden (keskiarvo) | 8 | -25 | -35 | -42 | -55 |
| Ero lumelääkkeeseen (oikaistu keskiarvo) | - | -31* | -43* | -49* | -62* |
| % potilaista, joilla â with ¥ 30 mg / dL, lasku lähtötasosta | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Perustaso (keskiarvo) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Muutos lähtötasoon nähden (keskiarvo) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Ero lumelääkkeeseen (oikaistu keskiarvo) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % potilaista, joilla <0,7% laskua lähtötasosta | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 verrattuna lumelääkkeeseen. |
Kun AVANDIA annettiin samalla päivittäisellä kokonaisannoksella, se oli yleensä tehokkaampi vähentämään FPG: tä ja HbA1c: tä, kun sitä annettiin jaettuina annoksina kahdesti päivässä verrattuna kerran päiväannoksiin. HbA1c: n tapauksessa ero 4 mg: n kerran päivässä ja 2 mg: n kahdesti päivässä -annoksen välillä ei kuitenkaan ollut tilastollisesti merkitsevä.
Pitkäaikaiset kliiniset tutkimukset
Vaikutuksen pitkäaikaista ylläpitämistä arvioitiin 52 viikon kaksoissokkoutetussa glyburidikontrolloidussa tutkimuksessa tyypin 2 diabeetikoilla. Potilaat satunnaistettiin 52 viikon ajan hoitoon AVANDIA 2 mg kahdesti päivässä (N = 195) tai AVANDIA 4 mg kahdesti päivässä (N = 189) tai glyburidilla (N = 202). Glyburidia saaneille potilaille annettiin aloitusannos joko 2,5 mg / päivä tai 5,0 mg / päivä. Annos titrattiin sitten 2,5 mg / päivä välein seuraavien 12 viikon aikana maksimiannokseen 15,0 mg / päivä glykeemisen kontrollin optimoimiseksi. Sen jälkeen glyburidiannos pidettiin vakiona.
Glyburidin titrattu mediaaniannos oli 7,5 mg. Kaikki hoidot johtivat tilastollisesti merkitsevään paranemiseen glykeemisessä kontrollissa lähtötasosta (kuvio 4 ja kuvio 5). Viikon 52 lopussa FPG: n ja HbA1c: n lasku lähtötasosta oli -40,8 mg / dl ja -0,53% AVANDIA 4 mg: n kanssa kahdesti päivässä; -25,4 mg / dL ja -0,27% AVANDIA 2 mg: n kanssa kahdesti päivässä; ja -30,0 mg / dL ja -0,72% glyburidilla. HbA1c: n tapauksessa AVANDIA 4 mg: n kahdesti vuorokaudessa ja glyburidin välinen ero ei ollut tilastollisesti merkitsevä viikolla 52. Alkuperäinen FPG: n lasku glyburidilla oli suurempi kuin AVANDIA: lla; tämä vaikutus ei kuitenkaan ollut yhtä kestävä ajan myötä.
Glykeemisen kontrollin paraneminen AVANDIA 4 mg: lla kahdesti päivässä viikolla 26 pidettiin tutkimuksen viikolla 52.
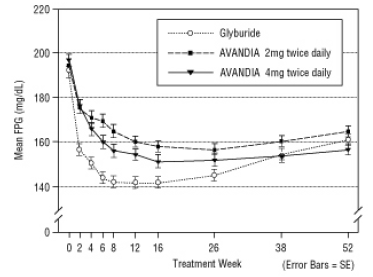
Kuvio 4. Keskimääräinen FPG ajan myötä 52 viikon Glyburide-kontrolloidussa tutkimuksessa
Kuvio 5. Keskimääräinen HbA1c ajan myötä 52 viikon glyburidiohjatussa tutkimuksessa
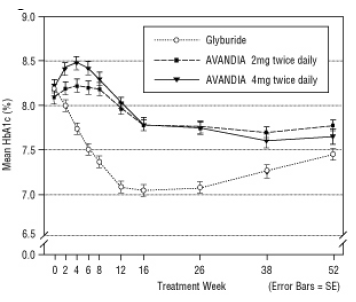
Hypoglykemiaa ilmoitettiin 12,1%: lla glyburidilla hoidetuista potilaista verrattuna 0,5% (2 mg kahdesti päivässä) ja 1,6% (4 mg kahdesti päivässä) AVANDIA-hoitoa saaneista potilaista. Parannukset glykeemisessä kontrollissa liittyivät keskimääräiseen painonlisäykseen 1,75 kg ja 2,95 kg Potilaat, joita hoidettiin vastaavasti 2 mg: lla ja 4 mg: lla AVANDIAa vuorokaudessa, verrattuna 1,9 kg: lla glyburidilla hoidettuja potilaita. AVANDIA: lla hoidetuilla potilailla C-peptidi, insuliini, proinsuliini ja proinsuliinin pilkkoutuneet tuotteet olivat vähentynyt merkittävästi annosjärjestyksessä, verrattuna glyburidilla käsitellyn määrän kasvuun potilaita.
Diabetes Outcome Progression Trial (ADOPT) oli monikeskus, kaksoissokkoutettu, kontrolloitu tutkimus (N = 4 351), joka tehtiin 4–6 vuoden aikana turvallisuuden ja tehon vertaamiseksi. AVANDIA-, metformiini- ja glyburidimonoterapiasta potilailla, joilla on äskettäin diagnosoitu tyypin 2 diabetes mellitus (â ¤ 3 vuotta), joiden ruokavalio on riittämätön ja Harjoittele. Potilaiden keskimääräinen ikä tässä tutkimuksessa oli 57 vuotta ja suurimmalla osalla potilaista (83%) ei ollut aiemmin tunnettuja sydän- ja verisuonitauteja. Keskimääräinen lähtötason FPG ja HbA1c olivat vastaavasti 152 mg / dl ja 7,4%. Potilaat satunnaistettiin saamaan joko AVANDIA 4 mg kerran päivässä, glyburidi 2,5 mg kerran päivässä tai metformiini 500 mg kerran päivässä, ja annokset olivat titrattu optimaaliseen glykeemiseen kontrolliin korkeintaan 4 mg kahdesti päivässä AVANDIA: lla, 7,5 mg kahdesti päivässä glyburidilla ja 1 000 mg kahdesti päivässä metformiini. Ensisijainen tehokkuustulos oli aika peräkkäiseen FPG-arvoon> 180 mg / dL vähintään 6 viikon hoidon jälkeen tutkitun lääkityksen siedetty annos tai aika riittämättömään glykeemiseen hallintaan riippumattoman päätöksen perusteella komitea.
Ensisijaisen tehokkuustuloksen kumulatiivinen esiintyvyys 5 vuoden kohdalla oli 15% AVANDIA: lla, 21% metformiinin kanssa ja 34% glyburidilla (riskisuhde 0,68 [95% CI 0,55, 0,85] verrattuna metformiiniin, HR 0,37 [95% CI 0,30, 0,45] verrattuna glyburidiin).
Sydän- ja verisuonitautien ja haittavaikutusten tiedot (mukaan lukien vaikutukset ruumiinpainoon ja luunmurtumiseen) ADOPT-valmisteesta AVANDIAlle, metformiinille ja glyburidille on kuvattu VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSETvastaavasti. Kuten kaikkien lääkkeiden tapauksessa, tehokkuustuloksia on tarkasteltava yhdessä turvallisuustietojen kanssa yksittäisen potilaan mahdollisen hyödyn ja riskien arvioimiseksi.
Yhdistelmä metformiinin tai sulfonyyliurean kanssa
AVANDIA: n lisääminen joko metformiiniin tai sulfonyyliureisiin johti merkittäviin vähenemisiin hyperglykemiassa kumpaankin näistä aineista yksinään. Nämä tulokset ovat yhdenmukaisia additiivisen vaikutuksen kanssa glykeemisen kontrollin kanssa, kun AVANDIAa käytetään yhdistelmähoitona.
Yhdistelmä metformiinin kanssa
Yhteensä 670 tyypin 2 diabetestä sairastavaa potilasta osallistui kahteen 26 viikon satunnaistettuun, kaksoissokkoutettuun, lumelääke / aktiivisesti kontrolloidut tutkimukset, joiden tarkoituksena on arvioida AVANDIAn tehokkuutta yhdessä metformiini. AVANDIA, annettuna joko kerran päivässä tai kahdesti päivässä, annettiin hoitoon potilailla, joiden metformiinin enimmäisannos (2,5 grammaa / päivä) oli riittämättömästi hallinnassa.
Yhdessä tutkimuksessa potilaat kontrolloivat riittämättömästi 2,5 grammaa / päivä metformiinia (keskimääräinen lähtötaso FPG 216 mg / dL ja keskimääräinen lähtötaso) HbA1c 8,8%) satunnaistettiin saamaan 4 mg AVANDIAa kerran päivässä, 8 mg AVANDIAa kerran päivässä tai plaseboa metformiini. FPG: n ja HbA1c: n tilastollisesti merkitsevä paraneminen havaittiin potilailla, joita hoidettiin seuraavien kanssa: metformiinia ja 4 mg AVANDIAa kerran päivässä ja 8 mg AVANDIAa kerran päivässä, kun taas potilaat jatkoivat pelkkää metformiinia (Taulukko 10).
Taulukko 10. Glykeemiset parametrit AVANDIA Plus Metforminin 26 viikon yhdistelmätutkimuksessa
| metformiini N = 113 |
AVANDIA 4 mg kerran päivässä + metformiini N = 116 |
AVANDIA 8 mg kerran päivässä + metformiini N = 110 |
|
| FPG (mg / dL) | |||
| Perustaso (keskiarvo) | 214 | 215 | 220 |
| Muutos lähtötasoon nähden (keskiarvo) | 6 | -33 | -48 |
| Ero yksin metformiinista (oikaistu keskiarvo) | - | -40* | -53* |
| % potilaista, joilla â with ¥ 30 mg / dL, lasku lähtötasosta | 20% | 45% | 61% |
| HbA1c (%) | |||
| Perustaso (keskiarvo) | 8.6 | 8.9 | 8.9 |
| Muutos lähtötasoon nähden (keskiarvo) | 0.5 | -0.6 | -0.8 |
| Ero yksin metformiinista (oikaistu keskiarvo) | - | -1.0* | -1.2* |
| % potilaista, joilla <0,7% laskua lähtötasosta | 11% | 45% | 52% |
| * p <0,0001 verrattuna metformiiniin. |
Toisessa 26 viikon tutkimuksessa tyypin 2 diabetesta sairastavilla potilailla, joiden metformiinin määrä oli riittämätön 2,5 grammalla / päivä, jotka satunnaistettiin saamaan AVANDIA 4 mg kahdesti vuorokaudessa ja metformiini (N = 105) osoitti tilastollisesti merkitsevää paranemista glykeemisessä kontrollissa FPG: n keskimääräisen hoitotehosteen ollessa -56 mg / dl ja HbA1c: n keskimääräisen hoitotehosteen -0,8% pelkästään metformiinia. Metformiinin ja AVANDIA: n yhdistelmä johti alhaisempiin FPG- ja HbA1c-arvoihin kuin kumpikin aine yksinään.
Potilaat, joiden metformiinin enimmäisannos (2,5 grammaa / päivä) oli riittämättömästi hallinnassa ja jotka olivat siirtynyt monoterapiaan AVANDIA: lla osoitti glykeemisen kontrollin menetyksen, josta ilmenee FPG: n nousu ja HbA1c. Tässä ryhmässä havaittiin myös LDL: n ja VLDL: n nousuja.
Yhdistelmä sulfonyyliurean kanssa
Kaikkiaan 3.457 tyypin 2 diabetestä sairastavaa potilasta osallistui kymmeneen 24–26 viikon satunnaistettuihin, kaksoissokkoutettuihin, plasebo / aktiivisesti kontrolloituihin tutkimuksiin ja yhteen. 2-vuoden kaksoissokkotettu, aktiivisesti kontrolloitu tutkimus vanhuksilla, joiden tarkoituksena oli arvioida AVANDIA-valmisteen tehoa ja turvallisuutta yhdessä sulfonyyliurea. AVANDIA 2 mg, 4 mg tai 8 mg päivittäin annettiin joko kerran päivässä (3 tutkimusta) tai jaettuina annoksina kahdesti päivässä (7 tutkimusta) potilaille, joiden hoitotasapaino on riittämätön submaksimaalisen tai maksimaalisen annoksen kanssa sulfonyyliurea.
Näissä tutkimuksissa yhdistelmä AVANDIA 4 mg tai 8 mg päivässä (annettuna yhtenä tai kahdesti päivässä jaettuna annoksena) ja a sulfonyyliurea vähensi merkittävästi FPG: tä ja HbA1c: tä verrattuna lumelääkkeeseen plus sulfonyyliureaan tai edelleen sulfonyyliurea. Taulukko 11 näyttää kootut tiedot kahdeksasta tutkimuksesta, joissa AVANDIA: ta lisättiin sulfonyyliureaan verrattiin plaseboon ja sulfonyyliureisiin.
Taulukko 11. Glykeemiset parametrit AVANDIA Plus -sulfonyyliurean 24 - 26 viikon yhdistelmätutkimuksissa
| Kahdesti päivässä jaettu annostelu (5 tutkimusta) | sulfonyyliurea N = 397 |
AVANDIA 2 mg kahdesti päivässä + sulfonyyliurea N = 497 |
sulfonyyliurea N = 248 |
AVANDIA 4 mg kahdesti päivässä + sulfonyyliurea N = 346 |
| FPG (mg / dL) | ||||
| Perustaso (keskiarvo) | 204 | 198 | 188 | 187 |
| Muutos lähtötasoon nähden (keskiarvo) | 11 | -29 | 8 | -43 |
| Ero pelkästään sulfonyyliureasta (oikaistu keskiarvo) | - | -42* | - | -53* |
| % potilaista, joilla â with ¥ 30 mg / dL, lasku lähtötasosta | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Perustaso (keskiarvo) | 9.4 | 9.5 | 9.3 | 9.6 |
| Muutos lähtötasoon nähden (keskiarvo) | 0.2 | -1.0 | 0.0 | -1.6 |
| Ero pelkästään sulfonyyliureasta (oikaistu keskiarvo) | - | -1.1* | - | -1.4* |
| % potilaista, joilla <0,7% laskua lähtötasosta | 21% | 60% | 23% | 75% |
| Kerran päivässä annostus (3 tutkimusta) | sulfonyyliurea N = 172 |
AVANDIA 4 mg kerran päivässä + sulfonyyliurea N = 172 |
sulfonyyliurea N = 173 |
AVANDIA 8 mg kerran päivässä + sulfonyyliureat N = 176 |
| FPG (mg / dL) | ||||
| Perustaso (keskiarvo) | 198 | 206 | 188 | 192 |
| Muutos lähtötasoon nähden (keskiarvo) | 17 | -25 | 17 | -43 |
| Ero pelkästään sulfonyyliureasta (oikaistu keskiarvo) | - | -47* | - | -66* |
| % potilaista, joilla â with ¥ 30 mg / dL, lasku lähtötasosta | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Perustaso (keskiarvo) | 8.6 | 8.8 | 8.9 | 8.9 |
| Muutos lähtötasoon nähden (keskiarvo) | 0.4 | -0.5 | 0.1 | -1.2 |
| Ero pelkästään sulfonyyliureasta (oikaistu keskiarvo) | - | -0.9* | - | -1.4* |
| % potilaista, joilla <0,7% laskua lähtötasosta | 11% | 36% | 20% | 68% |
| * p <0,0001 verrattuna pelkästään sulfonyyliureisiin. |
Yksi 24–26 viikon tutkimuksista sisälsi potilaita, joiden hoitotasapaino oli riittämätön suurimmissa glyburidiannoksissa ja jotka vaihdettiin 4 mg: aan AVANDIAa päivittäin monoterapiana; tässä ryhmässä osoitettiin glykeemisen kontrollin menetystä, mikä käy ilmi FPG: n ja HbA1c: n lisäyksistä.
2-vuoden kaksoissokkotutkimuksessa iäkkäät potilaat (59–89-vuotiaat), jotka saivat puolimaksimaalista sulfonyyliureaa (glipitsidi 10 mg kahdesti päivässä), satunnaistettiin lisätään AVANDIA (n = 115, 4 mg kerran päivässä 8 mg: aan tarvittaessa) tai jatketaan glipitsidin titrausta (n = 110) enintään 20 mg: aan kahdesti päivittäin. Keskimääräinen lähtötason FPG ja HbA1c olivat vastaavasti 157 mg / dl ja 7,72% AVANDIA plus glipitsidihaaralla ja 159 mg / dL ja 7,65% vastaavasti glipitsidiä ylititraavalle ryhmälle. Verensokeritasapainon menetys (FPG â ‰ ¥ 180 mg / dl) tapahtui huomattavasti pienemmässä osassa AVANDIAa ja glipitsidiä saaneista potilaista (2%) kuin glipitsidiä ylititraavat potilaat (28,7%). Noin 78% yhdistelmähoitoa saaneista potilaista sai 2 vuoden hoidon loppuun ja vain 51% glipitsidi-monoterapian. Yhdistelmähoidon vaikutus FPG: hen ja HbA1c: hen oli kestävä 2 vuoden tutkimusjakson aikana potilailla saavutetaan keskiarvo 132 mg / dL FPG: lle ja keskiarvo 6,98% HbA1c: lle verrattuna muutoksiin glipitsidissä käsivarsi.
Yhdistelmä sulfonyyliurean ja metformiinin kanssa
Kahdessa 24–26 viikkoisessa, kaksoissokkotetussa, lumekontrolloidussa tutkimuksessa, jonka tarkoituksena oli arvioida AVANDIAn tehokkuutta ja turvallisuutta yhdessä sulfonyyliurean ja metformiinin kanssa, AVANDIA 4 mg tai 8 mg päivittäin, annettiin jaettuina annoksina kahdesti päivässä, potilaille, joiden hoitotasapaino oli riittämätön submaksimaalisten (10 mg) ja maksimiannoksen (20 mg) glyburidin ja maksimaalisen annoksen metformiinin (2) kanssa. g / vrk). FPG: n ja HbA1c: n tilastollisesti merkitsevä paraneminen havaittiin potilailla, joita hoidettiin sulfonyyliurean yhdistelmillä plus metformiinia ja 4 mg AVANDIA: ta ja 8 mg AVANDIA: ta potilailla verrattuna jatkoi sulfonyyliurean ja metformiinin käyttöä, kuten taulukossa esitetään. 12.
Taulukko 12. Glykeemiset parametrit AVANDIA Plus -sulfonyyliurean ja metformiinin 26 viikon yhdistelmätutkimuksessa
| Sulfonyyliurea + metformiini N = 273 |
AVANDIA 2 mg kahdesti päivittäin + sulfonyyliurea + metformiini N = 276 |
AVANDIA 4 mg kahdesti päivässä + sulfonyyliurea + metformiini N = 277 |
|
| FPG (mg / dL) | |||
| Perustaso (keskiarvo) | 189 | 190 | 192 |
| Muutos lähtötasoon nähden (keskiarvo) | 14 | -19 | -40 |
| Ero sulfonyyliureasta ja metformiinista (oikaistu keskiarvo) | - | -30* | -52* |
| % potilaista, joilla â with ¥ 30 mg / dL, lasku lähtötasosta | 16% | 46% | 62% |
| HbA1c (%) | |||
| Perustaso (keskiarvo) | 8.7 | 8.6 | 8.7 |
| Muutos lähtötasoon nähden (keskiarvo) | 0.2 | -0.4 | -0.9 |
| Ero sulfonyyliureasta ja metformiinista (oikaistu keskiarvo) | - | -0.6* | -1.1* |
| % potilaista, joilla <0,7% laskua lähtötasosta | 16% | 39% | 63% |
| * p <0,0001 verrattuna lumelääkkeeseen. |
ylin
Viitteet
- Ruoka- ja lääkehallintoa käsittelevä tiedotusasiakirja. Endokriiniaineenvaihdunta- ja lääketurvallisuutta sekä riskienhallintaa käsittelevien neuvoa-antavien komiteoiden yhteinen kokous. Ju 2007.
- DREAM-tutkimuksen tutkijat. Rosiglitatsonin vaikutus diabeteksen esiintymistilaan heikentyneen glukoositoleranssin tai heikentyneen paastoglukoosin suhteen: satunnaistettu kontrolli Lansetti 2006;368:1096-1105.
- Home PD, Pocock SJ, Beck-Nielsen H, et ai. Rosiglitatsonista arvioitiin sydän- ja verisuonitulokset - välianalyysi. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH, et ai. Rifampiinin vaikutus rosiglitatsonin farmakokinetiikkaan terveillä koehenkilöillä. Clin Pharmacol Ther 2004; 75: 157-162.
ylin
Kuinka toimitetaan / varastointi ja käsittely
Jokainen viisikulmainen kalvopäällysteinen TILTAB-tabletti sisältää rosiglitatsonia maleaattina seuraavasti: 2 mg-vaaleanpunainen, merkinnällä SB toisella puolella ja 2 toisella; 4 mg oranssia, merkinnällä SB toisella puolella ja 4 toisella; 8 mg-puna-ruskea, merkinnällä SB toisella puolella ja 8 toisella.
- 2 mg: n pullot 60: NDC 0029-3158-18
- 4 mg pullot, joissa on 30: NDC 0029-3159-13
- 4 mg: n pullot, 90: NDC 0029-3159-00
- 8 mg pullot, joissa on 30: NDC 0029-3160-13
- 8 mg: n pullot, 90: NDC 0029-3160-59
Varastoi 25 ° C: ssa (77 ° F); retket 15 - 30 ° C (59 - 86 F). Annostele tiiviissä, valonkestävässä astiassa.
viimeksi päivitetty 02/2008
Avandia, rosiglitatsonimaleaatti, potilastiedot (selkeästi englanniksi)
Yksityiskohtaiset tiedot diabeteksen oireista, oireista, syistä ja hoidoista
Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötapoja, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysymyksiä käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta.
takaisin:Selaa kaikkia diabeteksen lääkkeitä



