Starlix diabeteksen hoitoon
Tuotemerkki: Starlix
Geneerinen nimi: nategliniditabletit
Sisällys:
Kuvaus
Kliininen farmakologia
Kliiniset tutkimukset
Käyttöaiheet ja käyttö
Vasta
varotoimet
Haitalliset reaktiot
yliannostus
Annostelu ja hallinnointi
Kuinka toimitetaan
Starlix, nateglinide, täydelliset potilastiedot (selkeästi englanniksi)
Kuvaus
Starlix® (nateglinidi) on suun kautta otettava diabeteslääke, jota käytetään tyypin 2 diabeteksen hoidossa [tunnetaan myös nimellä insuliinista riippumaton diabetes mellitus (NIDDM) tai aikuisten puhkeaminen diabetekseen]. Starlix, (-) - N - [(trans-4-isopropyylisykloheksaani) karbonyyli] -D-fenyylialaniini, on rakenteellisesti riippumaton suun kautta otettaviin sulfonyyliureaninsuliinin eritystä lisääviin aineisiin.
Rakennekaava on kuvan mukainen
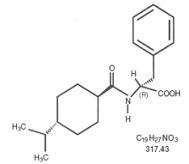
Nateglinidi on valkoinen jauhe, jonka molekyylipaino on 317,43. Se liukenee vapaasti metanoliin, etanoliin ja kloroformiin, liukenee eetteriin, liukenee niukasti asetonitriiliin ja oktanoliin ja käytännöllisesti liukenematta veteen. Starlix kaksoiskupera tabletti sisältää 60 mg tai 120 mg nateglinidiä suun kautta annettavaksi.
Inaktiiviset aineosat: kolloidinen piidioksidi, kroskarmelloosinatrium, hydroksipropyylimetyyliselluloosa, rautaoksidit (punainen tai keltainen), laktoosimonohydraatti, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, povidoni, talkki ja titaani dioksidi.
ylin
Kliininen farmakologia
Toimintamekanismi
Nateglinidi on aminohappojohdannainen, joka alentaa verensokeriarvoja stimuloimalla insuliinin eritystä haimasta. Tämä toiminta on riippuvainen haimasaarejen toimivista beeta-soluista. Nateglinidi on vuorovaikutuksessa haiman beeta-solujen ATP-herkän kalium (K + ATP) -kanavan kanssa. Seuraava beeta-solun depolarisaatio avaa kalsiumkanavan, tuottaen kalsiumin tuloa ja insuliinin eritystä. Insuliinin vapautumisen määrä on glukoosiriippuvainen ja vähenee alhaisilla glukoositasoilla. Nateglinidi on erittäin kudosselektiivinen ja sillä on alhainen affiniteetti sydämeen ja luurankoon.
farmakokinetiikkaa
imeytyminen
Oraalisen annon jälkeen välittömästi ennen ateriaa nateglinidi imeytyy nopeasti keskimääräisillä huumeiden huippupitoisuuksilla plasmassa (Cmax), joka tapahtuu yleensä tunnin sisällä (Tmax) annoksen antamisen jälkeen. Kun sitä annetaan tyypin 2 diabeteksen potilaille annosalueella 60 mg - 240 mg kolme kertaa päivässä yhdelle viikolla, nateglinidi osoitti lineaarista farmakokinetiikkaa sekä AUC: lle (aika / plasmapitoisuuskäyrän alapuolella oleva alue) että Cmax. Tmax: n todettiin myös olevan riippumaton annoksesta tässä potilaspopulaatiossa. Absoluuttisen hyötyosuuden arvioidaan olevan noin 73%. Annettuna aterian yhteydessä tai aterian jälkeen nateglinidin imeytymisaste (AUC) ei muutu. Imeytymisnopeudessa on kuitenkin viive, jolle on tunnusomaista Cmax-arvon lasku ja ajan viivästyminen huippupitoisuuden plasmaan saavuttamiseen (Tmax). Plasmaprofiileille on ominaista useita plasmakonsentraatiohuippuja, kun nateglinidiä annetaan paasto-olosuhteissa. Tämä vaikutus heikkenee, kun nateglinidi otetaan ennen ateriaa.
Jakelu
Nateglinidin laskimonsisäisen (IV) antamisen jälkeen saatujen tietojen perusteella nateglinidin vakaan tilan jakautumistilavuuden arvioidaan olevan noin 10 litraa terveillä koehenkilöillä. Nateglinidi sitoutuu laajasti (98%) seerumin proteiineihin, pääasiassa seerumin albumiiniin, ja vähäisemmässä määrin Î ± 1 happo glykoproteiiniin. Seerumin proteiiniin sitoutumisen laajuus on riippumaton lääkeainepitoisuudesta testialueella 0,1-10 ug / ml.
aineenvaihdunta
Nateglinidi metaboloituu sekafunktionaalisella oksidaasijärjestelmällä ennen eliminaatiota. Metabolian pääreitit ovat hydroksylaatio, jota seuraa glukuronidikonjugaatio. Tärkeimmät metaboliitit ovat vähemmän tehokkaita antidiabeettisia aineita kuin nateglinidi. Isopreeni-vähämetaboliitilla on samanlainen teho kuin kantayhdisteellä nateglinidillä.
In vitro -tiedot osoittavat, että nateglinidi metaboloituu pääasiassa sytokromi P450 -entsyymien CYP2C9 (70%) ja CYP3A4 (30%) kanssa.
eritys
Nateglinidi ja sen metaboliitit eliminoituvat nopeasti ja kokonaan suun kautta antamisen jälkeen. Noin 75% annetusta 14C-nateglinidistä todettiin virtsaan 6 tunnin kuluessa annosta. 85 prosenttia 14C-nateglinidistä erittyi virtsaan ja ylimääräinen 10% erittyi ulosteeseen. Noin 16% 14C-nateglinidistä erittyi virtsaan lähtöyhdisteenä. Kaikissa terveillä vapaaehtoisilla ja tyypin 2 diabetespotilailla tehdyissä tutkimuksissa nateglinidipitoisuudet plasmassa pienenivät nopeasti keskimääräisen eliminaation puoliintumisajan ollessa noin 1,5 tuntia. Tämän lyhyen eliminaation puoliintumisajan mukaisesti nateglinidi ei kertynyt toistuvasti annettaessa enintään 240 mg kolme kertaa päivässä 7 päivän ajan.
Lääkkeiden yhteisvaikutukset
In vitro lääkeaineenvaihduntatutkimukset osoittavat, että Starlix metaboloituu pääasiassa sytokromi P450 -isotsyymin CYP2C9 (70%) ja vähemmässä määrin CYP3A4 (30%) kautta. Starlix on mahdollinen CYP2C9-isoentsyymin estäjä in vivo, kuten osoittaa sen kyky estää tolbutamidin in vitro -metaboliaa. CYP3A4-metabolisten reaktioiden estämistä ei havaittu in vitro -kokeissa.
Glyburidi: Satunnaistetussa, moniannoksisessa ristiintutkimuksessa tyypin 2 diabetestä sairastavat potilaat annettiin 120 mg Starlixia kolme kertaa päivässä ennen ateriaa yhden päivän ajan yhdessä glyburidin 10 kanssa mg päivittäin. Kummankaan lääkkeen farmakokinetiikassa ei ollut kliinisesti merkittäviä muutoksia.
Metformiini: Kun Starlix 120 mg kolme kertaa päivässä ennen ateriaa annettiin yhdessä metformiinin kanssa 500 mg kolme kerran päivässä tyypin 2 diabeteksen potilailla, kummankaan farmakokinetiikassa ei havaittu kliinisesti merkitseviä muutoksia agentti.
Digoksiini: Kun Starlix 120 mg ennen ateriaa annettiin yhdessä yhden mg: n annoksen kanssa Digoksiini terveille vapaaehtoisille, kummankaan farmakokinetiikassa ei ollut kliinisesti merkitseviä muutoksia agentti.
Varfariini: Kun terveille henkilöille annettiin Starlix 120 mg kolme kertaa päivässä ennen ateriaa neljän päivän ajan yhdistelmänä yhden 30 mg: n varfariiniannoksen kanssa päivänä 2, kummankaan farmakokinetiikassa ei tapahtunut muutoksia agentti. Protrombiiniaika ei muuttunut.
Diklofenaakki: Aamu- ja lounasannosten antaminen Starlix 120 mg yhdessä yhden 75 mg: n annoksen kanssa diklofenaakin annos terveillä vapaaehtoisilla ei aiheuttanut merkittäviä muutoksia kummankaan farmakokinetiikkaan agentti.
Erityisväestöt
Geriatriset: Ikä ei vaikuttanut nateglinidin farmakokineettisiin ominaisuuksiin. Siksi annosta ei tarvitse muuttaa vanhuksille.
Sukupuoli: Nateglinidin farmakokinetiikassa ei havaittu kliinisesti merkittäviä eroja miesten ja naisten välillä. Siksi annosta ei tarvitse muuttaa sukupuolen perusteella.
Rotu: Kaukasian, mustan ja muun etnisen alkuperän potilaiden farmakokineettisen analyysin tulokset viittaavat siihen, että rodulla on vain vähän vaikutusta nateglinidin farmakokinetiikkaan.
Munuaisten vajaatoiminta: Verrattuna terveisiin vastaaviin koehenkilöihin, potilailla, joilla on tyypin 2 diabetes ja kohtalainen tai vaikea munuaisten vajaatoiminta (CrCl 15-50 ml / min), jota ei käytetä dialyysissä, näytti samanlaiselta puhdistuma, AUC ja Cmax. Dialyysipotilailla, joilla oli tyypin 2 diabetes ja munuaisten vajaatoiminta, kokonaislääkealtistus oli vähentynyt. Hemodialyysipotilaat kokivat kuitenkin myös plasmaproteiinien sitoutumisen vähenemisen verrattuna vastaaviin terveisiin vapaaehtoisiin.
Maksan vajaatoiminta: Nateglinidin huippupitoisuus ja kokonaisaltistus muilla kuin diabeetikoilla, joilla oli lievä maksan vajaatoiminta, kasvoivat 30% verrattuna vastaaviin terveisiin koehenkilöihin. Starlix® (nateglinidi) tulee käyttää varoen potilaille, joilla on krooninen maksasairaus. (Katso VAROTOIMET, Maksan vajaatoiminta.)
farmakodynamiikka
Starlix imeytyy nopeasti ja stimuloi haiman insuliinin eritystä 20 minuutin kuluessa suun kautta antamisesta. Kun Starlixia annetaan kolme kertaa päivässä ennen ateriaa, plasman insuliini nousee nopeasti, huippupitoisuudet ovat noin yksi tunti annostelun jälkeen ja lasku lähtötasoon 4 tuntia annostelun jälkeen.
Tuplasokeassa, kontrolloidussa kliinisessä tutkimuksessa, jossa Starlix annettiin ennen kutakin kolmesta ateriat, plasman glukoositasot määritettiin 12 tunnin päiväjaksolla 7 viikon kuluttua hoitoa. Starlix annettiin 10 minuuttia ennen ateriaa. Ateriat perustuivat tavanomaisiin diabeettisten painojen ylläpitovalikoihin kokonaiskaloripitoisuuden perusteella kunkin henkilön pituuden perusteella. Starlix tuotti tilastollisesti merkitseviä laskuja paasto- ja aterianjälkeisessä glykemiassa plaseboon verrattuna.
ylin
Kliiniset tutkimukset
Yhteensä 3566 potilasta satunnaistettiin yhdeksään kaksoissokkotutkimukseen, plasebo- tai aktiivikontrolloituun tutkimukseen, jotka kestäivät 8 - 24 viikkoa Starlix®: n (nateglinidi) turvallisuuden ja tehon arvioimiseksi. 3513 potilaalla oli tehon arvot lähtötasoa suuremmat. Näissä tutkimuksissa Starlixia annettiin 30 minuuttia ennen kutakin kolmena pääateriaa päivässä.
Starlix®-monoterapia verrattuna plaseboon
Satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa 24 viikon tutkimuksessa tyypin 2 diabeteksen potilaat, joilla HbA1C - 6,8% Pelkästään ruokavaliossa satunnaistettiin saamaan joko Starlix (60 mg tai 120 mg kolme kertaa päivässä ennen ateriaa) tai plaseboa. HbA1C: n lähtötaso oli välillä 7,9% - 8,1% ja 77,8% potilaista oli aikaisemmin hoitamatta suun kautta annettavalla diabeteksen hoidolla. Aikaisemmin diabeteslääkkeillä hoidettujen potilaiden piti lopettaa lääkitys vähintään 2 kuukaudeksi ennen satunnaistamista. Starlixin lisääminen ennen ateriaa johti tilastollisesti merkitsevään keskimääräisen HbA1C-arvon ja paaston keskimääräisen plasmaglukoosin (FPG) vähenemiseen lumelääkkeeseen verrattuna (ks. Taulukko 1). HbA1C: n ja FPG: n vähenemiset olivat samanlaisia potilailla, jotka eivät ole aiemmin saaneet diabeteksen vastaisia lääkkeitä.
Tässä tutkimuksessa ilmoitettiin yksi vaikea hypoglykemia (plasman glukoosiarvo <36 mg / dl) jaksossa potilaalla, jota hoidettiin Starlix 120 mg: lla kolme kertaa päivässä ennen ateriaa. Yhdelläkään potilaalla ei ollut hypoglykemiaa, joka vaati kolmannen osapuolen apua. Starlix-hoitoa saaneilla potilailla oli tilastollisesti merkitsevä keskimääräinen painonnousu lumelääkkeeseen verrattuna (ks. Taulukko 1).
Toisessa satunnaistetussa, kaksoissokkoutetussa, 24 viikon aktiivisessa ja lumelääkekontrolloidussa tutkimuksessa tyypin 2 diabeteksen potilaat satunnaistettiin saamaan Starlix (120 mg kolme kertaa päivittäin ennen ateriaa), metformiinia 500 mg (kolme kertaa päivässä), yhdistelmää Starlixiä 120 mg (kolme kertaa päivässä ennen ateriaa) ja metformiinia 500 mg (kolme kertaa päivässä), tai plasebo. Perustaso HbA1C vaihteli välillä 8,3% - 8,4%. 57 prosenttia potilaista oli aiemmin hoitamatta suun kautta annettavalla antidiabeettisella terapialla. Starlix-monoterapia johti keskimääräisen HbA1C: n ja keskimääräisen FPG: n vähennykseen merkittävästi lumelääkkeeseen verrattuna, mikä oli samanlainen kuin edellä raportoidut tutkimustulokset (katso taulukko 2).
Taulukko 1: Päätepistemäärät Starlix®-monoterapian 24 viikon kiinteän annoksen tutkimukselle
|
Plasebo |
Starlix® 60 mg kolme kertaa päivittäin ennen aterioita |
Starlix® 120 mg kolme kertaa päivittäin ennen aterioita |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Perustaso (keskiarvo) | 8.0 | 7.9 | 8.1 |
| Muutos lähtötasoon nähden (keskiarvo) | +0.2 | -0.3 | -0.5 |
| Ero lumelääkkeeseen verrattuna (keskiarvo) | -0.5 | -0.7 | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Perustaso (keskiarvo) | 167.9 | 161.0 | 166.5 |
| Muutos lähtötasoon nähden (keskiarvo) | +9.1 | +0.4 | -4.5 |
| Ero lumelääkkeeseen verrattuna (keskiarvo) | -8.7 | -13.6 | |
| Paino (kg) | N = 170 | N = 169 | N = 166 |
| Perustaso (keskiarvo) | 85.8 | 83.7 | 86.3 |
| Muutos lähtötasoon nähden (keskiarvo) | -0.7 | +0.3 | +0.9 |
| Ero lumelääkkeeseen verrattuna (keskiarvo) | +1.0 | +1.6 |
p-arvo â ‰ ¤ 0,004
Starlix®-monoterapia verrattuna muihin suun kautta otettaviin diabeteslääkkeisiin
glyburide
24-viikkoisessa, kaksoissokkoutetussa, aktiivisesti kontrolloidussa tutkimuksessa tyypin 2 diabeteksen potilaat, jotka olivat olleet sulfonyyliureassa 3 kuukauden ajan ja joilla oli lähtötasona HbA1C - ¥ ¥ 6,5% satunnaistettiin saamaan Starlix (60 mg tai 120 mg kolme kertaa päivässä ennen ateriaa) tai 10 mg glyburidia kerran päivittäin. Starlixiin satunnaistettujen potilaiden keskimääräinen HbA1C-arvo ja keskimääräinen FPG-arvo nousi merkitsevästi päätepisteessä verrattuna potilaisiin, jotka satunnaistettiin glyburidiin.
metformiini
Toisessa satunnaistetussa, kaksoissokkoutetussa, 24 viikon aktiivisessa ja lumelääkekontrolloidussa tutkimuksessa tyypin 2 diabeteksen potilaat satunnaistettiin saamaan Starlix (120 mg kolme kertaa päivittäin ennen ateriaa), metformiinia 500 mg (kolme kertaa päivässä), yhdistelmää Starlixiä 120 mg (kolme kertaa päivässä ennen ateriaa) ja metformiinia 500 mg (kolme kertaa päivässä), tai plasebo. Perustaso HbA1C vaihteli välillä 8,3% - 8,4%. 57 prosenttia potilaista oli aiemmin hoitamatta suun kautta annettavalla antidiabeettisella terapialla. Keskimääräisen HbA1C: n ja keskimääräisen FPG: n vähennykset päätepisteessä metformiini-monoterapiassa olivat merkittävästi suuremmat kuin näiden muuttujien vähenemiset Starlix-monoterapiassa (ks. Taulukko 2). Suhteessa lumelääkkeeseen Starlix-monoterapia liittyi merkittävään keskimääräisen painon nousuun, kun taas metformiinin monoterapiaan liittyi merkitsevä keskimääräisen painon lasku. Niiden potilaiden alaryhmässä, joille ei ole annettu diabeteslääkitystä, keskimääräisen HbA1C: n ja keskimääräisen FPG: n vähenemiset Starlix-monoterapiassa olivat samanlaisia kuin metformiinin monoterapiassa (ks. Taulukko 2). Niiden potilasryhmien joukossa, joita aikaisemmin hoidettiin muilla diabeteksen vastaisilla aineilla, pääasiassa glyburidilla, HbA1C Starlix-lääkkeessä monoterapiaryhmä nousi hieman lähtötasosta, kun taas HbA1C laski metformiinin monoterapiaryhmässä (katso taulukko 2).
Starlix®-yhdistelmähoito
metformiini
Toisessa satunnaistetussa, kaksoissokkoutetussa, 24 viikon aktiivisessa ja lumelääkekontrolloidussa tutkimuksessa tyypin 2 diabeteksen potilaat satunnaistettiin saamaan Starlix (120 mg kolme kertaa päivittäin ennen ateriaa), metformiinia 500 mg (kolme kertaa päivässä), yhdistelmää Starlixiä 120 mg (kolme kertaa päivässä ennen ateriaa) ja metformiinia 500 mg (kolme kertaa päivässä), tai plasebo. Perustaso HbA1C vaihteli välillä 8,3% - 8,4%. 57 prosenttia potilaista oli aiemmin hoitamatta suun kautta annettavalla antidiabeettisella terapialla. Aikaisemmin diabeteslääkkeillä hoidettujen potilaiden piti lopettaa lääkitys vähintään 2 kuukaudeksi ennen satunnaistamista. Starlixin ja metformiinin yhdistelmä johti tilastollisesti merkitsevästi suurempiin HbA1C- ja FPG-vähennyksiin verrattuna joko Starlix- tai metformiinimonoterapiaan (katso taulukko 2). Starlix yksinään tai yhdistelmänä metformiinin kanssa vähensi merkittävästi prandiaalisen glukoosipitoisuuden nousua ennen ateriaa kahteen tuntiin aterian jälkeen verrattuna pelkästään plaseboon ja metformiiniin.
Tässä tutkimuksessa ilmoitettiin yksi vaikea hypoglykemian jakso (plasman glukoosiarvo - 36 mg / dl) potilaalla, joka sai Starlixin ja metformiinin yhdistelmästä ja neljästä vaikea hypoglykemiajaksosta ilmoitettiin yhdellä metformiinipotilaalla hoitovarsi. Kukaan potilas ei kokenut hypoglykemian jaksoa, joka vaati kolmannen osapuolen apua. Lumelääkkeeseen verrattuna Starlix-monoterapia liittyi tilastollisesti merkitsevään painon nousuun, kun taas Starlix- ja metformiinihoidon yhteydessä ei havaittu merkittäviä painonmuutoksia (katso taulukko 2).
Toiseen 24 viikon kaksoissokkotutkimukseen, plasebokontrolloituun tutkimukseen aloitettiin ensimmäistä kertaa tyypin 2 diabeteksen potilaat, joilla oli HbA1C - 6,8% metformiinihoidon jälkeen (¥ ¥ 1500 mg vuorokaudessa â 1 kuukauden ajan). Neljän viikon sisäänajojaksoon metformiinin monoterapiassa (2000 mg päivässä) ja satunnaistetuksi saamaan Starlix (60 mg tai 120 mg kolme kertaa päivässä ennen ateriaa) tai plaseboa metformiinin lisäksi. Starlixin ja metformiinin yhdistelmähoitoon liittyi tilastollisesti merkitsevästi suurempi lasku HbA1C verrattuna metformiinin monoterapiaan (-0,4% ja -0,6% Starlix 60 mg: lla ja Starlix 120 mg: lla plus metformiini, vastaavasti).
Taulukko 2: Starlix®-monoterapian ja metformiinin yhdistelmän 24 viikon tutkimuksen lopputulokset
|
Plasebo |
Starlix® 120 mg kolme kertaa päivittäin ennen ateriat |
metformiini 500 mg kolme kertaa päivittäin |
Starlix® 120 mg ennen ateriat plus metformiini * |
|
| HbA1C (%) | ||||
| Kaikki | N = 160 | N = 171 | N = 172 | N = 162 |
| Perustaso (keskiarvo) | 8.3 | 8.3 | 8.4 | 8.4 |
| Muutos lähtötasoon nähden (keskiarvo) | +0.4 | -0.4 BC | -0.8 C | -1.5 |
| Ero lumelääkkeeseen | -0.8 | -1.2 | -1.9 | |
| NAN-ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Perustaso (keskiarvo) | 8.2 | 8.1 | 8.3 | 8.2 |
| Muutos lähtötasoon nähden (keskiarvo) | +0.3 | -0.7 C | -0.8 C | -1.6 |
| Ero lumelääkkeeseen | -1.0 | -1.1 | -1.9 | |
| Non-NAN-ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Perustaso (keskiarvo) | 8.3 | 8.5 | 8.7 | 8.7 |
| Muutos lähtötasoon nähden (keskiarvo) | +0.6 | +0.004 BC | -0.8 C | -1.4 |
| Ero lumelääkkeeseen | -0.6 | -1.4 | -2.0 | |
| FPG (mg / dL) | ||||
| Kaikki | N = 166 | N = 173 | N = 174 | N = 167 |
| Perustaso (keskiarvo) | 194.0 | 196.5 | 196.0 | 197.7 |
| Muutos lähtötasoon nähden (keskiarvo) | +8.0 | -13.1 BC | -30.0 C | -44.9 |
| Ero lumelääkkeeseen | -21.1 | -38.0 | -52.9 | |
| Paino (kg) | ||||
| Kaikki | N = 160 | N = 169 | N = 169 | N = 160 |
| Perustaso (keskiarvo) | 85.0 | 85.0 | 86.0 | 87.4 |
| Muutos lähtötasoon nähden (keskiarvo) | -0.4 | +0.9 BC | -0.1 | +0.2 |
| Ero lumelääkkeeseen | +1.3 | +0.3 | +0.6 |
p-arvo â ‰ ¤ 0,05 vs. plasebo
b p-arvo â ‰ ¤ 0,03 vs. metformiini
c p-arvo â ‰ ¤ 0,05 vs. yhdistelmä
* Metformiinia annettiin kolme kertaa päivässä
rosiglitatsoni
Tyypin 2 potilaille tehtiin 24 viikon kaksoissokkoutettu monikeskus plasebokontrolloitu tutkimus diabetes, jota ei hoideta riittävästi terapeuttisen vasteen jälkeen 8 mg: n rosiglitatsonimonoterapialla päivittäin. Starlixin (120 mg kolme kertaa päivässä aterian kanssa) lisäämiseen liittyi tilastollisesti merkitsevästi suurempi HbA1C-arvon lasku verrattuna rosiglitatsonimonoterapiaan. Ero oli -0,77% 24. viikolla. Painon keskimääräinen muutos lähtötasosta oli noin +3 kg Starlixillä plus rosiglitatsonilla hoidetuilla potilailla ja noin +1 kg potilailla, joita hoidettiin plasebolla ja rosiglitatsonilla.
glyburide
12 viikkoa kestäneessä tutkimuksessa tyypin 2 diabetesta sairastavien potilaiden hoidosta riittämättömästi glyburidilla 10 mg kerran päivässä Starlixin lisääminen (60 mg tai 120 mg kolme kertaa päivässä ennen ateriaa) ei tuottanut ylimääräistä hyötyä.
ylin
Käyttöaiheet ja käyttö
Starlix® (nateglinidi) on tarkoitettu lisäaineeksi ruokavalioon ja liikuntaan glykeemisen valvonnan parantamiseksi aikuisilla, joilla on tyypin 2 diabetes mellitus.
ylin
Vasta
Starlix® (nateglinidi) on vasta-aiheinen potilaille, joilla:
1. Tunnettu yliherkkyys lääkkeelle tai sen inaktiivisille aineosille.
2. Tyypin 1 diabetes.
3. Diabeettinen ketoasidoosi. Tätä tilaa tulee hoitaa insuliinilla.
ylin
varotoimet
Makrovaskulaariset tulokset: Kliinisissä tutkimuksissa ei ole saatu vakuuttavaa näyttöä makrovaskulaarisen riskin vähentämisestä Starlixin tai muun diabeteksen vastaisen lääkkeen kanssa.
Hypoglykemia: Kaikki oraaliset verensokeria alentavat lääkkeet, jotka imeytyvät systeemisesti, pystyvät tuottamaan hypoglykemiaa. Hypoglykemian esiintymistiheys liittyy diabeteksen vakavuuteen, glykeemisen tason hallintaan ja muihin potilaan ominaisuuksiin. Geriatriset potilaat, aliravitsemukset saaneet potilaat ja lisämunuaisen tai aivolisäkkeen vajaatoiminta tai vaikea munuaisten vajaatoiminta ovat alttiimpia näiden hoitojen glukoosipitoisuutta alentavalle vaikutukselle. Hypoglykemian riskiä voi lisätä rasittava fyysinen harjoittelu, alkoholin nauttiminen, riittämätön kalorien saanti akuutista tai kroonisesta pohjalta tai yhdistelmät muiden suun kautta annettavien diabeteslääkkeiden kanssa tekijöille. Hypoglykemiaa voi olla vaikea tunnistaa potilailla, joilla on autonominen neuropatia ja / tai potilailla, jotka käyttävät beetasalpaajia. Starlix® (nateglinidi) tulee antaa ennen ateriaa hypoglykemian riskin vähentämiseksi. Aterioita ohittavien potilaiden tulee myös ohittaa aikataulun mukainen Starlix-annos hypoglykemian riskin vähentämiseksi.
Maksan vajaatoiminta: Starlixia tulee käyttää varoen potilailla, joilla on kohtalainen tai vaikea maksasairaus, koska sellaisia potilaita ei ole tutkittu.
Glukoosikontrollin menetys
Ohimenevä glykeemisen hallinnan menetys voi tapahtua kuumeen, infektioon, traumaan tai leikkaukseen. Tällöin voidaan tarvita insuliiniterapiaa Starlix-hoidon sijasta. Starlixin toissijainen vika tai heikentynyt tehokkuus tietyn ajanjakson aikana voi tapahtua.
Tietoa potilaille
Potilaille on tiedotettava Starlixin mahdollisista riskeistä ja hyödyistä sekä vaihtoehtoisista hoitomuodoista. Hypoglykemian riskit ja hallinta tulisi selittää. Potilaita tulisi neuvoa ottamaan Starlix 1–30 minuuttia ennen aterian nauttimista, mutta ohittamaan aikataulun mukainen annos, jos ohittaa aterian, jotta hypoglykemian riski vähenee. Lääkkeiden yhteisvaikutuksista tulisi keskustella potilaiden kanssa. Potilaille on kerrottava mahdollisista lääkkeiden yhteisvaikutuksista Starlixin kanssa.
Laboratoriotestit
Hoitovastet tulisi arvioida ajoittain glukoosiarvoilla ja HbA1C-tasoilla.
Lääkkeiden yhteisvaikutukset
Nateglinidi sitoutuu voimakkaasti plasmaproteiineihin (98%), pääasiassa albumiiniin. In vitro -siirtotutkimukset erittäin proteiineihin sitoutuneilla lääkkeillä, kuten furosemidillä, propranololilla, kaptopriilillä, nikardipiinilla, pravastatiinilla, glyburidi, varfariini, fenytoiini, asetyylisalisyylihappo, tolbutamidi ja metformiini eivät osoittaneet vaikutusta nateglinidiproteiinin määrään sitova. Samalla tavoin nateglinidillä ei ollut vaikutusta propranololin, glyburidin, nikardipiinin, varfariinin, fenytoiinin, asetyylisalisyylihapon ja tolbutamidin seerumiproteiinisitoutumiseen in vitro. Yksittäisten tapausten harkittu arviointi on kuitenkin perusteltua kliinisessä ympäristössä.
Tietyt lääkkeet, mukaan lukien ei-steroidiset anti-inflammatoriset aineet (NSAID: t), salisylaatit, monoaminioksidaasin estäjät ja ei-selektiiviset beeta-adrenergiset estäjät voivat voimistaa Starlixin ja muiden suun kautta annettavien diabeteslääkkeiden hypoglykeemistä vaikutusta huumeita.
Tietyt lääkkeet, mukaan lukien tiatsidit, kortikosteroidit, kilpirauhasen tuotteet ja sympatomimeetit, voivat vähentää Starlixin ja muiden suun kautta otettavien diabeteslääkkeiden hypoglykeemistä vaikutusta.
Kun näitä lääkkeitä annetaan Starlixiä saaville potilaille tai ne otetaan pois, potilasta tulee tarkkailla tarkkaan glykeemisen tason muutosten varalta.
Huumeiden ja ruoan yhteisvaikutukset
Aterian koostumus (korkea proteiini, rasva tai hiilihydraatti) ei vaikuttanut nateglinidin farmakokinetiikkaan. Huippupitoisuudet plasmassa kuitenkin alenivat merkittävästi, kun Starlix annettiin 10 minuuttia ennen nestemäistä ateriaa. Starlixilla ei ollut vaikutusta mahalaukun tyhjentämiseen terveillä koehenkilöillä asetaminofeenitestillä mitattuna.
Karsinogeneesi / Mutageneesi / Hedelmällisyyden heikkeneminen
Karsinogeenisuus: Kaksivuotinen karsinogeenisuustutkimus Sprague-Dawley-rotilla suoritettiin suun kautta annettavilla nateglinidiannoksilla korkeintaan 900 mg / kg / päivä, mikä tuotti AUC-altistumisen uros- ja naarasrotilla noin 30 ja 40 kertaa ihmisen terapeuttinen altistus suositellulla Starlix-annoksella 120 mg, kolme kertaa päivässä ennen aterioita. Kaksivuotinen karsinogeenisuustutkimus B6C3F1-hiirillä suoritettiin suun kautta annettavilla nateglinidiannoksilla 400 mg / kg / vrk, mikä tuotti AUC-altistumisen miehillä ja naarashiiret noin 10 ja 30-kertaisesti ihmisen terapeuttiseen altistukseen suositellulla 120 mg: n Starlix-annoksella kolme kertaa päivässä ennen ateriaa. Rotista tai hiiristä ei löytynyt todisteita kasvaimen aiheuttamasta vasteesta.
Mutageneesi: Nateglinidi ei ollut genotoksinen in vitro Ames-testissä, hiiren lymfoomimäärityksessä, kromosomipoikkeavuustestissä kiinanhamsterin keuhkosoluissa tai hiiren in vivo mikrotumakokeessa.
Hedelmällisyyden heikkeneminen: Nateglinidin anto rotille annosteltiin jopa 600 mg / kg hedelmällisyyteen. (noin 16-kertainen ihmisen terapeuttinen altistus suositellulla Starlix-annoksella 120 mg kolme kertaa päivässä ennen ateriat).
raskaus
Raskausluokka C
Nateglinidi ei ollut teratogeeninen rotilla annoksilla, jotka olivat korkeintaan 1 000 mg / kg (noin 60-kertainen ihmisen terapeuttiseen altistukseen suositellulla Starlix-annoksella 120 mg, kolme kertaa päivässä ennen ateriaa). Kaniinilla alkion kehitykseen vaikutettiin haitallisesti, ja sappirakon ikävaiheen tai pienen sappirakon esiintyvyys lisääntyi annos 500 mg / kg (noin 40-kertainen ihmisen terapeuttiseen altistukseen suositellulla Starlix-annoksella 120 mg, kolme kertaa päivässä ennen ateriat). Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Starlixiä ei tule käyttää raskauden aikana.
Työ ja toimitus
Starlixin vaikutusta synnytykseen ja synnytykseen ihmisillä ei tunneta.
Imettävät äidit
Imetysrottien tutkimukset osoittivat, että nateglinidi erittyy maitoon; maidon ja plasman AUC0-48h-suhde oli noin 1: 4. Peri- ja postnataalisen jakson aikana kehon painot olivat alhaisempia rottien jälkeläisillä, joille annettiin nateglinidiä annoksella 1000 mg / kg (noin 60-kertainen ihmisen terapeuttiseen altistumiseen suositellulla 120 mg: n Starlix-annoksella, kolme kertaa päivässä ennen ateriat). Ei tiedetä erittyykö Starlix äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, Starlixiä ei tule antaa imettävälle naiselle.
Lasten käyttö
Starlixin turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Starlixin turvallisuudessa tai tehossa ei havaittu eroja 65-vuotiaiden tai sitä vanhempien ja alle 65-vuotiaiden välillä. Joidenkin vanhempien yksilöiden suurempaa herkkyyttä Starlix-terapialle ei kuitenkaan voida sulkea pois.
ylin
Haitalliset reaktiot
Kliinisissä tutkimuksissa Starlix®: llä (nateglinidi) hoidettiin noin 2600 tyypin 2 diabetesta sairastavaa potilasta. Heistä noin 1 335 potilasta hoidettiin vähintään 6 kuukautta ja noin 190 potilasta yhden vuoden ajan tai kauemmin.
Hypoglykemia oli suhteellisen harvinaista kaikissa kliinisten tutkimusten hoitoryhmissä. Vain 0,3% Starlix-potilaista lopetti hoidon hypoglykemian vuoksi. Ruoansulatuskanavan oireet, erityisesti ripuli ja pahoinvointi, eivät olleet yleisempää potilailla, jotka käyttivät Starlixin ja metformiinin yhdistelmää, kuin potilailla, jotka saivat pelkästään metformiinia. Samoin perifeerinen turvotus ei ollut yleisempää potilailla, jotka käyttivät Starlixin ja rosiglitatsonin yhdistelmää, kuin potilailla, jotka saivat pelkästään rosiglitatsonia. Seuraavassa taulukossa luetellaan tapahtumat, joita tapahtui useammin Starlix-potilailla kuin lumelääkepotilailla kontrolloiduissa kliinisissä tutkimuksissa.
Yleiset haittavaikutukset (¥% 2% Starlix®-potilailla) Starlix®-monoterapiakokeissa (% potilaista)
| Plasebo | Starlix® | |
| N = 458 | N = 1441 | |
| Haluttu termi | ||
| Ylähengitystieinfektio | 8.1 | 10.5 |
| Selkäkipu | 3.7 | 4.0 |
| Influenssan oireet | 2.6 | 3.6 |
| Huimaus | 2.2 | 3.6 |
| nivelsairaus | 2.2 | 3.3 |
| Ripuli | 3.1 | 3.2 |
| Tahaton trauma | 1.7 | 2.9 |
| Keuhkoputkentulehdus | 2.6 | 2.7 |
| Yskiminen | 2.2 | 2.4 |
| hypoglykemia | 0.4 | 2.4 |
Markkinoille saattamisen jälkeisen kokemuksen aikana on ilmoitettu harvoin yliherkkyysreaktioita, kuten ihottumaa, kutinaa ja urtikariaa. Samoin on ilmoitettu keltaisuutta, kolestaattista hepatiittia ja kohonneita maksaentsyymejä.
Laboratorion poikkeavuudet
Virtsahappo: Potilailla, jotka saivat pelkästään Starlix-valmistetta, Starlix-valmistetta yhdessä metformiinin, metformiinin kanssa yksinään ja glyburidin kanssa, keskimääräiset virtsahappotasot nousivat. Vastaavat erot lumelääkkeestä olivat 0,29 mg / dl, 0,45 mg / dL, 0,28 mg / dL ja 0,19 mg / dL. Näiden löydösten kliinistä merkitystä ei tunneta.
ylin
yliannostus
Kliinisessä tutkimuksessa tyypin 2 diabeetikoilla Starlix® (nateglinidi) annettiin vuonna nostamalla annoksia jopa 720 mg: aan päivässä 7 päivän ajan, eikä kliinisesti merkittäviä haittavaikutuksia ollut raportoitu. Starlixin yliannostuksia ei ole todettu kliinisissä tutkimuksissa. Yliannostus voi kuitenkin johtaa liialliseen glukoositasoa alentavaan vaikutukseen hypoglykeemisten oireiden kehittyessä. Hypoglykeemiset oireet tajuttomuuden tai neurologisten löydösten varalta tulee hoitaa suun kautta annettavalla glukoosilla ja annos- ja / tai ateriamuodoilla säätämällä. Vakavat hypoglykeemiset reaktiot, joissa on kooma, kouristukset tai muut neurologiset oireet, tulee hoitaa laskimonsisäisellä glukoosilla. Koska nateglinidi sitoutuu voimakkaasti proteiineihin, dialyysi ei ole tehokas tapa poistaa se verestä.
ylin
Annostelu ja hallinnointi
Starlix® (nateglinidi) tulee ottaa 1 - 30 minuuttia ennen ateriaa.
Monoterapia ja yhdistelmä metformiinin tai tiatsolidiinidionin kanssa
Starlixin suositeltu aloitus- ja ylläpitoannos yksinään tai yhdessä metformiinin tai tiatsolidiinidionin kanssa on 120 mg kolme kertaa päivässä ennen ateriaa.
Starlixin 60 mg: n annosta, joko yksinään tai yhdessä metformiinin tai tiatsolidiinidionin kanssa, voidaan käyttää potilailla, jotka ovat lähellä tavoitetta HbA1C hoidon aloittamisen yhteydessä.
Annostus ikääntyneillä potilailla
Erityisiä annoksen säätöjä ei yleensä tarvita. Joidenkin yksilöiden suurempaa herkkyyttä Starlix-terapialle ei kuitenkaan voida sulkea pois.
Annostus munuaisten ja maksan vajaatoiminnassa
Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai vaikea munuaisten vajaatoiminta tai potilailla, joilla on lievä maksan vajaatoiminta. Annosta potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta, ei ole tutkittu. Siksi Starlixia tulee käyttää varoen potilailla, joilla on kohtalainen tai vaikea maksasairaus (ks. VAROTOIMET, Maksan vajaatoiminta).
ylin
Kuinka toimitetaan
Starlix® (nateglinidi) tabletit
60 mg
Vaaleanpunainen, pyöreä, viistetty reunatabletti, jonka toisella puolella on merkintä "Starlix" ja toisella puolella "60".
Pullot 100... NDC 0078-0351-05
120 mg
Keltainen, soikea tabletti, jonka toisella puolella on merkintä "Starlix" ja toisella puolella "120".
Pullot 100... NDC 0078-0352-05
varastointi
Varastoi 25 ºC: ssa (77 ºF); retket sallitaan lämpötilaan 15 ºC - 30 ºC (59 ºF - 86 ºF).
Annostele tiukassa USP-astiassa.
T2008-01
REV: HEINÄKUU 2008
Valmistanut:
Novartis Pharma Stein AG
Stein, Sveitsi
Jakaja:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
Viimeksi päivitetty 07/2008
Starlix, nateglinide, täydelliset potilastiedot (selkeästi englanniksi)
Yksityiskohtaiset tiedot diabeteksen oireista, oireista, syistä ja hoidoista
Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötapoja, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysymyksiä käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta.
takaisin: Selaa kaikkia diabeteksen lääkkeitä


