Apidra diabeteksen hoitoon
Tuotemerkki: Apidra
Yleinen nimi: Insuliini Glulisine
Apidra (glulisiininsuliini) on ihmisen valmistama tuote, joka on lähes identtinen ihmisen insuliinin kanssa. Sitä käytetään diabetes mellituksen hoitoon. Käyttö, annostus, sivuvaikutukset.
Sisällys:
Käyttöaiheet ja käyttö
Annostelu ja hallinnointi
Vasta
Varoitukset ja varotoimet
Haitalliset reaktiot
Huumeiden yhteisvaikutukset
Käyttö tietyissä populaatioissa
yliannostus
Kuvaus
Kliininen farmakologia
Ei-kliininen toksikologia
Kliiniset tutkimukset
Kuinka toimitetaan
Apidra, glusiiniinsuliini, potilastiedot (selkeästi englanniksi)
viitteitä
Apidra on nopeavaikutteinen ihmisen insuliinianalogi, joka on tarkoitettu parantamaan glykeemistä kontrollia aikuisilla ja lapsilla, joilla on diabetes mellitus.
ylin
Annostelu ja hallinnointi
Annostusta koskevat näkökohdat
APIDRA on rekombinantti insuliinianalogi, joka on yhtä suuri kuin ihmisen insuliini (ts. Yhdellä APIDRA-yksiköllä on sama verensokeria alentava vaikutus kuin yhdellä yksiköllä tavallista ihmisen insuliinia) laskimoon annettaessa. Kun ihon alle annetaan, APIDRA: lla on nopeampi vaikutuksen alkaminen ja lyhyempi vaikutusaika kuin tavallisella ihmisinsuliinilla.
APIDRA-annos on yksilöitävä. Verensokerin seuranta on välttämätöntä kaikilla potilailla, jotka saavat insuliinihoitoa.
Päivittäinen kokonaisinsuliinin tarve voi vaihdella ja on yleensä välillä 0,5 - 1 yksikkö / kg / päivä. Insuliinitarpeet voivat muuttua stressin, suuren sairauden tai liikunnan, ateriamallien tai samanaikaisesti annettavien lääkkeiden muutosten yhteydessä.
Ihonalainen anto
APIDRA tulee antaa 15 minuutissa ennen ateriaa tai 20 minuutin kuluessa aterian aloittamisesta.
Ihonalaisena injektiona annettavaa APIDRAa tulisi yleensä käyttää hoito-ohjelmissa, joissa käytetään keskimääräistä tai pitkävaikutteista insuliinia.
APIDRA tulee antaa subkutaanisena injektiona vatsan seinämään, reiteen tai olkavarteen. Pistoskohdat tulee kiertää samalla alueella (vatsa, reisi tai olkavarsi) yhdestä injektiosta toiseen, jotta voidaan vähentää lipodystrofian riskiä. HAITTAVAIKUTUKSET].
Jatkuva ihonalainen infuusio (insuliinipumppu)
APIDRA voidaan antaa jatkuvana ihonalaisena infuusiona vatsan seinämään. Älä käytä laimennettua tai sekoitettua insuliinia ulkoisissa insuliinipumpuissa. Infuusiokohdat tulisi kiertää samalla alueella lipodystrofian riskin vähentämiseksi HAITTAVAIKUTUKSET]. Ulkoisen insuliini-infuusiopumpun alkuperäisen ohjelmoinnin tulisi perustua edellisen hoidon päivittäiseen kokonaisinsuliiniannokseen.
Seuraavia insuliinipumppuja on käytetty APIDRA: n kliinisissä tutkimuksissa, jotka on suorittanut APIDRA: n valmistaja sanofi-aventis:
- Disetronic® H-Tron® sekä V100 ja D-Tron® Disetronic-katetroilla (Rapid ™, Rapid C ™, Rapid D ™ ja Tender ™)
- MiniMed®-mallit 506, 507, 507c ja 508 ja MiniMed-katetrit (Sof-set Ultimate QR ™ ja Quick-set ™).
Ennen kuin käytät toista insuliinipumppua APIDRA: n kanssa, lue pumpun etiketti varmistaaksesi, että pumppu on arvioitu APIDRA: lla.
Lääkärien ja potilaiden tulee arvioida huolellisesti pumpun käyttöä koskevat tiedot APIDRA-lääkemääräyksissä, potilastiedotteissa ja pumpun valmistajan oppaissa. APIDRA-erityisiä tietoja tulee noudattaa käyttöajan, infuusioyksiköiden vaihtamistiheyden tai muun suhteen APIDRA-käytön erityiset yksityiskohdat, koska APIDRA -kohtaiset tiedot voivat poiketa pumpun yleisestä käyttöohjeesta ohjeet.
Perustuen in vitro -tutkimuksiin, jotka ovat osoittaneet säilöntäaineen, metakresolin ja insuliinin hajoamisen, APIDRA säiliössä tulisi vaihtaa vähintään 48 tunnin välein. Kliinisessä käytössä oleva APIDRA ei saa altistua yli 37 ° C (98,6 ° F) lämpötiloille. [See VAROITUKSET JA VAROTOIMET ja TOIMITTAMINEN / Varastointi ja käsittely].
Laskimonsisäinen antaminen
APIDRAa voidaan antaa laskimonsisäisesti lääketieteellisessä valvonnassa glykeemisen kontrollin suhteen seuraamalla tarkoin verensokeria ja seerumin kaliumia hypoglykemian ja hypokalemian välttämiseksi. Laskimonsisäiseen käyttöön APIDRAa tulisi käyttää pitoisuuksina 0,05 yksikköä / ml - 1 yksikkö / ml glulisiininsuliinia infuusiojärjestelmissä, joissa käytetään polyvinyylikloridipusseja (PVC). APIDRAn on osoitettu pysyvän vain normaalissa suolaliuoksessa (0,9% natriumkloridi). Parenteraaliset lääkevalmisteet on tarkastettava silmämääräisesti hiukkasten ja värimuutosten varalta ennen antamista, aina kun liuos ja pakkaus sallivat. Älä anna insuliiniseoksia laskimonsisäisesti.
Annosmuodot ja vahvuudet
Apidra 100 yksikköä / ml (U-100) on saatavana:
- 10 ml injektiopulloja
- 3 ml patruunoita käytettäväksi OptiClikissä® Insuliinin annostelulaite
- 3 ml SoloStar-esitäytettyä kynää
ylin
Vasta
Apidra on vasta-aiheinen:
- hypoglykemian jaksojen aikana
- potilaille, jotka ovat yliherkkiä Apidralle tai jollekin sen apuaineelle
Käytettynä potilailla, joilla tunnetaan yliherkkyys Apidralle tai sen apuaineille, potilailla voi kehittyä paikallisia tai yleisiä yliherkkyysreaktioita. Haitalliset reaktiot].
ylin
Varoitukset ja varotoimet
Annostuksen säätäminen ja seuranta
Glukoosin seuranta on välttämätöntä potilaille, jotka saavat insuliinihoitoa. Insuliinijärjestelmään tulee tehdä muutoksia varovaisesti ja vain lääkärin valvonnassa. Insuliinin voimakkuuden, valmistajan, tyypin tai antotavan muutokset voivat johtaa tarpeeseen muuttaa insuliiniannosta. Samanaikaista suun kautta annettavaa diabeteslääkitystä voidaan joutua säätämään.
Kuten kaikkien insuliinivalmisteiden tapauksessa, Apidran vaikutustaika voi vaihdella eri henkilöillä tai eri aikoina sama henkilö ja riippuu monista sairauksista, mukaan lukien pistoskohdasta, paikallisesta verentoimituksesta tai paikallisesta lämpötila. Potilaat, jotka muuttavat fyysisen aktiivisuutensa tasoa tai ateriaohjelmaa, voivat vaatia insuliiniannosten muuttamista.
hypoglykemia
Hypoglykemia on yleisin insuliinihoidon haittavaikutus, Apidra mukaan lukien. Hypoglykemian riski kasvaa tiukemman glykeemisen valvonnan avulla. Potilaita on koulutettava tunnistamaan ja hallitsemaan hypoglykemia. Vakava hypoglykemia voi johtaa tajuttomuuteen ja / tai kouristuksiin ja johtaa aivojen toiminnan tilapäiseen tai pysyvään heikkenemiseen tai kuolemaan. Vakava hypoglykemia, joka vaatii toisen henkilön apua ja / tai parenteraalinen glukoosi-infuusio tai glukagonin antamista on havaittu kliinisissä tutkimuksissa insuliinin kanssa, mukaan lukien tutkimukset Apidra.
Hypoglykemian ajoitus heijastaa yleensä annettujen insuliiniformulaatioiden aika-toimintaprofiilia. Muut tekijät, kuten muutokset ruuan saannissa (esim. Ruuan määrä tai aterioiden ajoitus), pistoskohta, liikunta ja samanaikaiset lääkkeet voivat myös muuttaa hypoglykemian riskiä [Katso Huumeiden yhteisvaikutukset].
Kuten kaikki insuliinit, noudata varovaisuutta potilailla, joilla on hypoglykemia-tietoisuus, ja potilailla, jotka voivat olla jotka ovat alttiita hypoglykemialle (esim. lapsiväestö ja potilaat, jotka paastovat tai syövät epätäydellistä ruokaa saanti). Potilaan kyky keskittyä ja reagoida voi heikentyä hypoglykemian seurauksena. Tämä voi aiheuttaa riskin tilanteissa, joissa nämä kyvyt ovat erityisen tärkeitä, kuten ajaessasi tai käyttäessäsi muita koneita.
Seerumin glukoositasojen nopeat muutokset voivat aiheuttaa diabetespotilailla hypoglykemian kaltaisia oireita glukoosiarvosta riippumatta. Hypoglykemian varhaisvaroitukset voivat olla erilaisia tai heikompia tietyissä olosuhteissa, kuten pitkäaikainen diabetes, diabeettinen hermosairaus, lääkkeiden, kuten beetasalpaajien, käyttö [Katso Huumeiden yhteisvaikutukset] tai tehostettua diabeteksen hallintaa. Nämä tilanteet voivat johtaa vakavaan hypoglykemiaan (ja mahdollisesti tajunnan menetykseen) ennen potilaan tietoisuutta hypoglykemiasta.
Laskimonsisäisesti annetulla insuliinilla on nopeampi vaikutuksen alkaminen kuin ihonalaisesti annetulla insuliinilla, mikä vaatii tarkempaa hypoglykemian seurantaa.
Yliherkkyys ja allergiset reaktiot
Insuliinivalmisteilla, mukaan lukien Apidra, voi esiintyä vakavaa, hengenvaarallista, yleistynyttä allergiaa, mukaan lukien anafylaksia. Haitalliset reaktiot].
hypokalemia
Kaikki insuliinituotteet, Apidra mukaan lukien, aiheuttavat kaliummuutoksen solunulkoisesta tilaan solunsisäiseen tilaan, mikä voi johtaa hypokalemiaan. Hoitamaton hypokalemia voi aiheuttaa hengityshalvauksen, kammioarytmian ja kuoleman. Ole varovainen potilailla, joilla saattaa olla riski hypokalemiaan (esim. Potilaat, jotka käyttävät kaliumia alentavia lääkkeitä, potilaat, jotka käyttävät lääkkeitä, jotka ovat herkkiä seerumin kaliumpitoisuuksille). Tarkkaile glukoosia ja kaliumia usein, kun Apidraa annetaan laskimonsisäisesti.
Munuaisten tai maksan vajaatoiminta
Munuaisten tai maksan vajaatoiminnasta kärsivillä potilailla voidaan tarvita usein glukoosin seurantaa ja insuliiniannoksen pienentämistä Kliininen farmakologia].
Insuliinien sekoittaminen
Ihonalaiseen injektioon tarkoitettua Apidraa ei saa sekoittaa muiden insuliinivalmisteiden kuin NPH-insuliinin kanssa. Jos Apidraa sekoitetaan NPH-insuliinin kanssa, Apidra tulee vetää ensin ruiskuun. Injektio tapahtuu heti sekoittamisen jälkeen.
Älä sekoita Apidraa muiden insuliinien kanssa laskimoon tai jatkuvaan ihonalaiseen infuusiopumppuun käytettäväksi.
Laskimoon annettavaa Apidraa ei saa laimentaa muilla kuin 0,9-prosenttisella natriumkloridiliuoksella (normaali suolaliuos). Apidran sekoittamisen tehoa ja turvallisuutta ulkoisissa ihonalaisissa infuusiopumppuissa käytettävien laimentimien tai muiden insuliinien kanssa ei ole osoitettu.
Ihonalaiset insuliini-infuusiopumput
Kun Apidraa käytetään ulkoisessa insuliinipumpussa ihonalaiseen infuusioon, sitä ei pidä laimentaa tai sekoittaa minkään muun insuliinin kanssa. Säiliön apidra tulee vaihtaa vähintään 48 tunnin välein. Apidraa ei saa altistaa yli 37 ° C: n lämpötiloille.
Insuliinipumpun tai infuusioyksikön toimintahäiriöt tai insuliinin hajoaminen voivat nopeasti johtaa hyperglykemiaan ja ketoosiin. Hyperglykemian tai ketoosin syyn nopea tunnistaminen ja korjaaminen on välttämätöntä. Väliaikaiset ihonalaiset injektiot Apidralla voivat olla tarpeen. Potilaat, jotka käyttävät jatkuvaa ihonalaista insuliini-infuusiopumppuhoitoa, on koulutettava antamaan insuliinia injektiona, ja potilaalla on oltava vaihtoehtoinen insuliinihoito pumpun vajaatoiminnan varalta. [See Annostelu ja hallinnointi, Kuinka toimitetaan / varastointi ja käsittely].
Laskimonsisäinen antaminen
Kun Apidraa annetaan laskimonsisäisesti, glukoosi- ja kaliumpitoisuutta on seurattava tarkoin, jotta vältetään mahdollisesti kuolettava hypoglykemia ja hypokalemia.
Älä sekoita Apidraa muiden insuliinien kanssa laskimoon annettavaksi. Apidra voidaan laimentaa vain normaalissa suolaliuoksessa.
Huumeiden yhteisvaikutukset
Jotkut lääkkeet voivat muuttaa insuliinintarvetta ja hypoglykemian tai hyperglykemian riskiä Huumeiden yhteisvaikutukset].
ylin
Haitalliset reaktiot
Seuraavista haittavaikutuksista keskustellaan muualla:
- Hypoglykemia [Katso Varoitukset ja varotoimet]
- Hypokalemia [Katso Varoitukset ja varotoimet]
Kliinisen tutkimuksen kokemus
Koska kliiniset tutkimukset suoritetaan hyvin erilaisilla suunnitelmilla, yhdessä kliinisessä tutkimuksessa ilmoitetut haittavaikutusten määrät eivät välttämättä ole voidaan verrata helposti toisessa kliinisessä tutkimuksessa ilmoitettuihin nopeuksiin, eivätkä ne välttämättä heijasta kliinisessä tutkimuksessa tosiasiallisesti havaittuja nopeuksia harjoitella.
Seuraavissa taulukoissa on lueteltu haittavaikutusten esiintyvyys Apidra-kliinisissä tutkimuksissa tyypin 1 diabeteksen ja tyypin 2 diabeteksen potilailla.
Taulukko 1: Hoito - esiintyvät haittavaikutukset tyypin 1 diabetestä sairastavien potilaiden yhdistetyissä tutkimuksissa (haittavaikutukset, joiden esiintymistiheys â ‰% 5%)
| APIDRA,% (N = 950) |
Kaikki vertailut, % (N = 641) |
|
| nasofaryngiitti | 10.6 | 12.9 |
| hypoglykemiab | 6.8 | 6.7 |
| Ylähengitysteiden infektio | 6.6 | 5.6 |
| Influenssa | 4.0 | 5.0 |
|
Lisproinsuliini, tavallinen ihmisinsuliini, aspartinsuliini b Vain vaikea oireellinen hypoglykemia |
Taulukko 2: Hoito - esiintyvät haittavaikutukset tyypin 2 diabetestä sairastavien potilaiden yhdistetyissä tutkimuksissa (haittavaikutukset, joiden esiintymistiheys â ‰ ¥ 5%)
| APIDRA,% (N = 883) |
Normaali ihmisinsuliini,% (N = 883) |
|
| Ylähengitysteiden infektio | 10.5 | 7.7 |
| nasofaryngiitti | 7.6 | 8.2 |
| Turvotus perifeerinen | 7.5 | 7.8 |
| Influenssa | 6.2 | 4.2 |
| nivelkipu | 5.9 | 6.3 |
| verenpainetauti | 3.9 | 5. |
- lastentautioppi
Taulukossa 3 on yhteenveto kliinisessä tutkimuksessa esiintyneistä haittavaikutuksista yli 5% APIDRA: lla (n = 277) tai lisproinsuliinilla hoidetuilla tyypin 1 diabeteksen lapsilla ja murrosikäisillä (N = 295).
Taulukko 3: Hoito - esiintyvät haittavaikutukset tyypin 1 diabeteksen lapsilla ja murrosikäisillä (haittavaikutukset, joiden esiintymistiheys â ‰% 5%)
| APIDRA,% (N = 277) |
Lispro,% (N = 295) |
|
| nasofaryngiitti | 9.0 | 9.5 |
| Ylähengitysteiden infektio | 8.3 | 10.8 |
| Päänsärky | 6.9 | 11.2 |
| Hypoglykeeminen kohtaus | 6.1 | 4.7 |
- Vakava oireellinen hypoglykemia
Hypoglykemia on yleisimmin havaittu haittavaikutus insuliinia käyttävillä potilailla, mukaan lukien Apidra Varoitukset ja varotoimet]. Vakavan oireenmukaista hypoglykemian määrää ja esiintyvyyttä, joka määritellään hypoglykemiaksi, joka vaatii kolmannen osapuolen väliintuloa, olivat vertailukelpoisia kaikissa hoito-ohjelmissa (katso taulukko 4). Vaiheen 3 kliinisessä tutkimuksessa tyypin 1 diabeteksen saaneilla lapsilla ja nuorilla oli esiintyvyys korkeampi vakavan oireenmukaista hypoglykemiaa kahdessa hoitoryhmässä verrattuna tyypin 1 aikuisiin diabetes. (katso taulukko 4) Kliiniset tutkimukset].
Taulukko 4: Vakava oireellinen hypoglykemia *
| Tyypin 1 diabetes Aikuisia 12 viikkoa glargininsuliinilla |
Tyypin 1 diabeteksen aikuiset 26 viikkoa glargininsuliinilla |
Tyypin 2 diabetes Aikuisia 26 viikkoa NPH-ihmisinsuliinilla |
Tyypin 1 diabeteksen lastenlääkkeet 26 viikkoa |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra Ennen ateriaa |
Apidra Aterian jälkeen |
Normaali ihmisen insuliini | Apidra | Insuliini Lispro | Apidra | Normaali ihmisen insuliini | Apidra | Insuliini Lispr | |
| * Vakava oireellinen hypoglykemia, joka määritellään hypoglykemiseksi tapahtumaksi, joka vaatii toisen henkilön apua ja joka täyttää yhden seuraavista kriteereistä: tapahtumaan liittyi kokoveren viittaus verensokeriin <36 mg / dl tai tapahtumaan liittyi nopea toipuminen suun kautta annettujen hiilihydraattien, laskimonsisäisen glukoosin tai glukagonin annon jälkeen. | |||||||||
| Tapahtumat kuukaudessa potilasta kohti | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Potilaiden osuus (n / kokonaismäärä N) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Insuliinin aloittaminen ja glukoosikontrollin tehostaminen
Glukoosin hallinnan tehostamiseen tai nopeaan parantamiseen on liitetty ohimenevä, palautuva oftalmologinen taitehäiriö, diabeettisen retinopatian paheneminen ja akuutti tuskallinen perifeerinen neuropatia. Pitkäaikainen glykeeminen hallinta vähentää kuitenkin diabeettisen retinopatian ja neuropatian riskiä.
- lipodystrofia
Insuliinin, mukaan lukien Apidra, pitkäaikainen käyttö voi aiheuttaa lipodystrofiaa toistuvien insuliini-injektioiden tai infuusioiden yhteydessä. Lipodystrofiaan sisältyy lipohypertrofia (rasvakudoksen paksuuntuminen) ja lipoatrofia (rasvakudoksen oheneminen), ja se voi vaikuttaa insuliinin imeytymiseen. Kierrä insuliinin injektio- tai infuusiokohtia samalla alueella vähentääksesi lipodystrofian riskiä. [See Annostelu ja hallinnointi].
- Painonnousu
Painonnousu voi tapahtua insuliinihoidolla, mukaan lukien Apidra, ja sen katsotaan johtuvan insuliinin anabolisista vaikutuksista ja glukosurian vähenemisestä.
- Perifeerinen turvotus
Insuliini, mukaan lukien Apidra, voi aiheuttaa natriumretentiota ja turvotusta, etenkin jos aiemmin huono aineenvaihdunnan hallinta paranee tehostetulla insuliiniterapialla.
- Haittavaikutukset jatkuvalla ihonalaisella insuliininfuusiolla (CSII)
12 viikon satunnaistetussa tutkimuksessa tyypin 1 diabeteksen (n = 59) potilailla katetrin nopeus tukkeumat ja infuusiokohdan reaktiot olivat samanlaisia Apidraa ja aspartinsuliinia saaneilla potilailla (Taulukko 5).
Taulukko 5: Katetrin tukkeumat ja reaktiot infuusiokohdassa.
| Apidra (N = 29) |
aspartinsuliini (N = 30) |
|
|---|---|---|
| Katetrin tukkeumat / kuukausi | 0.08 | 0.15 |
| Infuusiokohdan reaktiot | 10.3% (3/29) | 13.3% (4/30) |
- Allergiset reaktiot
Paikallinen allergia
Kuten mitä tahansa insuliinihoitoa käytettäessä, Apidraa käyttävillä potilailla voi olla punoitusta, turvotusta tai kutinaa pistoskohdassa. Nämä vähäiset reaktiot häviävät yleensä muutamasta päivästä muutamaan viikkoon, mutta joissakin tapauksissa se voi vaatia Apidran käytön lopettamista. Joissain tapauksissa nämä reaktiot voivat liittyä muihin tekijöihin kuin insuliiniin, kuten ihon puhdistusaineen ärsyttäjiin tai huonoon injektiotekniikkaan.
Systeeminen allergia
Minkä tahansa insuliinin, mukaan lukien Apidra, kanssa voi esiintyä vakavaa, hengenvaarallista, yleistynyttä allergiaa, mukaan lukien anafylaksia. Yleinen insuliiniallergia voi aiheuttaa koko kehon ihottumaa (mukaan lukien kutina), hengenahdistusta, hengityksen vinkumista, hypotensiota, takykardiaa tai vihoa.
Enintään 12 kuukauden mittaisissa kontrolloiduissa kliinisissä tutkimuksissa mahdollisia systeemisiä allergisia reaktioita ilmoitettiin 79: lla potilaalla 1833 potilasta (4,3%), jotka saivat Apidraa, ja 58 potilasta 1524 potilasta (3,8%), jotka saivat vertailun lyhytaikaista vaikutusta insuliinit. Näiden kokeiden aikana Apidra-hoito lopetettiin pysyvästi yhdellä 1833 potilaasta mahdollisen systeemisen allergisen reaktion vuoksi.
Paikallisia reaktioita ja yleistyneitä myalgioita on ilmoitettu käytettäessä metakresolia, joka on Apidran apuaine.
Vasta-aineiden tuotanto
Tyypin 1 diabeteksen (n = 333) potilailla tehdyssä tutkimuksessa insuliinivasta-aineiden pitoisuudet, jotka reagoivat sekä ihmisinsuliinin että insuliinin kanssa glulisiini (ristireaktiiviset insuliinivasta-aineet) pysyi lähellä lähtötasoa tutkimuksen 6 ensimmäisen kuukauden aikana potilailla, joita hoidettiin Apidra. Vasta-ainepitoisuuden lasku havaittiin tutkimuksen seuraavien 6 kuukauden aikana. Tyypin 2 diabeteksen (n = 411) potilailla tehdyssä tutkimuksessa samanlainen ristireagoivan insuliinivasta-ainepitoisuuden kasvu oli havaittu potilailla, joita hoidettiin Apidralla ja potilailla, joita hoidettiin ihmisinsuliinilla ensimmäisen 9 kuukauden aikana opiskella. Sen jälkeen vasta-aineiden konsentraatio laski Apidra-potilailla ja pysyi vakaana ihmisinsuliinipotilailla. Ristireaktiivisten insuliinivasta-ainepitoisuuksien ja HbA1c: n, insuliiniannoksien tai hypoglykemian esiintymisen välillä ei ollut korrelaatiota. Näiden vasta-aineiden kliinistä merkitystä ei tunneta.
Apidra ei herättänyt merkittävää vasta-ainevastetta tutkimuksessa, joka koski lasten ja nuorten tyypin 1 diabetesta.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on havaittu Apidran käytön hyväksynnän jälkeen.
Koska näitä reaktioita ilmoitetaan vapaaehtoisesti epävarman koon väestöstä, niin ei ole aina mahdollista arvioida luotettavasti niiden esiintymistiheyttä tai vahvistaa syy-yhteys huumeisiin valotus.
On ilmoitettu lääkevirheitä, joissa Apidran sijasta on vahingossa annettu muita insuliineja, etenkin pitkävaikutteisia insuliineja.
ylin
Huumeiden yhteisvaikutukset
Monet lääkkeet vaikuttavat glukoosimetaboliaan ja saattavat edellyttää insuliiniannoksen säätämistä ja erityistä tarkkaa seurantaa.
Lääkkeisiin, jotka voivat lisätä insuliinien, mukaan lukien Apidra, verensokeria alentavaa vaikutusta ja siten lisätä hypoglykemian riskiä, sisältyvät suun kautta annettavat diabeteslääkkeet, pramlintiidi, ACE-estäjät, disopyramidi, fibraatit, fluoksetiini, monoaminioksidaasin estäjät, propoksifeeni, pentoksifylliini, salisylaatit, somatostatiinianalogit ja sulfonamidi antibiootteja.
Lääkkeitä, jotka voivat vähentää Apidran verensokeria alentavaa vaikutusta, ovat kortikosteroidit, niasiini, danatsoli, diureetit, sympatomimeetit (esim. Epinefriini, albuteroli, terbutaliini), glukagoni, isoniatsidi, fenotiatsiinijohdannaiset, somatropiini, kilpirauhashormonit, estrogeenit, progestogeenit (esim. oraaliset ehkäisyvalmisteet), proteaasinestäjät ja epätyypilliset psykoosilääkkeet.
Beetasalpaajat, klonidiini, litiumsuolat ja alkoholi voivat joko lisätä tai vähentää insuliinin verensokeria alentavaa vaikutusta.
Pentamidiini voi aiheuttaa hypoglykemiaa, jota voi joskus seurata hyperglykemia.
Hypoglykemian merkit voivat vähentyä tai puuttua potilailla, jotka käyttävät adrenergisiä lääkkeitä, kuten beetasalpaajat, klonidiini, guanetidiini ja reserpiini.
ylin
Käyttö tietyissä populaatioissa
raskaus
Raskauskategoria C: Glulisiini-insuliinilla on tehty lisääntymis- ja teratologiatutkimuksia rotilla ja kaneilla, joissa vertailuna on käytetty tavallista ihmisen insuliinia. Glulisinsuliinia annettiin naarasrotille koko raskauden ajan ihonalaisina annoksina, jotka olivat korkeintaan 10 yksikköä / kg kerran päivässä (annos altistuminen 2 kertaa ihmisen keskimääräinen annos perustuen kehon pinta-alan vertailuun), eikä sillä ollut merkittäviä toksisia vaikutuksia alkion ja sikiön kehittäminen.
Glulisinsuliinia annettiin naaraskaniille koko raskauden ajan ihon alle 1,5 annoksena Yksiköt / kg / päivä (annos, joka johtaa altistumiseen 0,5 kertaa ihmisen keskimääräinen annos ruumiin pinta-alan perusteella) vertailu). Haitallisia vaikutuksia alkion ja sikiön kehitykseen havaittiin vain äidille toksisilla annostasoilla, jotka indusoivat hypoglykemiaa. Lisääntynyt implantaation jälkeisten menetysten ja luurankojen esiintyvyys havaittiin annoksella 1,5 yksikköä / kg kerran päivässä (annos jolloin tuloksena on altistus, joka on 0,5 kertaa ihmisen keskimääräinen annos, joka perustuu kehon pinta - alan vertailuun), joka myös aiheutti kuolleisuuden patoja. Seuraavalla pienimmällä annostasolla 0,5 yksikköä / kg kerran vuorokaudessa havaittiin vähäistä lisääntymistä implantaation jälkeisten tappioiden esiintymistiheydessä (annos, joka johtaa altistukseen kertaa keskimääräinen ihmisen annos, joka perustuu kehon pinta-alan vertailuun), johon liittyi myös vaikea hypoglykemia, mutta siinä ei ollut vikoja annos. Kaniinilla ei havaittu vaikutuksia annoksella 0,25 yksikköä / kg kerran päivässä (annos, joka johtaa altistumiseen 0,1-kertainen ihmisen keskimääräiseen annokseen, kehon pinta-alavertailun perusteella). Glulisiininsuliinin vaikutukset eivät poikkea vaikutuksista, joita havaittiin samoilla annoksilla ihonalaisella säännöllisellä ihmisinsuliinilla, ja niiden katsottiin johtuvan äidin hypoglykemian toissijaisista vaikutuksista.
Apidran käytöstä raskaana olevilla naisilla ei ole hyvin kontrolloituja kliinisiä tutkimuksia. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulisi käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen riskin sikiölle. Diabetespotilailla tai raskausdiabetesta kärsivillä potilailla on välttämätöntä ylläpitää hyvää aineenvaihdunnan hallintaa ennen raskautta ja koko raskauden ajan. Insuliinitarpeet saattavat vähentyä ensimmäisen kolmanneksen aikana, yleensä lisääntyä toisen ja kolmannen kolmanneksen aikana ja vähentyä nopeasti synnytyksen jälkeen. Näiden potilaiden glukoosipitoisuuden tarkka seuranta on välttämätöntä.
Imettävät äidit
Ei tiedetä, erittyykö glulisiininsuliini äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta, kun Apidraa annetaan imettävälle naiselle. Apidran käyttö on yhteensopivaa imetyksen kanssa, mutta imettävät diabeetikot voivat tarvita insuliiniannoksien muuttamista.
Käyttö lapsille
Apidran subkutaanisten injektioiden turvallisuus ja tehokkuus on osoitettu tyypin 1 diabeteksen saaneilla lapsipotilailla (ikä 4 - 17 vuotta). Kliiniset tutkimukset]. Apidraa ei ole tutkittu alle 4-vuotiailla lapsilla, joilla on tyypin 1 diabetes, ja lapsilla, joilla on tyypin 2 diabetes.
Kuten aikuisillakin, Apidran annos on yksilöitävä lapsipotilailla metabolisen tarpeen ja verensokerin säännöllisen seurannan perusteella.
Geriatrinen käyttö
Kliinisissä tutkimuksissa (n = 2408) Apidraa annettiin 147 potilaalle - 65-vuotiaille ja 27 potilaalle - 75-vuotiaille. Valtaosalla tästä pienestä vanhusten potilasryhmästä oli tyypin 2 diabetes. HbA1c-arvojen ja hypoglykemian esiintymistiheyden muutokset eivät eronneet iän mukaan. Siitä huolimatta, että Apidraa annetaan geriatrisille potilaille, on noudatettava varovaisuutta.
ylin
yliannostus
Ylimääräinen insuliini voi aiheuttaa hypoglykemiaa ja etenkin laskimonsisäisesti hypokalemiaa. Lieviä hypoglykemiajaksoja voidaan yleensä hoitaa suun kautta annettavalla glukoosilla. Lääkkeen annostusta, ateriamalleja tai liikuntaa voidaan joutua muuttamaan. Vakavampia hypoglykemiajaksoja, joissa on kooma, kouristus tai neurologinen vajaatoiminta, voidaan hoitaa lihaksensisäisellä / ihonalaisella glukagonilla tai väkevällä laskimonsisäisellä glukoosilla. Jatkuva hiilihydraattien saanti ja tarkkailu voivat olla tarpeen, koska hypoglykemia voi toistua ilmeisen kliinisen toipumisen jälkeen. Hypokalemia on korjattava asianmukaisesti.
Kuvaus
Apidra® (glulisiininsuliini [rDNA alkuperä] -injektio) on nopeavaikutteinen ihmisen insuliinianalogi, jota käytetään alentamaan verensokeria. Glulisuliininsuliini tuotetaan rekombinantti-DNA-tekniikalla käyttämällä ei-patogeenistä Escherichia colin (K12) laboratoriokantaa. Glulisuliininsuliini eroaa ihmisen insuliinista siinä, että aminohappoasparagiini asemassa B3 korvataan lysiinillä ja asemassa B29 oleva lysiini korvataan glutamiinihapolla. Kemiallisesti glulisiininsuliini on 3B-lysiini-29B-glutamiinihappo-ihmisinsuliini, sen empiirinen kaava on C258H384N64O78S6 ja molekyylipaino 5823, ja sillä on seuraava rakennekaava:
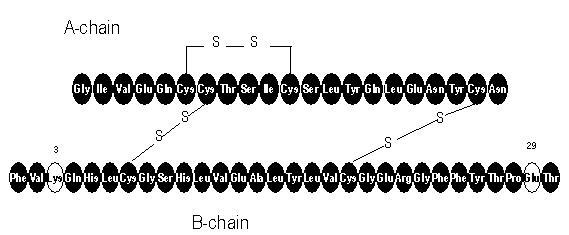
Apidra on steriili, vesipitoinen, kirkas ja väritön liuos. Jokainen Apidra-millilitra sisältää 100 yksikköä (3,49 mg) glulisiininsuliinia, 3,15 mg metakresolia, 6 mg trometamiinia, 5 mg natriumkloridia, 0,01 mg polysorbaattia 20 ja injektionesteisiin käytettävää vettä. Apidran pH on noin 7,3. PH säädetään lisäämällä suolahapon ja / tai natriumhydroksidin vesiliuoksia.
ylin
Kliininen farmakologia
Toimintamekanismi
Glukoosimetabolian sääteleminen on insuliinien ja insuliinianalogien, mukaan lukien glulisinsuliini, ensisijainen aktiivisuus. Insuliinit alentavat verensokeria stimuloimalla luu-lihaksen ja rasvan perifeeristä glukoosin imeytymistä ja estämällä maksan glukoosin tuotantoa. Insuliinit estävät lipolyysiä ja proteolyysiä ja tehostavat proteiinisynteesiä.
Apidran ja tavallisen ihmisinsuliinin glukoosipitoisuutta alentavat vaikutukset ovat potentiaalisia, kun niitä annetaan laskimonsisäisesti. Ihonalaisen annon jälkeen Apidran vaikutus alkaa nopeammin ja kestää lyhyemmin kuin tavallisessa ihmisinsuliinissa. [Katso farmakodynamiikka].
farmakodynamiikka
Terveillä vapaaehtoisilla ja diabetespotilailla tehdyt tutkimukset osoittivat, että Apidra on nopeampi vaikutuksen alkaminen ja lyhyempi toiminnan kesto kuin tavalliselle ihmisinsuliinille annettaessa ihon alle.
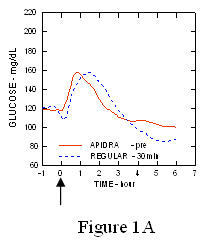
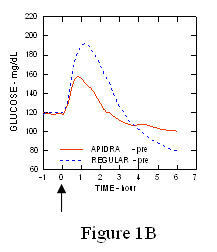
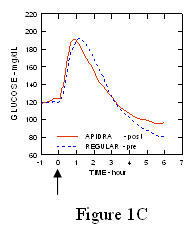
Tyypin 1 diabeteksen (n = 20) potilailla tehdyssä tutkimuksessa Apidran ja säännöllinen ihmisinsuliini arvioitiin eri aikoina suhteessa tavanomaiseen ateriaan annoksella 0,15 Yksikköä / kg. (Kuvio 1.)
Suurin verensokerin kulku (Î ”GLUmax; lähtötasosta vähennetty glukoosipitoisuus) 2 minuuttia ennen ateriaa injektoidun Apidran ollessa 65 mg / dL verrattuna normaalin ihmisen 64 mg / dL insuliini, joka injektoidaan 30 minuuttia ennen ateriaa (ks. kuva 1A), ja 84 mg / dl tavanomaiselle ihmisinsuliinille, joka injektoidaan 2 minuuttia ennen ateriaa (ks. kuva 1B). 15 minuutin kuluttua aterian alkamisesta injektoidun Apidran enimmäisverensokeritasapaino oli 85 mg / dL verrattuna 84 mg / dl tavanomaiseen ihmisinsuliiniin, joka ruiskutetaan 2 minuuttia ennen ateriaa (ks. kuva 1C).
Kuvio 1. Seriaalinen keskimääräinen verensokeri, joka kerättiin jopa 6 tuntiin Apidran ja tavallisen ihmisinsuliinin kerta-annoksen jälkeen. Apidralle annettiin 2 minuuttia (Apidra - pre) ennen aterian alkua verrattuna tavanomaiseen ihmisinsuliiniin, jota annettiin 30 minuuttia (säännöllinen - 30 min) ennen aterian aloittamista (kuva 1A) ja verrattuna tavanomaiseen ihmisinsuliiniin (säännöllinen - pre), joka annettiin 2 minuuttia ennen ateriaa (kuva 1B). Apidralle annettiin 15 minuuttia (Apidra - post) aterian aloittamisen jälkeen verrattuna tavanomaiseen ihmisinsuliiniin (Normaali - pre), joka annettiin 2 minuuttia ennen ateriaa (kuva 1C). X-akselilla nolla (0) on 15 minuutin aterian alku.
 |
 |
 |
 |
Satunnaistetussa, avoimessa, kaksisuuntaisessa ristiintutkimuksessa 16 tervettä miespuolista koehenkilöä sai laskimonsisäisen Apidran tai tavallisen ihmisinsuliinin infuusio suolaliuoslaimentimella nopeudella 0,8 milliyksikköä / kg / min kahdelle tuntia. Saman Apidra-annoksen tai tavanomaisen ihmisinsuliinin infuusio tuotti vastaavan verensokerin loppumisen tasapainotilassa.
farmakokinetiikkaa
Imeytyminen ja hyötyosuus
Farmakokinetiikkaprofiilit terveillä vapaaehtoisilla ja diabetespotilailla (tyyppi 1 tai tyyppi 2) osoittivat, että glulisiininsuliini imeytyi nopeammin kuin tavallinen ihmisinsuliini.
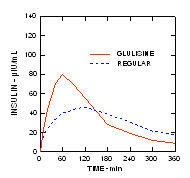
Tyypin 1 diabeteksen (n = 20) potilailla tehdyssä tutkimuksessa, jonka ihonalainen annos oli 0,15 yksikköä / kg, keskimääräinen aika maksimipitoisuuteen (Tmax) oli 60 minuuttia (alue 40-120 minuuttia) ja huippupitoisuus (Cmax) oli 83 mikroyksikköä / ml (alue 40-131 mikroyksikköä / ml) glulisinsuliinille verrattuna keskimääräiseen Tmax-arvoon 120 minuuttia (alue 60 - 239 minuuttia) ja Cmax-arvoon 50 mikroyksikköä / ml (alue 35 - 71 mikroyksikköä / ml) normaaleille ihmisille insuliini. (Kuva 2)
Kuvio 2. Glulisinsuliinin ja tavallisen ihmisinsuliinin farmakokinetiikkaprofiilit tyypin 1 diabeteksen potilailla annoksen ollessa 0,15 yksikköä / kg.
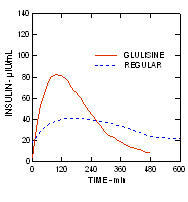
Glulisinsuliini -insuliinia ja tavallista ihmisinsuliinia annettiin ihonalaisesti annoksena 0,2 yksikköä / kg yksikössä euglykeeminen puristustutkimus potilailla, joilla on tyypin 2 diabetes (n = 24) ja ruumiin massaindeksi (BMI) välillä 20 - 36 kg / m2. Keskimääräinen aika maksimipitoisuuteen (Tmax) oli 100 minuuttia (alue 40 - 120 minuuttia) ja mediaani huippupitoisuus (Cmax) oli 84 mikroyksikköä / ml (alue 53 - 165 mikroyksikköä / ml). glulisiiniinsuliinilla verrattuna normaaliin ihmisinsuliiniin keskimäärin Tmax-arvoon 240 minuuttia (alue 80 - 360 minuuttia) ja mediaaniin Cmax 41 mikroyksikköä / ml (alue 33 - 61 mikroyksikköä / ml). (Kuva 3.)
Kuvio 3. Glulisinsuliinin ja tavallisen ihmisinsuliinin farmakokinetiikkaprofiilit tyypin 2 diabeteksen potilailla ihonalaisen annoksen ollessa 0,2 yksikköä / kg.
Kun Apidraa injektoitiin ihonalaisesti kehon eri alueille, aikapitoisuusprofiilit olivat samanlaiset. Glulisiiniinsuliinin absoluuttinen biologinen hyötyosuus ihon alle annon jälkeen on noin 70% injektiopinnasta riippumatta (vatsa 73%, deltoid 71%, reisi 68%).
Terveillä vapaaehtoisilla (n = 32) tehdyssä kliinisessä tutkimuksessa glulisiininsuliinin kokonaistaloudellinen hyötyosuus oli samanlainen ihon alle. injektio glulisiini- ja NPH-insuliinia (esisekoitettu ruiskuun) ja erillisen samanaikaisen ihonalaisen injektion jälkeen injektiot. Apidran enimmäispitoisuus (Cmax) heikentyi 27% esisekoituksen jälkeen; aika maksimipitoisuuteen (Tmax) ei kuitenkaan vaikuttanut. Apidran sekoittamisesta muiden kuin NPH-insuliinien kanssa ei ole tietoa. [See Kliiniset tutkimukset].
Jakelu ja eliminointi
Glulisiininsuliinin ja tavallisen ihmisinsuliinin jakautuminen ja eliminaatio laskimonsisäisen annon jälkeen annostelu on samanlainen jakautumistilavuuksien ollessa 13 ja 21 litraa ja puoliintumisaikojen ollessa 13 ja 17 minuutin, vastaavasti. Ihonalaisen annon jälkeen glulisiini-insuliini eliminoituu nopeammin kuin tavallinen ihmisinsuliini, sen puoliintumisaika on 42 minuuttia verrattuna 86 minuuttiin.
Kliininen farmakologia tietyillä populaatioilla
Pediatriset potilaat
Apidran ja tavallisen ihmisinsuliinin farmakokineettisiä ja farmakodynaamisia ominaisuuksia arvioitiin a tutkimus, joka tehtiin 7–11-vuotiailla lapsilla (n = 10) ja 12–16-vuotiailla nuorilla (n = 10) tyypin 1 kanssa diabetes. Apidran ja tavanomaisen ihmisinsuliinin farmakokinetiikan ja farmakodynamiikan suhteelliset erot vuonna 2006 nämä tyypin 1 diabeteksen potilaat olivat samanlaisia kuin terveillä aikuisilla ja tyypin 1 aikuisilla diabetes.
Rotu
24 terveellä valkoihoisella ja japanilaisella koehenkilöllä tehdyssä tutkimuksessa verrattiin glulisiininsuliinin, lisproinsuliinin ja tavallisen ihmisinsuliinin ihonalaisen injektion jälkeen suoritettua farmakokinetiikkaa ja farmakodynamiikkaa. Sublutaanisella glulisiininsuliinin injektiolla japanilaisten koehenkilöiden aloitusaltistus oli suurempi (33%) suhteessa AUC: iin (0 - 1 h) ja AUC: iin (0-kiinnityspää) kuin valkoihoisiin (21%), vaikka kokonaisaltistukset olivat samankaltaisia. Lisproinsuliinilla ja tavallisella ihmisinsuliinilla oli samanlaisia havaintoja.
liikalihavuus
Glulisuliininsuliinia ja tavallista ihmisinsuliinia annettiin ihonalaisesti annoksena 0,3 yksikköä / kg yksikössä euglykeeminen puristustutkimus lihavilla, ei-diabeettisilla henkilöillä (n = 18), joiden painoindeksi (BMI) on välillä 30–40 kg / m2. Keskimääräinen aika maksimipitoisuuteen (Tmax) oli 85 minuuttia (alue 49 - 150 minuuttia) ja keskimääräinen huippupitoisuus (Cmax) oli 192 mikroyksikköä / ml (alue 98 - 380 mikroyksikköä / ml). glulisiininsuliinilla verrattuna mediaanin Tmax-arvoon 150 minuuttia (vaihteluväli 90 - 240 minuuttia) ja keskimääräiseen Cmax-arvoon 86 mikroyksikköä / ml (alue 43 - 175 mikroyksikköä / ml) normaaleille ihmisille insuliini.
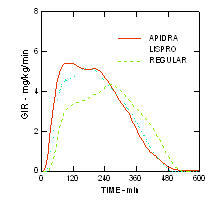
Apidran ja lisproinsuliinin nopeampi toiminnan alkaminen ja lyhyempi vaikutuksen kesto verrattuna tavanomaiseen ihmisinsuliiniin ylläpidettiin liikalihamattomassa ei-diabeettisessa populaatiossa (n = 18). (Kuva 4.)
Kuvio 4. Glukoosi-infuusionopeudet (GIR) euglykeemisessä puristustutkimuksessa ihon alle injektoinnin jälkeen 0,3 yksikköä / kg Apidraa, lisproinsuliinia tai tavallista ihmisinsuliinia lihavilla potilailla.
Munuaisten vajaatoiminta
Ihmisinsuliinilla tehdyt tutkimukset ovat osoittaneet kohonneiden insuliinitasojen nousua munuaisten vajaatoimintaa sairastavilla potilailla. Tutkimuksessa, joka tehtiin 24 muulle kuin diabeetikolle, joilla oli normaali munuaisten toiminta (ClCr> 80 ml / min), kohtalainen munuaisten vajaatoiminta (30-50 ml / min) ja vaikea munuaisten vajaatoiminta (Varoitukset ja varotoimet).
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta Apidran farmakokinetiikkaan ja farmakodynamiikkaan ei ole tutkittu. Jotkut tutkimukset ihmisinsuliinilla ovat osoittaneet kohonneiden insuliinitasojen maksan vajaatoimintaa sairastavilla potilailla. [See Varoitukset ja varotoimet].
sukupuoli
Sukupuolen vaikutusta Apidran farmakokinetiikkaan ja farmakodynamiikkaan ei ole tutkittu.
raskaus
Raskauden vaikutusta Apidran farmakokinetiikkaan ja farmakodynamiikkaan ei ole tutkittu.
Tupakointi
Tupakoinnin vaikutusta Apidran farmakokinetiikkaan ja farmakodynamiikkaan ei ole tutkittu.
ylin
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kahden vuoden tavanomaisia karsinogeenisuustutkimuksia eläimillä ei ole tehty. Sprague Dawley -rotilla tehtiin 12 kuukauden toistuvan annoksen toksisuustutkimus glulisinsuliinilla subkutaanisilla annoksilla 2,5, 5, 20 tai 50 yksikköä / kg kahdesti päivässä (annos, joka johtaa altistumiseen 1, 2, 8 ja 20 kertaa ihmisen keskimääräinen annos ruumiin pinta-alan perusteella vertailu).
Naisilla rotilla, joille annettiin glulisiininsuliinia, oli rintarauhaskasvaimista suurempi kuin annoksesta riippumaton verrattuna käsittelemättömiin vertailuryhmiin. Rintasyöpäkasvaimien esiintyvyys glulisinsuliini- ja tavallisen ihmisinsuliinin suhteen oli samanlainen. Näiden havaintojen merkitystä ihmisille ei tunneta. Glulisinsuliininsuliini ei ollut mutageeninen seuraavissa kokeissa: Ames-testi, nisäkkäiden kromosomi in vitro aberraatiokoe V79-kiinalaishamsterin soluissa ja in vivo nisäkkäiden erytrosyyttien mikrotuumakoe rottia.
Uros- ja naarasrotilla tehdyissä hedelmällisyyskokeissa ihonalaisina annoksina korkeintaan 10 yksikköä / kg kerran päivässä (annos johtaa altistumiseen 2 kertaa keskimääräinen ihmisen annos annoksella kehon pinta-alavertailun perusteella), mitään selviä haittavaikutuksia urosten ja naisten hedelmällisyyteen tai eläinten yleiseen lisääntymiskykyyn ei havaittu havaittu.
ylin
Kliiniset tutkimukset
Apidran turvallisuutta ja tehoa tutkittiin aikuisilla potilailla, joilla oli tyypin 1 ja tyypin 2 diabetes (n = 1833), ja lapsilla ja murrosikäisillä potilailla (4 - 17 vuotta), joilla oli tyypin 1 diabetes (n = 572). Ensisijainen tehoparametri näissä kokeissa oli glykeeminen kontrolli, arvioituna glykoituneella hemoglobiinilla (GHb ilmoitettiin HbA1c-ekvivalenttina).
Tyypin 1 diabetes aikuiset
Tyypin 1 diabeteksen potilaille tehtiin 26 viikon satunnaistettu, avoin, aktiivisesti kontrolloitu, ei-ala-arvoisuus -tutkimus Apidran (n = 339) turvallisuus ja tehokkuus verrattuna lisproinsuliiniin (n = 333) annettuna ihonalaisesti 15 minuutin kuluessa ennen ateria. Glargiiniinsuliini annettiin kerran päivässä iltaisin perusinsuliinina. Lisproinsuliinilla ja glargininsuliinilla oli 4 viikon sisäänajo ennen satunnaistamista. Suurin osa potilaista oli valkoihoisia (97%). 58 prosenttia potilaista oli miehiä. Keskimääräinen ikä oli 39 vuotta (vaihteluväli 18-74 vuotta). Glykeeminen kontrolli, päivittäisten lyhytvaikutteisten insuliini-injektioiden lukumäärä sekä Apidran ja lisproinsuliinin päivittäiset kokonaisannokset olivat samanlaiset molemmissa hoitoryhmissä (taulukko 6).
Taulukko 6: Tyypin 1 diabeteksen myrkytys - aikuinen
| Hoidon kesto Hoito yhdessä: |
26 viikkoa Glargininsuliini |
|
|---|---|---|
| Apidra | Insuliini Lispro | |
| ||
| Glykoitunut hemoglobiini (GHb)* (%) | ||
| Potilaiden lukumäärä | 331 | 322 |
| Perustaso tarkoittaa | 7.6 | 7.6 |
| Oikaistu keskimääräinen muutos lähtötasosta | -0.1 | -0.1 |
| Hoitoero: Apidra - Insuliini Lispro | 0.0 | |
| 95%: n luotettavuusluku hoitoeron suhteen | (-0.1; 0.1) | |
| Perusinsuliiniannos (yksikköä / päivä) | ||
| Perustaso tarkoittaa | 24 | 24 |
| Oikaistu keskimääräinen muutos lähtötasosta | 0 | 2 |
| Lyhytvaikutteinen insuliiniannos (yksikköä / päivä) | ||
| Perustaso tarkoittaa | 30 | 31 |
| Oikaistu keskimääräinen muutos lähtötasosta | -1 | -1 |
| Lyhytvaikutteisten insuliini-injektioiden keskimääräinen lukumäärä päivässä | 3 | 3 |
| Paino (kg) | ||
| Perustaso tarkoittaa | 73.9 | 74.1 |
| Keskimääräinen muutos lähtötasosta | 0.6 | 0.3 |
Tyypin 2 diabetes - aikuiset
Insuliinilla hoidetuilla tyypin 2 diabeetikoilla suoritettiin 26 viikon satunnaistettu, avoin, aktiivisesti kontrolloitu, ei-ala-arvoisuus -tutkimus 15 minuutin sisällä ennen ateriaa annetun Apidran (n = 435) turvallisuus ja tehokkuus verrattuna tavanomaiseen ihmisinsuliiniin (n = 441), joka annettiin 30–45 minuuttia ennen ateria. Ihmisen NPH-insuliinia annettiin kahdesti päivässä perusinsuliinina. Kaikki potilaat osallistuivat 4 viikon sisäänajoon tavallisella ihmisinsuliinilla ja NPH-ihmisinsuliinilla. 85 prosenttia potilaista oli valkoihoisia ja 11% mustia. Keskimääräinen ikä oli 58 vuotta (vaihteluväli 26-84 vuotta). Keskimääräinen kehon massaindeksi (BMI) oli 34,6 kg / m2. Satunnaistamisessa 58% potilaista käytti suun kautta annettavaa diabeteslääkettä. Näitä potilaita kehotettiin jatkamaan suun kautta otettavan diabeteslääkkeen käyttöä samassa annoksessa koko tutkimuksen ajan. Suurin osa potilaista (79%) sekoitti lyhytvaikutteisen insuliininsa NPH-ihmisinsuliiniin välittömästi ennen injektiota. GHb: n vähennykset lähtötasosta olivat samanlaisia kahden hoitoryhmän välillä (katso taulukko 7). Apidran ja tavanomaisten ihmisinsuliiniryhmien välillä ei havaittu eroja päivittäisissä lyhytvaikutteisten insuliinin injektioiden lukumäärässä tai perus- tai lyhytvaikutteisissa insuliiniannoksissa. (Katso taulukko 7.)
Taulukko 7: Tyypin 2 diabetes Mellitus-Adult
| Hoidon kesto | 26 viikkoa | |
|---|---|---|
| Hoito yhdessä: | NPH-ihmisinsuliini | |
| Apidra | Normaali ihmisen insuliini | |
| ||
| Glykoitunut hemoglobiini (GHb)* (%) | ||
| Potilaiden lukumäärä | 404 | 403 |
| Perustaso tarkoittaa | 7.6 | 7.5 |
| Oikaistu keskimääräinen muutos lähtötasosta | -0.5 | -0.3 |
| Hoitoero: Apidra - säännöllinen ihmisen insuliini | -0.2 | |
| 95%: n luotettavuusluku hoitoeron suhteen | (-0.3; -0.1) | |
| Perusinsuliiniannos (yksikköä / päivä) | ||
| Perustaso tarkoittaa | 59 | 57 |
| Oikaistu keskimääräinen muutos lähtötasosta | 6 | 6 |
| Lyhytvaikutteinen insuliiniannos (yksikköä / päivä) | ||
| Perustaso tarkoittaa | 32 | 31 |
| Oikaistu keskimääräinen muutos lähtötasosta | 4 | 5 |
| Lyhytvaikutteisten insuliini-injektioiden keskimääräinen lukumäärä päivässä | 2 | 2 |
| Paino (kg) | ||
| Perustaso tarkoittaa | 100.5 | 99.2 |
| Keskimääräinen muutos lähtötasosta | 1.8 | 2.0 |
Tyypin 1 diabeteksen aikuiset: Anto ennen ateriaa ja sen jälkeen
12 viikon satunnaistettu, avoin, aktiivisesti kontrolloitu, ei-ala-arvoisuus -tutkimus tehtiin potilaille, joilla oli tyypin 1 diabetes, jotta voidaan arvioida Apidran turvallisuutta ja tehokkuutta eri aikoina suhteessa a ateria. Apidra annettiin ihonalaisesti joko 15 minuutissa ennen ateriaa (n = 286) tai heti a ateria (n = 296) ja tavallista ihmisinsuliinia (n = 278) annettiin ihonalaisesti 30 - 45 minuuttia ennen ateria. Glargiiniinsuliini annettiin kerran päivässä nukkumaan mennessä perusinsuliinina. Tavanomaisella ihmisinsuliinilla ja glargininsuliinilla oli 4 viikon sisäänajo, jota seurasi satunnaistaminen. Suurin osa potilaista oli valkoihoisia (94%). Keskimääräinen ikä oli 40 vuotta (vaihteluväli 18 - 73 vuotta). Glykeeminen kontrolli (katso taulukko 8) oli vertailukelpoinen kolmella hoito-ohjelmalla. Lyhytvaikutteisten insuliini-injektioiden päivittäisessä kokonaismäärässä ei havaittu muutoksia hoidon välillä lähtötasosta. (Katso taulukko 8.)
Taulukko 8: Ateria ennen ja jälkeen aterian tyypin 1 diabeteksen Mellitus-aikuisella
| Hoidon kesto Hoito yhdessä: |
12 viikkoa glargininsuliini |
12 viikkoa glargininsuliini |
12 viikkoa glargininsuliini |
|---|---|---|---|
| Apidra pre ateria |
Apidra post ateria |
Normaali ihmisen insuliini | |
| |||
| Glykoitunut hemoglobiini (GHb)* (%) | |||
| Potilaiden lukumäärä | 268 | 276 | 257 |
| Perustaso tarkoittaa | 7.7 | 7.7 | 7.6 |
| Oikaistu keskimääräinen muutos lähtötasosta†| -0.3 | -0.1 | -0.1 |
| Perusinsuliiniannos (yksikköä / päivä) | |||
| Perustaso tarkoittaa | 29 | 29 | 28 |
| Oikaistu keskimääräinen muutos lähtötasosta | 1 | 0 | 1 |
| Lyhytvaikutteinen insuliiniannos (yksikköä / päivä) | |||
| Perustaso tarkoittaa | 29 | 29 | 27 |
| Oikaistu keskimääräinen muutos lähtötasosta | -1 | -1 | 2 |
| Lyhytvaikutteisten insuliini-injektioiden keskimääräinen lukumäärä päivässä | 3 | 3 | 3 |
| Paino (kg) | |||
| Perustaso tarkoittaa | 79.2 | 80.3 | 78.9 |
| Keskimääräinen muutos lähtötasosta | 0.3 | -0.3 | 0.3 |
Tyypin 1 diabeteksen lapsipotilaat
26-viikon satunnaistettu, avoin, aktiivisesti kontrolloitu, ei-ala-arvoisuus -tutkimus suoritettiin yli 4-vuotiailla lapsilla ja murrosikäisillä tyypin 1 kanssa diabetes mellitus Apidran (n = 277) turvallisuuden ja tehon arvioimiseksi verrattuna lisproinsuliiniin (n = 295) annettuna ihon alle 15 minuutin kuluessa ennen ateria. Potilaat saivat myös glargiiniinsuliinia (annettiin kerran päivässä illalla) tai NPH-insuliinia (annettiin kerran aamulla ja kerran illalla). Lisproinsuliinilla ja glargininsuliinilla tai NPH: lla oli 4 viikon sisäänajo ennen satunnaistamista. Suurin osa potilaista oli valkoihoisia (91%). Viisikymmentä prosenttia potilaista oli miehiä. Keskimääräinen ikä oli 12,5 vuotta (vaihteluväli 4-17 vuotta). Keskimääräinen BMI oli 20,6 kg / m2. Glykeeminen kontrolli (katso taulukko 9) oli vertailukelpoinen kahdella hoitomenetelmällä.
Taulukko 9: Tulokset 26 viikon tutkimuksesta lapsipotilailla, joilla on tyypin 1 diabetes mellitus
| Apidra | lispro | |
|---|---|---|
| Potilaiden lukumäärä | 271 | 291 |
| Perusinsuliini | NPH tai glargininsuliini | NPH tai glargininsuliini |
| ||
| Glykoitunut hemoglobiini (GHb)* (%) | ||
| Perustaso tarkoittaa | 8.2 | 8.2 |
| Oikaistu keskimääräinen muutos lähtötasosta | 0.1 | 0.2 |
| Hoitoero: Keskimääräinen (95%: n luottamusväli) | -0.1 (-0.2, 0.1) | |
| Perusinsuliiniannos (yksikköä / kg / päivä) | ||
| Perustaso tarkoittaa | 0.5 | 0.5 |
| Keskimääräinen muutos lähtötasosta | 0.0 | 0.0 |
| Lyhytvaikutteinen insuliiniannos (yksikköä / kg / päivä) | ||
| Perustaso tarkoittaa | 0.5 | 0.5 |
| Keskimääräinen muutos lähtötasosta | 0.0 | 0.0 |
| Lyhytvaikutteisten insuliini-injektioiden keskimääräinen lukumäärä päivässä | 3 | 3 |
| Perustaso keskimääräinen ruumiinpaino (kg) | 51.5 | 50.8 |
| Painon keskimääräinen muutos lähtötasosta (kg) | 2.2 | 2.2 |
Tyypin 1 diabeteksen aikuiset: Jatkuva ihonalainen insuliini-infuusio
12 viikon satunnaistettu, aktiivinen kontrollitutkimus (Apidra vs. aspartinsuliini) aikuisilla, joilla oli tyypin 1 diabetes (Apidra n = 29, aspartinsuliini n = 30) arvioi Apidran käytön jatkuvassa ulkoisessa ihonalaisessa insuliinissa pumppu. Kaikki potilaat olivat valkoihoisia. Keskimääräinen ikä oli 46 vuotta (vaihteluväli 21–73 vuotta). Keskimääräinen GHb nousi lähtötasosta päätepisteeseen molemmissa hoitoryhmissä (6,8%: sta 7,0%: iin Apidran kohdalla; aspartinsuliinista 7,1% - 7,2%).
ylin
Kuinka toimitetaan / varastointi ja käsittely
Kuinka toimitetaan
| |
| Apidra 100 yksikköä / ml (U-100) on saatavana: | |
| 10 ml injektiopulloja | NDC 0088-2500-33 |
| 3 ml: n patruunajärjestelmä*, pakkaus 5 | NDC 0088-2500-52 |
| 3 ml SoloStar-esitäytettyä kynää, 5 kpl pakkaus | NDC 0088-2502-05 |
Kynän neulat eivät sisälly pakkauksiin.
OptiClik: n kanssa käytettävät BD Ultra-Fine ™ -kynän neulat1 myydään erikseen ja niitä valmistaa Becton Dickinson and Company.
Solostar on yhteensopiva kaikkien Becton Dickinson and Company, Ypsomed ja Owen Mumford -kynäjen neulojen kanssa.
varastointi
Älä käytä viimeisen käyttöpäivämäärän jälkeen (katso pakkaus ja pakkaus).
Avaamaton injektiopullo / patruunajärjestelmä / SoloStar
Avaamattomat Apidra-injektiopullot, patruunajärjestelmät ja SoloStar on säilytettävä jääkaapissa (2 ° C - 8 ° C). Suojaa valolta. Apidraa ei tule säilyttää pakastimessa, eikä sitä saa antaa jäätyä. Hävitä, jos se on jäätynyt.
Avaamattomat injektiopullot / patruunajärjestelmät / SoloStar, jota ei ole säilytetty jääkaapissa, on käytettävä 28 päivän kuluessa.
Avaa (käytössä) injektiopullo:
Avatut injektiopullot, myös jäähdytettyinä, on käytettävä 28 päivän kuluessa. Jos jäähdytys ei ole mahdollista, käytössä olevaa avointa injektiopulloa voidaan pitää jäädyttämättä 28 päivän ajan poissa suorasta lämmöstä ja valosta, kunhan lämpötila ei ole yli 25 ° C.
Avoin (käytössä) patruunajärjestelmä:
OptiClik®: iin asetettua avattua (käytössä olevaa) patruunajärjestelmää EI pidä jäähdyttää, vaan se tulisi pitää 25 ° C: n lämpötilassa poissa suorasta kuumuudesta ja valosta. Avattu (käytössä) patruunajärjestelmä on hävitettävä 28 päivän kuluttua. Älä säilytä OptiClik®-laitetta, joko patruunajärjestelmän kanssa tai ilman, jääkaapissa milloin tahansa.
Avoin (käytössä) SoloStar-esitäytetty kynä:
Avattua (käytössä) SoloStar-laitetta EI pidä jäähdyttää, vaan se tulisi pitää alle 25 ° C: n lämpötilassa poissa suorasta kuumuudesta ja valosta. Huoneenlämpötilassa pidetty avattu (käytössä) SoloStar on hävitettävä 28 päivän kuluttua.
Infuusiosetit:
Infuusioyksiköt (säiliöt, letkut ja katetrit) ja säiliössä oleva Apidra on hävitettävä 48 tunnin käytön jälkeen tai sen jälkeen, kun lämpötila on yli 98 ° F (37 ° C).
Laskimonsisäinen käyttö:
Infuusiopussit, jotka on valmistettu kohdan 3.2 mukaisesti ANNOSTELU JA HALLINNOINTI ovat stabiileja huoneenlämpötilassa 48 tuntia.
Valmistelu ja käsittely
Laskimoon annettavan laimennoksen jälkeen liuos on tarkastettava silmämääräisesti hiukkasten ja värimuutosten varalta ennen antamista. Älä käytä liuosta, jos se on muuttunut sameaksi tai sisältää hiukkasia; Käytä vain, jos se on kirkasta ja väritöntä. Apidra ei ole yhteensopiva dekstroosi- ja Ringers-liuoksen kanssa, joten sitä ei voida käyttää näiden liuosnesteiden kanssa. Apidran käyttöä muiden liuosten kanssa ei ole tutkittu, joten sitä ei suositella.
Patruunajärjestelmä: Jos OptiClik® (Apidran insuliinin annostelulaite) on toimintahäiriö, Apidra voidaan vetää patruunajärjestelmästä U-100-ruiskuun ja pistää.
Apidra, glusiiniinsuliini, potilastiedot (selkeästi englanniksi)
viimeksi päivitetty: 02/2009
Yksityiskohtaiset tiedot diabeteksen oireista, oireista, syistä ja hoidoista
Tämän monografian tietoja ei ole tarkoitettu kattamaan kaikkia mahdollisia käyttötarkoituksia, ohjeita, varotoimenpiteitä, lääkkeiden yhteisvaikutuksia tai haitallisia vaikutuksia. Nämä tiedot ovat yleisiä, eikä niitä ole tarkoitettu erityisiksi lääketieteellisiksi ohjeiksi. Jos sinulla on kysyttävää käyttämistäsi lääkkeistä tai haluat lisätietoja, kysy lääkäriltäsi, apteekista tai sairaanhoitajalta.
takaisin: Selaa kaikkia diabeteksen lääkkeitä



